拟南芥铜锌超氧化物歧化酶解聚的中间态性质
刘祚军,黄胜威,李明浩,吴丽芳
(1. 中国科学院 合肥物质科学研究院, 合肥 230031; 2. 中国科学院大学, 北京 100049; 3. 安徽省农业科学院 农业工程研究所, 合肥 230001)
植物在受到外界环境胁迫时产生应激反应,并通过产生活性氧建立防御机制。然而,活性氧的产生是不可控的,过量的活性氧又会引起对植物体蛋白质、脂类、核酸等的损伤[1]。超氧化物歧化酶(Superoxide dismutase,SOD)是一类广泛存在的金属酶,负责清除生物体内有害的活性氧,被认为是衡量植物抗逆性状的一种重要指标蛋白[2-3]。根据活性中心结合金属离子的不同,SOD分为铜锌超氧化物歧化酶(Cu, Zn superoxide dismutase, Cu, Zn-SOD)、铁超氧化物歧化酶(Fe superoxide dismutase,Fe-SOD)、锰超氧化物歧化酶(Mn superoxide dismutase,Mn-SOD)和镍超氧化物歧化酶(Ni superoxide dismutase,Ni-SOD)等4类。其中,在高等植物中,Cu, Zn-SOD在体内含量最高、分布也最为普遍,因此,其相关研究具有重要的理论和农业生产意义[4]。
拟南芥(Arabidopsisthaliana)是重要的模式生物,已发现有7个SOD酶,其中,拟南芥铜锌超氧化物歧化酶(Arabidopsisthalianasuperoxide dismutase 1,AtSOD1)被推测为一个大小为32 ku的同源二聚体,是理想的研究植物SOD酶结构与功能关系的模式蛋白[5-6]。
目前,对AtSOD1的研究仍不够深入,因此其在体内表达调控机制依旧不明[7]。其主要原因有两个方面:一是生物体内条件复杂,导致机理研究困难;二是对于该酶本身的性质,如稳定性、活性特别是结构与活性的关系等基本信息了解不够充分,这在很大程度上限制了相关研究的开展。本研究结合圆二色谱(Circular dichroism,CD)、差示扫描量热法(Differential scanning calorimetry,DSC)、电子顺磁共振波谱(Electron paramagnetic resonance,EPR)等方法对AtSOD1酶的基本性质进行表征,以期为AtSOD1酶结构与功能以及金属配位结构研究提供方法学和数据支撑。
1 材料与方法
1.1 AtSod1的克隆、表达与蛋白质纯化
采集拟南芥新鲜嫩叶(约40 d) 50~100 mg,按照 Trizol RNAiso Plus 试剂盒说明书提取总RNA,以总RNA为模板,利用Super Script II反转录试剂盒获得cDNA,再以此为模板,根据AtSod1(NCBI 序列号:X60935.1)的序列设计引物(正义引物:5′-GGAATTCCATATGGCGAAAGGAGTTGCAGT-3′;反义引物:5′-CCCAAGCTTTTAGCCCTGGAGACCAATGA-3′),扩增AtSod1,将扩增片段克隆到pET-28a载体(Novagen),转化大肠杆菌Rosseta菌株,28 ℃,培养至OD600约0.8时,1 mmol/L IPTG诱导表达6 h后,超声破碎,取上清液,蛋白质经Ni-NTA树脂(Novagen)亲和层析和HiprepTm16/60 SephacrylTmS-200 HR分子筛纯化,透析处理浓缩后用于后续分析。
1.2 AtSOD1的浓度和Km值测定
使用改良型 Bradford 法蛋白浓度测定试剂盒(上海生工,产品编号C503041)进行蛋白浓度的测定。595 nm处测定吸光度值,做标准曲线,计算蛋白质的浓度。具体方案详见产品说明书。

Km测定:酶的浓度不变,通过改变底物自由基的量来测定。Km值等于酶促反应速度达到最大反应速度一半时所对应的底物浓度。
1.3 AtSOD1的活性中心金属配位表征
利用电子顺磁共振技术测定SOD酶的活性中心Cu的配位结构[8]。样品质量浓度根据SOD酶中的铜离子含量而定,一般不低于0.5 mg/mL即可。样品要在液氦温度20 K测定,X波段,微波功率6.33 mW,微波频率9.39 GHz,磁场调频100 KHz,磁场调幅1~10 Gs(视样品情况而定,通常5 Gs),扫描时间24 s,扫描次数1~20次(视样品情况而定,通常10次)。
1.4 AtSOD1的化学稳定性分析
利用尿素(Urea)对SOD酶进行化学解叠,以圆二色谱来测定二级结构的变化,分析其化学稳定性。具体方法为,先根据蛋白的浓度,设置一定的梯度,将蛋白的CD初始峰值设置在-30~-20为宜,便于下一步结构解叠时的观察。尿素解叠蛋白反应的总体积为500 μL,SOD酶的浓度恒定,尿素浓度设置合理的梯度(0~8 mol/L),余下的体积由buffer补平。扫描时,采取较慢的扫描速度和较长的响应时间提高信噪比。
1.5 AtSOD1的物理稳定性分析
利用差示扫描量热仪法测定SOD样品。该方法中,质量浓度要求5 mg/mL以上,温度先升到120 ℃,然后缓慢降到25 ℃,在降温过程中观察比热容值的变化,计算蛋白质处于中间态时的Tm值。
2 结果与分析
2.1 AtSOD1的表达与纯化
经预测分析,AtSOD1经pET-28a载体表达后,氨基酸数目为172个,分子质量约18 ku,等电点为6.05。诱导表达后,经鉴定目标酶蛋白主要在上清液中,因此取上清液用于下一步的亲和层析。亲和层析结果显示,杂蛋白带明显。因此进一步进行分子筛纯化,获得目标酶蛋白(图1)。
2.2 AtSOD1的含量与Km值测定
经测定蛋白质的质量浓度,制定了标准曲线,相应的方程为Y=0.005 73X。
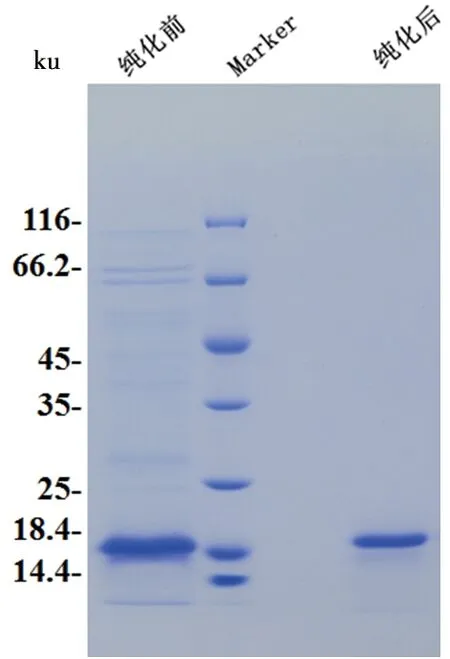
图1 AtSOD1的分子筛纯化结果
通过黄嘌呤氧化酶体系测试了SOD的酶催化动力学,相应的酶的米氏常数为km=0.2 μmol/L,具体见图2。
2.3 AtSOD1的活性中心金属配位表征
Cu, Zn-SOD酶在进化上比较保守,分子中的Cu为二价,具有顺磁性[4]。AtSOD1的低温EPR结果显示,其具有典型的二价铜的特征峰,不过信号比较弱。将蛋白浓缩至10 mg/mL左右时,信号并没有明显的增强,表明AtSOD1中铜离子的含量很低。
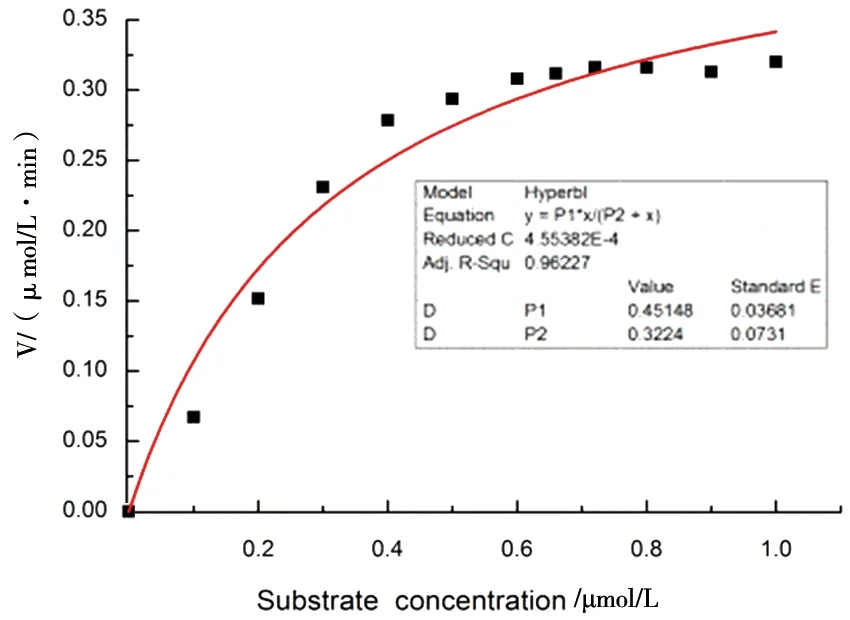
图2 AtSOD1的Km值
细胞中的铜离子90%结合到铜蓝蛋白中,极少以游离的一价铜存在[9]。在真核生物中,Cu, Zn-SOD的成熟需要铜转运蛋白(Copper chaperone for superoxide dismutase1,CCS)作为伴侣分子。该蛋白可以通过和SOD酶间的相互作用来传递铜到达它的目的地,并帮助SOD酶正确折叠具备催化活性[10]。
Cu, Zn-SOD在酵母表达时,由于本身具有CCS蛋白,因此很容易表达出折叠正确的活性蛋白[11]。而在大肠杆菌中,由于本身不含CCS蛋白,因此表达出来的SOD酶生物活性往往很低,不过,通过共表达CCS蛋白也可以表达出活性Cu, Zn-SOD[10]。
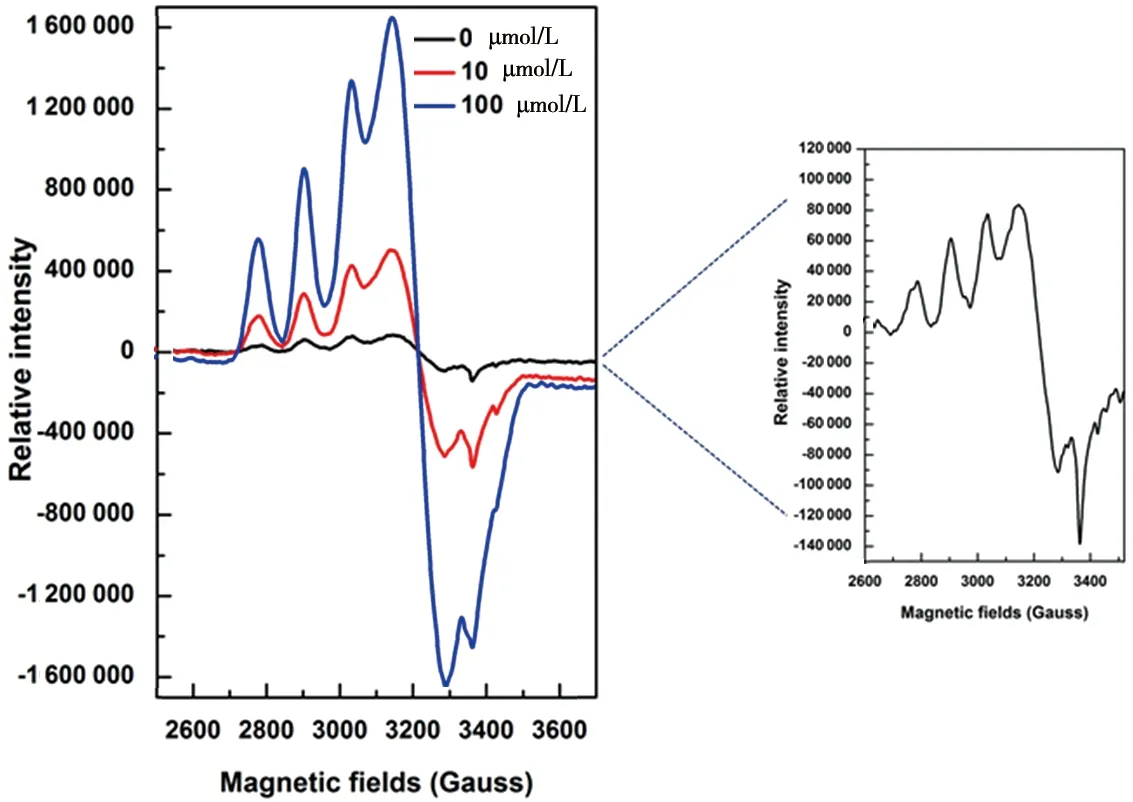
图3 外源铜锌离子影响活性AtSOD1酶表达的EPR表征
分别通过向培养基中补充终浓度10 μmol/L CuSO4、4 μmol/L Zn (NO3)2和100 μmol/L CuSO4、40 μmol/L Zn (NO3)2两个梯度,诱导表达AtSOD1[4]。提取纯化后,将蛋白质浓度校准为500 μg/mL,进行低温EPR检测,结果(图3)发现,随着外源补充金属离子浓度的增加,EPR信号依次增强,显示正相关性。EPR拟合结果显示,关键参数g值没有发生改变,说明Cu2+正确结合到SOD中。
2.4 AtSOD1的化学稳定性
分别以天然态AtSOD1(holo态)和去除金属离子的AtSOD1(apo态)为研究对象,利用尿素(Urea)对SOD酶进行化学解折叠,然后通过测定其CD结构的变化来对它的稳定性进行表征。结果显示,解折叠态与holo态相比,α-螺旋的比例由13.6% 增至30.9%,β-折叠由43.6%降为0.0%,β-转角由原来的 11.6%增加至37.5%。结果表明,对于AtSOD1来说,β-折叠是维持蛋白质结构稳定性的重要因素[12]。
以往研究[13-14]表明,SOD酶尿素解折叠反应时,与apo态相比,holo态的二级结构对尿素不敏感。本研究表明,利用尿素处理AtSOD1,不论是apo态还是holo态,解折叠曲线均发生了明显的向长波方向的红移现象,即β-折叠比例减少,α-螺旋增加,且在225 nm附近出现了一个拐点(图4)。进一步分析0~8 mol/L尿素处理AtSOD1后225 nm处波长的变化。结果显示,apo态AtSOD1加入一定浓度的尿素后,迅速解折叠,这可能与失去金属离子后AtSOD1的稳定性下降有关[13]。而holo态AtSOD1尿素处理结果显示,在尿素浓度达到4~5 mol/L时,解折叠曲线出现了平台期,这在以往的文献中未见报道(图5)。推测认为该平台期与holo态AtSOD1二聚体解聚为单体的过程有一定的关联。
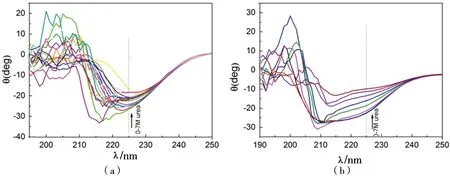
(a)holo态的解折叠结果;(b)apo态解折叠的结果。二者皆在约225 nm处出现拐点

A:holo态AtSOD1;B:apo态AtSOD1
2.5 AtSOD1的物理稳定性
研究表明,Cu, Zn-SOD酶耐高温,在75 ℃时,构象不发生明显变化,但仍具有酶的催化活性,一般认为与金属离子Cu2+和Zn2+的存在有关[13]。比热容是热力学中常用的一个物理概念,是单位质量物质的热容量,即单位质量物体改变单位温度时吸收或放出的热量,属于物质本身的属性,具有指纹属性。对于蛋白质来说,每一个比热容值对应着相应的相对稳定的构象,Tm值是处在两种状态之间的中间态,Tm值越低,某种程度上意味着稳定性越差[15]。
将AtSOD1加入DSC仪中,迅速升温到120 ℃,然后缓慢降到25 ℃,观察Tm值的变化(图6)。结果显示,对于 holo态AtSOD1来说,存在两个Tm值,分别为102.2 ℃和100.5 ℃,前一个值反映了AtSOD1完全解折叠的状态,另一个Tm值反映了AtSOD1的何种结构状态仍不得而知。对人类和牛的SOD1的DSC研究显示,holo态的Tm值为92 ℃和96 ℃,apo态的Tm值为54 ℃和50 ℃[16-17]。上述结果和AtSOD1的结果非常类似,区别在于holo态AtSOD1的结果出现了比邻的双峰。结合尿素解折叠AtSOD1的CD结果来看,该Tm值可能与CD二级结构平台期的结果互为呼应,故进一步认为这些结果反映了SOD蛋白质从二聚体解聚为单体过程中的一个中间态。此外,对于apo态AtSOD1来说,Tm值为54.6 ℃,说明去除金属离子后,酶的稳定下降。以二硫苏糖醇(DTT)还原二硫键后,apo态AtSOD1的Tm值进一步下降为46.5 ℃,这表明金属离子和链间二硫键是SOD结构稳定的重要因素[13]。

reduced-apo态为二硫键被还原的apo蛋白
3 结论
本研究重点对At-SOD1酶的化学和物理稳定性进行了表征,发现了该酶由二聚体解折叠为单体过程中的一个中间态,且CD结果和DCS结果互为验证。推测认为,该中间态反映了酶由二聚体解聚为单体过程中的特殊状态,该发现尚属首次,其可能对于酶的结构稳定性起着一定的作用。
此外,本研究通过在培养基外源补充二价铜和二价锌离子,获得了具有完整结构的AtSOD1,无须通过铜离子螯合柱亲和层析纯化。纯化的酶蛋白反映出良好EPR光谱特征,满足EPR检测要求,为该酶的后续金属配位研究打下方法学基础。

