基于FOXM1启动子示踪体系对MDA-MB-231细胞亚群的分选与鉴定
汪运超, 李子青, 向 勤, 谭拥军
(湖南大学 生物学院 湖南省抗癌靶向蛋白药物工程研究中心,长沙410082)
叉头框转录因子M1 (Forkhead box M1,FOXM1) 属于Forkhead转录因子超家族,是一种促癌转录因子[1]。FOXM1主要通过调节细胞增殖相关基因的转录,在胚胎发育、组织再生的过程中发挥着关键性的功能[2-3]。近年越来越多的研究表明,FOXM1与肿瘤的发生、发展密切相关,其在肿瘤发生发展中有着重要的功能,包括促进细胞增殖、增强DNA损伤修复、促进肿瘤上皮间质转化(EMT)增加肿瘤转移的可能性、促进肿瘤诱导的血管生长、通过扩增肿瘤相关的干细胞或起始细胞促使肿瘤发生等[4]。目前多项研究发现FOXM1在乳腺癌、卵巢癌、膀胱癌、胃癌、结直肠癌和肺癌等多种人类癌细胞中过表达,而在正常细胞中表达较低甚至不表达。其中FOXM1高表达的乳腺癌往往呈低分化、高度恶性、远处转移等特点,且与多种致瘤信号途径相关,临床预后不佳[5]。但是FOXM1如何调控乳腺癌发生发展的分子机制还有待进一步深入研究。因此,能够为研究FOXM1在乳腺癌发展中的分子机制提供方便有效的细胞模型工具,对了解乳腺癌的复发和转移、确定治疗肿瘤靶点均具有重大意义。
慢病毒载体是近年来才发展的一种基因治疗载体,可在体内较长期的表达[6]。目前来说,绿色荧光蛋白 (Green fluorecent protein, GFP) 是最佳标记分子,具有检测简单、荧光特异性强等优势[7],已大范围应用于体外及活体研究。文中所用的启动子示踪体系具有在细胞内能利用慢病毒能够将自身DNA与宿主染色体整合的优点[8],将某基因的启动子序列与慢病毒自身携带的启动序列相互替换,结合报告基因标记。此方法已经成功地用于人肿瘤干细胞和人诱导多能干细胞的分离[9]。Shan等[10]利用Nanog基因启动子结合报告系统从肝癌细胞中分离并获得了Nanog-和Nanog+细胞亚群。本研究采取了类似的策略,构建了一个用FOXM1启动子介导GFP荧光蛋白表达的慢病毒体系,通过这种体系可以用外源性GFP蛋白表达来追踪内源性FOXM1的表达,并利用GFP蛋白绿色荧光信号对FOXM1表达的细胞进行示踪,旨在为FOXM1作为靶向治疗提供良好的实验基础。
1 材料和方法
1.1 慢病毒载体的构建与鉴定
在 EPD数据库中查找 Promoter-FOXM1序列,并在其5′端和3′端分别加入XholI及XbalI限制性核酸内酶切位点序列,设计引物,具体序列如下:正义链5′-GCGCCTCGAGCATTTGTTTGTTTTGGAGAC-3′;反义链 5′-GCGCTCTAGACGTTAGGCCGTAGCTCCG-3′;引物由上海生工有限公司合成。首先在PCR仪上进行变性、退火、延伸,再利用限制性核酸内切酶XholI和XbalI双酶切pLvx-ef1α-GFP载体过夜。使用T4 DNA连接酶对PCR产物与双酶切后的载体在4 ℃下连接过夜,DH5α感受态进行转化,冰上30 min后在42 ℃下热击90 s,迅速放置于冰上2 min,加1 mL不含抗生素的液体培养基,摇床37 ℃下,扩大培养45 min, 取适量已转化成功的感受态均匀涂在具有抗性的LB固体培养基,37 ℃倒置培养12~16 h。最后挑取单克隆菌落,经双酶切电泳鉴定阳性克隆后,将其鉴定的质粒在生工公司完成测序。将测序正确的菌液加甘油保存,进行质粒大提后用于后续病毒包装的流程。
1.2 细胞培养
将人的乳腺癌细胞MDA-MB-231、人的肾上皮细胞HEK-293T培养于10%胎牛血清的 DMEM(加青链霉素)中,在温度为37 ℃,CO2体积分数为5%的培养箱条件下培养,等细胞密度达到70%~80%时进行胰酶消化传代。本实验所用的均为状态良好且在生长对数期的细胞。
1.3 慢病毒Lv-PromoterFOXM1-GFP的包装与慢病毒感染
慢病毒包装所用到的细胞是HEK-293T,待细胞密度达到70%~80%时,取已构建的FOXM1启动子携带绿色荧光蛋白的慢病毒重组质粒Lv-PromoterFOXM1-GFP,包装质粒Δ8.91和PVSVG,进行转染实验。在培养后的48 h和72 h两个时间点来收集上层培养液,离心5 min后取上清液并用0.45 μm的过滤头过滤掉杂质,即为可用的病毒。取适量病毒上清液加入细胞密度为70%~80%的人乳腺癌细胞MDA-MB-231,并向培养基中加入相应比例的聚凝胺(polybrene),目的是增加感染效率,感染72 h后在荧光显微镜下观察细胞形态及荧光情况。
1.4 流式细胞仪分选FOXM1高表达细胞和FOXM1低表达细胞
流式细胞分选约1×107已感染成功的MDA-MB-231细胞用胰酶消化,4 ℃离心,1000 r/min,5 min,去掉上清液,再加PBS清洗2~3次,用不含血清和双抗的DMEM均匀吹打细胞,使其成单细胞悬液,置于冰上并避光,等待上机进行检测分选。流式分选通过贝克曼流式分选仪(中南大学湘雅医院)来分选。所分选出的细胞用加20%血清和双倍双抗的DMEM接收,收集后立即培养于正常的培养环境中。
1.5 Western Blot实验
经流式细胞仪分选出FOXM1高表达细胞和FOXM1低表达细胞后,收集细胞并提取总蛋白,将处理好的样品以每孔80 μg的上样量进行SDS-PAGE电泳,后湿转法转移到 PVDF膜上。5%脱脂牛奶浸泡封闭2~3 h,加入一抗4 ℃孵育过夜,TBST洗涤30 min后再加对应的二抗室温2~3 h,最后进行显影并拍照保存。β-actin作为内参验证蛋白的含量。
1.6 荧光定量PCR
Omega RNA提取试剂盒,实验步骤参照相应试剂盒的说明书,流式细胞仪分选出的FOXM1 高表达细胞和FOXM1低表达细胞,分别提取两个细胞群体的总RNA,用逆转录试剂盒(Thermo Fisher) 将RNA逆转录为cDNA。用SYBR GreenMaster Mix 试剂盒进行qRT-RCR测定,94 ℃预变性 3 min,之后40个扩增循环如下:94 ℃变性30 s,60 ℃退火20 s,72 ℃延伸10 s。GAPDH基因为内参。相关基因的引物设计见表1。
2 结果与分析
2.1 Lv-PromoterFOXM1-GFP慢病毒载体的构建和鉴定
在EPD数据库中查找Promoter-FOXM1序列,根据其序列设计并合成Promoter-FOXM1引物,在慢病毒载体pLvx-ef1α-GFP多克隆位点处选择XholⅠ和XbalⅠ进行双酶切后,将PCR扩增的Promoter-FOXM1序列,经T4DNA连接酶连到pLvx-ef1α-GFP载体中,转化、涂板,挑单克隆菌落,选取了5个单菌落,在1%的琼脂糖凝胶下电泳检测。结果(图1)表明,除5号转化子以外,其余长度大小均为1200 bp,从中挑取两个单克隆菌送上海生工进行测序,经对比测序,结果显示目的基因已成功连接至慢病毒载体中。

表1 相关基因的qRT-PCR引物
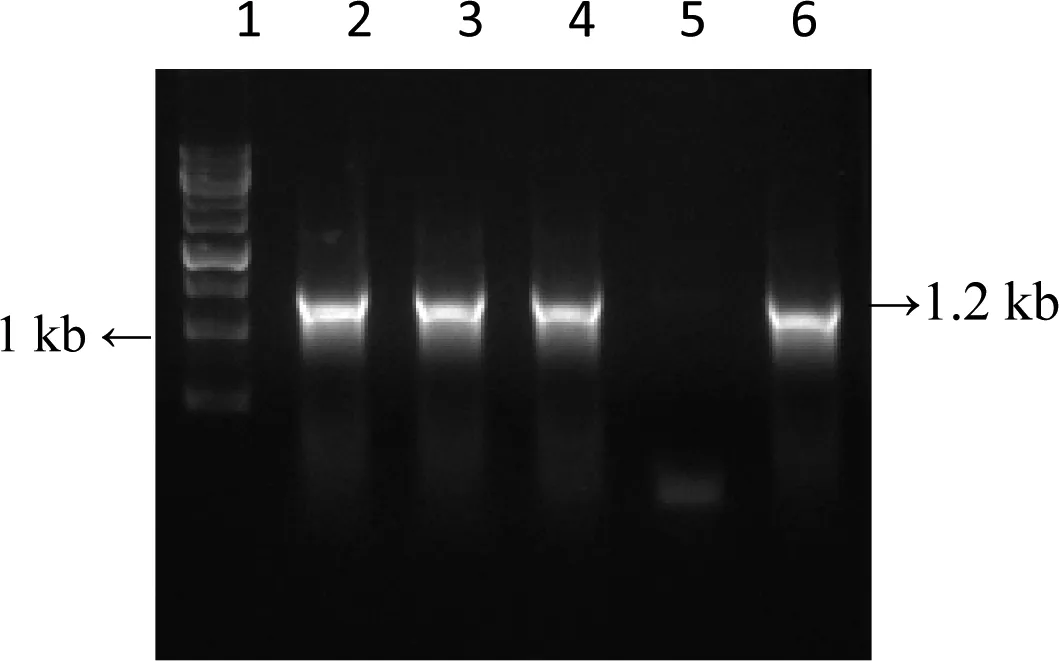
1:1 kb DNA Ladder Marker;2~6:Lv-PromoterFOXM1-GFP转化子
2.2 慢病毒的包装及其滴度测定
在慢病毒包装之前,首先查看293T细胞形态及生长状态。选取生长密度为70%~80%的293T细胞,将慢病毒重组质粒Lv-PromoterFOXM1-GFP,包装质粒Δ8.91和PVSVG共同转293T细胞48 h后,在荧光倒置显微镜下观察。结果[图2(a)和(b)]发现有绿色荧光,表明重组质粒正确并表达正常。将上述收集的慢病毒上清离心后并用0.45 μm的无菌过滤头进行过滤,除去杂质,得到的慢病毒用慢病毒滴度快速检测卡快速检测,和比色进行对比,比色卡见图2(c),比色卡有T1、T2、T3、T4和T5共5个范围值。在正常情况下,每100 000慢病毒颗粒(LPs)中会有1个具有感染活性的病毒载体,即1TU。通常上清中病毒含量需要超过106TU/mL,即在T1~T3范围值内,才能确保得到足够浓度的慢病毒载体。通过与比色卡对比,检测卡结果显示病毒滴度大概是1.25×106~7TU/ mL,在T1~T2的范围值内,说明包装所得到的慢病毒浓度足够进行下一步感染目的细胞实验。
2.3 慢病毒成功感染人乳腺癌细胞系MDA-MB-231
MDA-MB-231细胞被慢病毒上清感染24 h后,用加10%血清的DMEM继续培养72 h,荧光倒置显微镜下观察细胞的形态及绿色荧光的表达情况。在随机挑选的每个视野下均可见绿色荧光 GFP 的表达[图3(a)和(b)]。由于GFP 是由FOXM1作为启动子来启动表达的,这些有GFP表达的细胞即为FOXM1高表达细胞。结果表明病毒Lv-PromoterFOXM1-GFP成功感染上了MDA-MB-231。
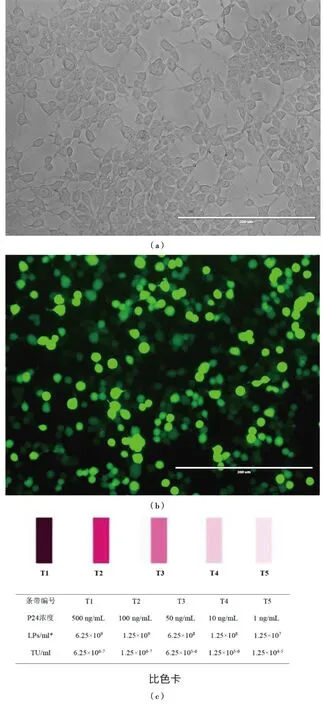
(a)293T细胞转染白光视野;(b)293T细胞转染荧光视野(倒置荧光显微镜×200);(c)慢病毒滴度快速检测卡
2.4 人乳腺癌细胞系MDA-MB-231中FOXM1高表达与低表达细胞亚群分离
用没有感染病毒的MDA-MB-231单细胞样品作为阴性对照,经流式细胞仪分析检测GFP的阳性率约为58%[图4(a)],说明在MDA-MB-231中高表达FOXM1的细胞比例占半数。然后以未感染病毒的MDA-MB-231单细胞样品作为阴性对照,根据GFP的表达,流式细胞仪分选出显著的FOXM1低表达(231 M1 Low)和FOXM1高表达(231 M1 High),具体见图4(b)。
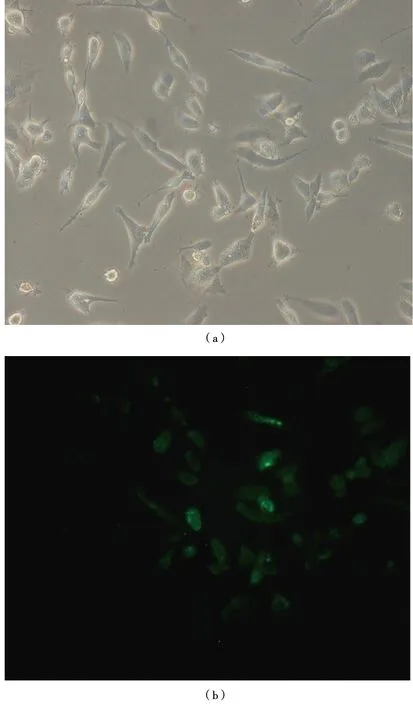
(a)白光视野; (b)GFP荧光视野。倒置荧光显微镜×200
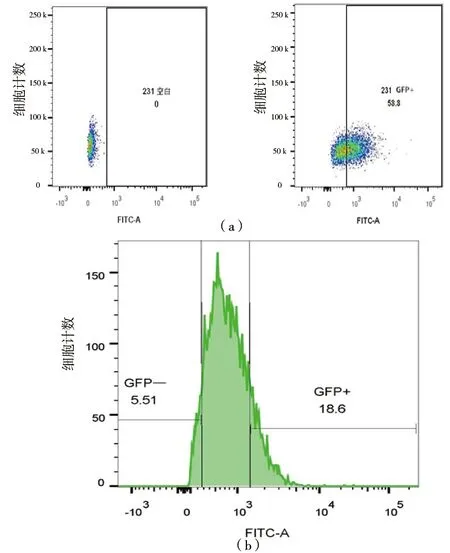
(a)以MDA-MB-231未感染的细胞作为阴性对照,流式细胞分析GFP阳性细胞所占比例;(b)流式细胞仪分选FOXM1低表达和FOXM1高表达的MDA-MB-231细胞群分别所占的比例
2.5 人乳腺癌细胞系MDA-MB-231中FOXM1高表达及低表达细胞亚群的鉴定
以未感染病毒的MDA-MB-231单细胞样品为对照,根据GFP的表达,流式细胞仪分选出显著的FOXM1低表达(231 M1 Low)和FOXM1高表达的细胞(231 M1 High),分选后贴壁培养,待细胞正常增殖后,分别提取两个亚群细胞的总蛋白,Western Blot结果说明,根据GFP所分选出的细胞能很好地对应FOXM1的表达量[图5(a)]。分别提总RNA,后逆转录为cDNA。qRT-PCR结果显示,GFP表达量能很好地对应FOXM1表达量[图5(b)]。
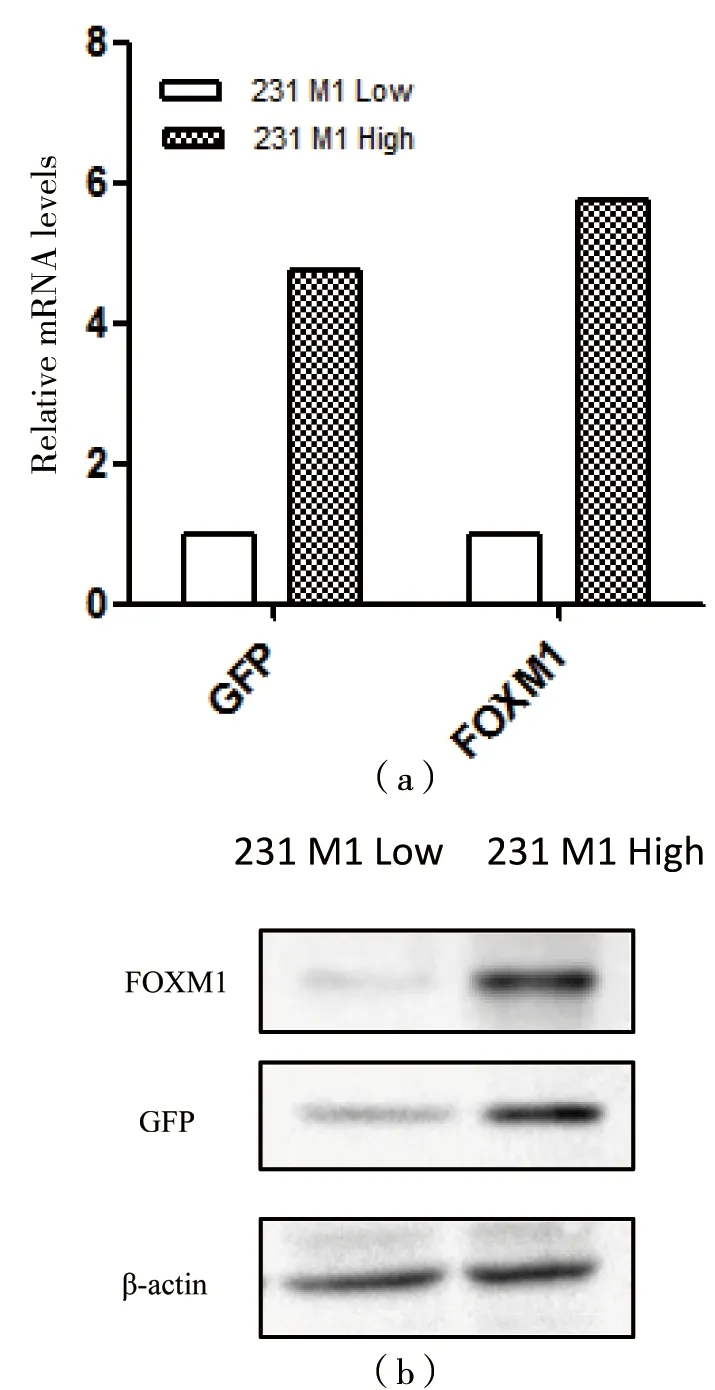
(a)qRT-PCR分别检测两个细胞亚群的FOXM1和GFP的表达;(b)Western Blot 分别检测两个细胞亚群的FOXM1和GFP的表达
3 讨论
乳腺癌在女性恶性肿瘤中十分常见,且对女性身心健康造成严重的威胁[11]。在过去的几十年中,尽管乳腺癌的诊断和治疗水平均有较大改善,但肿瘤的复发和远处转移仍是威胁患者生命的重要因素[12]。因此,迫切需要找到特异性的肿瘤分子标记物和其调控机制为肿瘤治疗提供新方式。
FOXM1是一类与细胞增殖、胚胎发育、衰老、再生、DNA损伤修复和肿瘤发生发展等许多病理生理过程密切相关的转录因子[13]。目前在多种类型的肿瘤细胞中检测到过表达的FOXM1。研究表明,FOXM1的表达水平增高不仅是乳腺癌发生的早期事件,而且与乳腺癌的浸润程度、淋巴结转移及患者的预后等因素均有直接关系[14-15]。此外,发现在乳腺癌细胞中抑制FOXM1的表达,可引起肿瘤细胞的死亡及永久性的细胞周期滞留,在不损伤正常组织的情况下,抑制FOXM1的表达可阻止肿瘤细胞的增殖来达到治疗肿瘤的效果[16]。因此,FOXM1在细胞中的特殊功能以及与乳腺癌之间的密切关系,已经成为肿瘤治疗的新靶点,进一步探索FOXM1的更多生物学功能和肿瘤治疗的分子机制,为肿瘤治疗开辟新思路。
目前,在基因治疗方面,慢病毒的应用比较广泛,对于细胞转染有多种方法,但是细胞种类不同,其转染效率也会有所差异,其中脂质体转染最为常见[17],但脂质体转染法成本较高。所以,为了达到较高的转染效果,选择低毒且高效的载体是很重要的[18]。本研究所用到的慢病毒载体,其来源是I型的HIV病毒,可利用整合酶和逆转录酶,将自身的RNA 逆转录成 DNA 并可整合至宿主细胞的染色体中,可使目的基因能够在宿主的细胞中稳定且长期表达,且感染能力强、毒性小,因此被认定是将外源的基因整合至细胞内最有效的载体[19-21]。慢病毒启动子示踪体系在细胞内能利用慢病毒将自身DNA与宿主染色体整合的优点,将某个基因的启动子序列与慢病毒自身携带的启动序列替换[8]。正是基于这些理论基础,本研究构建了以FOXM1为启动子且携带有绿色荧光蛋白GFP慢病毒表达载体Lv-pFOXM1-GFP,将FOXM1基因的启动子与荧光蛋白GFP相连,由于基因启动子的启动或丧失能够引起荧光信号的变化,进而根据荧光判断出人乳腺癌细胞MDA-MB-231中FOXM1的表达情况。再通过流式细胞仪从MDA-MB-231细胞中分离出FOXM1高表达细胞及FOXM1低表达细胞两个细胞亚群。
综上所述,通过构建FOXM1基因启动子携带绿色荧光蛋白的慢病毒载体,从荧光的变化可视化地反映了细胞内FOXM1的变化过程,从而达到体外示踪的目的。后续可用FOXM1不同的细胞亚群进行小鼠的活体实验研究,通过荧光的变化可直观地观察小鼠活体中乳腺癌的生长及转移情况,为研究乳腺癌发生发展的分子机制提供了良好的实验工具材料,并且对研究发现新的治疗靶点、寻找特异性靶向治疗方法及判断患者的预后等均具有重要意义。

