不同发酵剂菌种对Mozzarella干酪成熟过程中蛋白降解及风味形成的影响
白建,赵建英,薛建娥,刘奥强,王亚捷
(吕梁学院 生命科学系,山西 吕梁 033001)
干酪成熟是在合适的温度和湿度环境下,干酪基质中的乳糖在发酵剂、非发酵剂作用下的代谢,蛋白质在凝乳酶、蛋白酶、肽酶作用下进行的一系列降解反应以及脂肪的降解,其中蛋白质的降解赋予干酪良好的质构、独特的风味,而蛋白质的降解一般与所使用的发酵剂种类及数量有很大的关系,此外发酵剂还影响干酪的产率、理化成分及最终产品的品质。Rehman等发现发酵剂的类型比加工工艺对契达干酪风味形成的影响更重要[1],刘瑛等研究发现嗜温发酵剂对牦牛乳硬质干酪蛋白降解最弱,嗜热发酵剂对干酪蛋白降解能力最强,混合发酵剂对蛋白降解适中[2]。Pisano和Morea报道具有自溶特性的乳酸菌有利于干酪中蛋白的降解、氨基酸的生成及最终品质的形成[3-4],Morea研究报道从干酪中分离的Lactobacillusparacaseisubsp.paracasei和L.parabuchneristrains菌种所制作干酪较对照干酪形成了更多的氨基酸。Irigoyen A在添加Lactobacillusparacasei和Lactobacillusplantarum辅助发酵剂的羊奶奶酪中检测出更多的游离氨基酸和风味物质[5]。
Mozzarella(莫兹瑞拉)干酪是著名的干酪品种之一,按照水分含量其属硬质、半硬质干酪,产品成熟后风味柔和,其加工过程常用的发酵剂为嗜温型乳酸菌中的嗜热链球菌和保加利亚乳杆菌,对不同发酵剂菌种特别是益生菌对Mozzarella干酪品质的影响少有报道,本研究将几种不同的发酵剂菌种应用在Mozzarella干酪中,通过对成熟过程中干酪质构、蛋白降解、风味等品质特性的分析,评价不同菌种对Mozzarella干酪品质的影响,为益生菌干酪的开发提供了理论借鉴。
1 材料与方法
1.1 材料
新鲜牛乳:各项指标符合要求,标准化后使C/F(酪蛋白∶脂肪)为0.76。Streptococcussalivariussubsp.thermophilus(唾液链球菌嗜热亚种)CH9和Lactobacillusdelbrueckilsubsp.bulgaricus(保加利亚乳杆菌德氏亚种)LB、LPC-37(植物乳杆菌)、BI-07(双歧杆菌)、LA-14(嗜酸乳杆菌)、凝乳酶Stamix 1150:CHR HANSEN生产,活力为35000 RU/g,丹尼斯克(北京)有限公司。
1.2 仪器
干酪槽(加工量为2 L)、干酪刀、干酪模具;DL-CJ-2F医疗型洁净工作台、HPP-9272恒温培养箱 北京东联哈尔仪器制造有限公司;H.H.S21-6电热恒温水浴锅 上海医疗器械五厂;TDL-离心机 上海安亭科学仪器厂;DZQ400-2D单室真空包装机 温州市鼎力包装机械制造有限公司;TCP2色差仪 北京新奥伊克光电技术有限公司;L-8900氨基酸自动分析仪 日本日立公司;GC6890-MS5973N气相色谱-质谱联用仪 美国Agilent公司。
1.3 试验方法
1.3.1 干酪制作
原料乳(标准化)→巴氏杀菌(63 ℃,30 min)→冷却(至36 ℃)→加发酵剂(按原料乳量的0.5%加入)→加凝乳酶(添加由2%食盐水配成的1%凝乳酶溶液)→凝乳→切割→加热收缩(温度由36 ℃缓慢升到38 ℃)→排乳清(pH值6.3)→堆酿→加盐(加盐量为1.8%)→热烫、拉伸→冷却→真空包装→成熟(4 ℃)。
加入CH9∶LB为1∶1组成的混合发酵剂,加入LPC-37(植物乳杆菌)、BI-07(双歧杆菌)、LA-14(嗜酸乳杆菌)发酵剂各0.50%的干酪分别记为SL、LPC、BI、LA。
1.3.2 测定项目及方法
蛋白质含量采用凯式定氮法测定;脂肪含量按GB/T 5009.6-2003中方法测定;水分含量按GB/T 5009.3-2003中方法测定;盐含量采用硝酸银滴定法;pH测定参考Giannoglou等的方法[6];出品率按照以下公式进行计算。

WSN、12% TCA-SN、5% PTA-N、FAA的测定:WSN参考Bütikofer等的方法[7],10 g干酪加入50 mL纯净水在40 ℃下匀浆1 h,然后在4 ℃下,3000 g×30 min,上清液用滤纸过滤,凯氏定氮法测定氮含量。12% TCA-SN参考刘会平等的方法[8],称取1.5 g干酪,与45 mL 12%的TCA溶液充分混合、匀浆,以4000 r/min离心20 min,取上清液定量地移入凯氏消化瓶中,进行半凯氏定氮。5% PTA-N 参考Bütikofer 等和Katsiari等的方法[9],10 mL水溶性提取液加入3.95 mol/L硫酸7 mL和330 g/L磷酸3 mL,充分混合后于4 ℃放置过夜,滤纸过滤,采用凯氏定氮法测定上清液中氮含量。FAA 参考Dimitrellou等的方法[10],取 20 g干酪加入纯净水210 mL,在40 ℃下匀浆并过滤,测定上清液中水溶性游离氨基酸含量。
风味物质的检测:称取3 g干酪放在萃取瓶中,在80 ℃下萃取,吸附30 min,然后进行GC-MS检测。HP-5色谱柱(30 m×0.25 mm×0.25 μm),载气为氦气,流速为1 mL/min。不分流方式进样,进样口温度维持在250 ℃。程序升温条件:首先以40 ℃保持10 min,然后以5 ℃/min的速率升温至110 ℃,最后以10 ℃/min的升温速率升至240 ℃,保持10 min,以电子轰击方式,能量为70 eV进行MS运行,压力为1650 V,数据以35~400 amu的扫描范围进行收集,通过比较挥发性风味物质的质谱数据与计算机标准谱图库NIST 98中的数据以及与以前文献报道过的成分相对照,对干酪中的挥发性风味物质进行定性、半定量分析[11-14],以匹配度确定化合物的名称。
2 结果与分析
2.1 不同菌种对干酪组成成分的影响

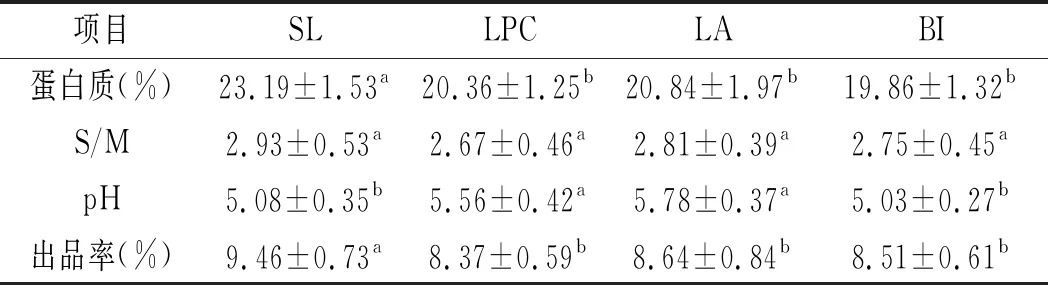
表1 不同菌种制作干酪的基本成分Table 1 The basic components of cheeses made by various strains
续 表
由表1可知,不同菌种制作干酪的水分含量、S/M虽然有差异,但彼此间不显著(P>0.05),而脂肪含量、蛋白质含量、出品率和pH值彼此间差异显著 (P<0.05),SL和LPC干酪的脂肪含量显著高于LA和BI干酪(P<0.05),LPC、LA、BI干酪的蛋白质含量、出品率和pH值显著低于SL干酪。可能与益生菌代谢乳糖的机制不同进而生成乳酸的量不同,不同的pH值环境影响干酪凝胶的组织结构,进而影响干酪基质中的干物质含量。添加益生菌的干酪减少了乳酸的生成,Leroy和 De Vuyst发现添加益生菌的干酪成熟过程中生成的乳酸较少,主要是因为益生菌缺少β-半乳糖苷酶,进而对乳糖的分解利用能力变差[15-16],Mc Brearty 等报道Lactobacillus和Bifidobacterium在乳糖浓度较低时可以利用异型代谢途径生成乳酸和醋酸[17],Ong等发现添加益生菌干酪中的醋酸含量较高[18]。
2.2 不同菌种对干酪成熟过程中蛋白降解的影响

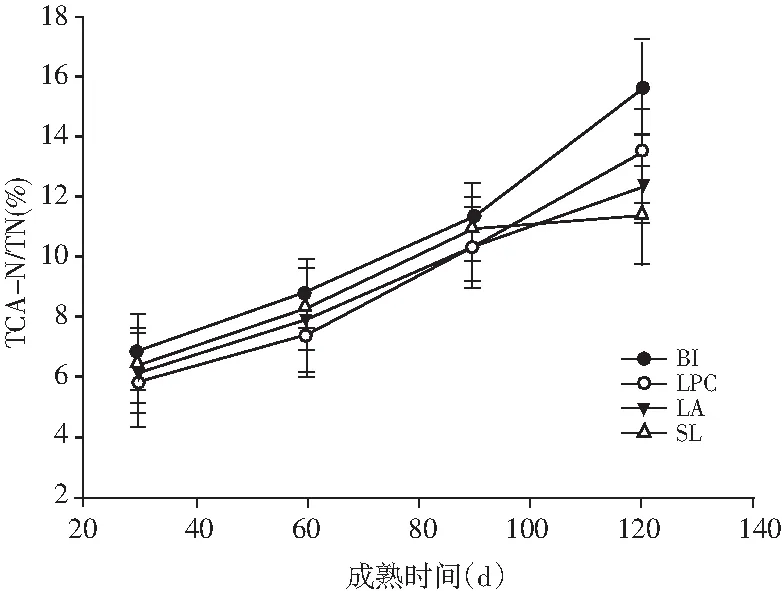

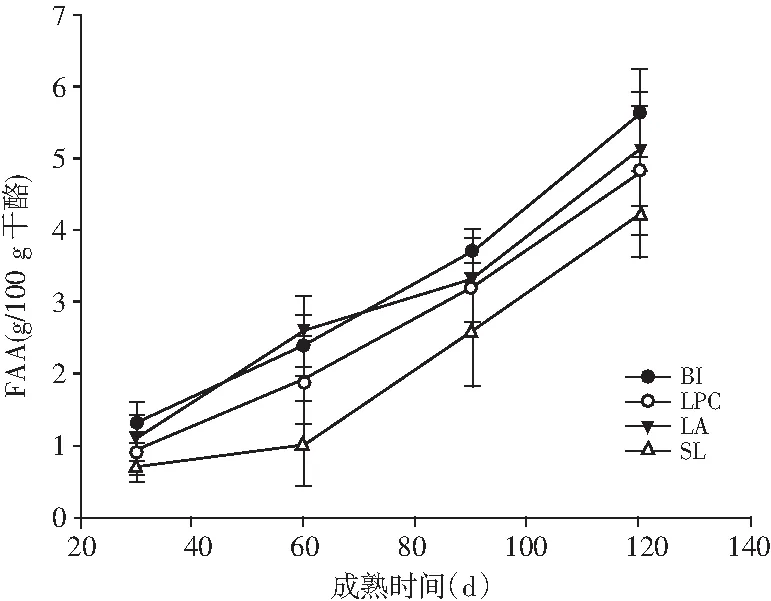
图1 不同菌种制作Mozzarella干酪成熟过程中 蛋白降解的变化Fig.1 Changes of proteolysis for Mozzarella cheese made by different strains during ripening process
蛋白降解是干酪成熟过程中重要的反应,Mozzarella干酪中由蛋白质降解转化而来的风味化合物包括肽类、氨基酸以及氨基酸在转氨酶、脱羧酶等作用下进一步代谢生成的酮、酸、醛、醇、酚、醚、吲哚、胺等。不同发酵剂的蛋白水解酶系及肽类转运系统不同,进而其蛋白水解的程度不同,表现在蛋白水解的深度和广度不同。常用评价蛋白水解的指标包括水溶性氮、12%三氯乙酸溶解性氮、5%磷钨酸氮以及游离氨基酸的量。由图1可知,4种发酵剂菌种制作干酪成熟过程中的可溶性蛋白及游离氨基酸含量都随着成熟时间的延长而增加,与Giannoglou 等研究发现高压处理菌种制作干酪及高压处理干酪后溶解性氮含量显著增加的结果相似。BI干酪在成熟过程中WSN/TN、PTA-N/TN含量显著高于其他组干酪,成熟120 d时BI和LPC干酪组TCA-N/TN高于SL和LA组,整个成熟期间BI、LA、LPC组干酪FAA含量都显著高于SL干酪(P<0.05),益生菌LPC、LA、BI对干酪中蛋白降解影响较大,与Bezerra等的研究报道添加益生菌BB-12的羊奶Coalho干酪在28 d的成熟过程中水溶性氮含量极显著高于其他几种益生菌干酪一致[19],Albenzio等报道动物双歧杆菌BB-12对干酪中蛋白水解作用较强,在干酪成熟过程中可以形成大量的游离氨基酸和水溶性肽,添加益生菌的干酪在28 d的成熟过程中蛋白水解深度指数较高,几种益生菌混合干酪的蛋白水解深度指数在整个成熟过程中高于其他干酪相似[20],归因于多种益生菌对蛋白水解的协同作用,益生菌干酪的蛋白水解深度指数高于普通菌种干酪,充分说明益生菌的蛋白水解活性高于普通菌种。Albenzio和Randazzo发现益生菌具有光谱的酶系,这些酶催化的生化反应形成的物质有利于干酪质构及良好风味的形成,进而提高干酪的感官及营养价值[21]。Irigoyen等发现添加L.paracasei和L.plantarum干酪中的亮氨酸、异亮氨酸、苯丙氨酸、丝氨酸、丙氨酸的含量高于Lactococcuslactissubsp.lactis和Lactococcuslactissubsp.cremoris菌种制作的干酪。
2.3 不同菌种对干酪成熟过程中风味的影响
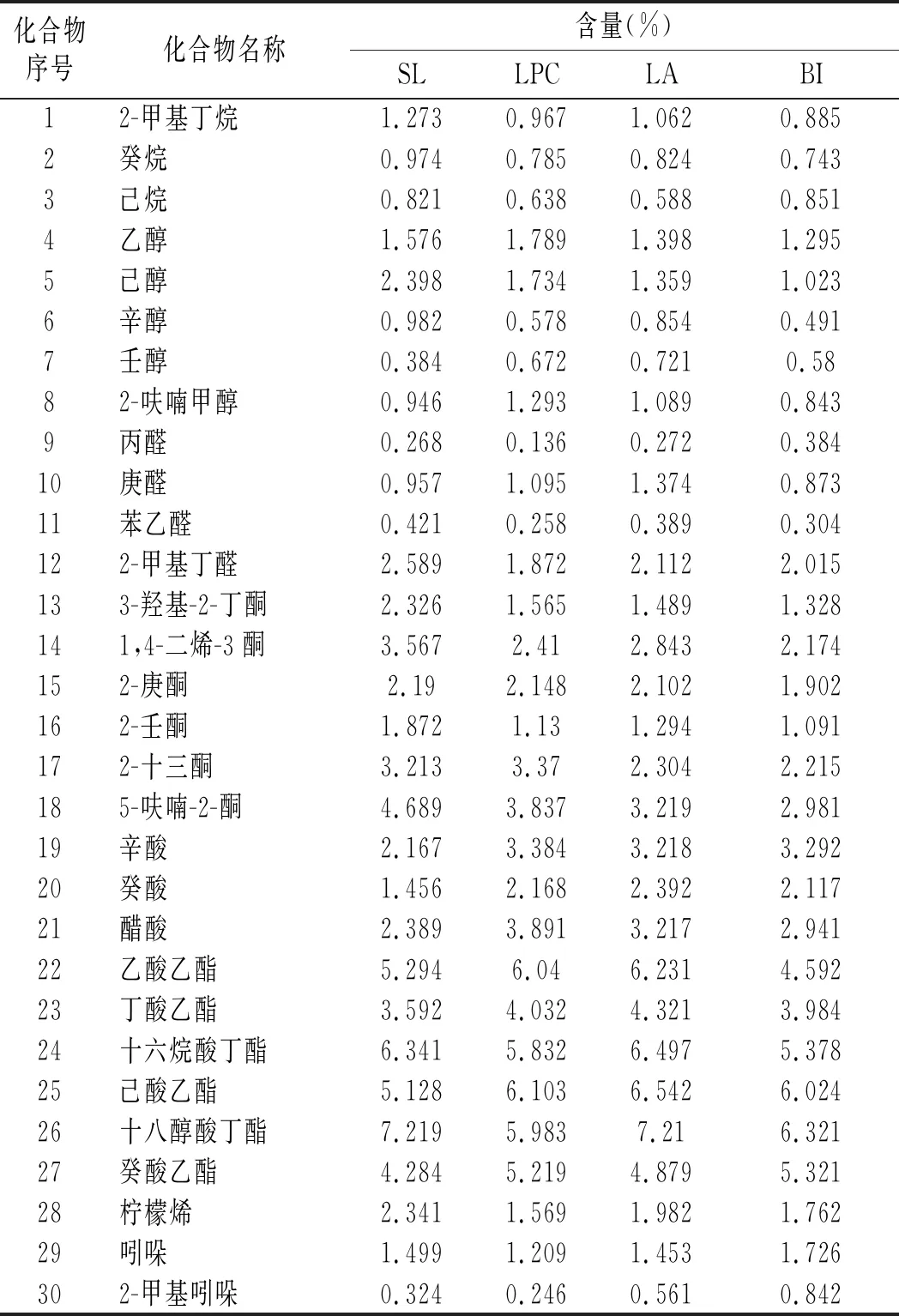
表2 不同菌种制作Mozzarella干酪成熟120 d时的 挥发性风味化合物含量Table 2 The content of volatile compounds in Mozzarella cheese made by different strains at ripening for 120 days
由表2可知,从4种不同菌种制作干酪中鉴定到了30种主要的挥发性风味化合物,包括3种烷烃、5种醇类、4种醛类、6种酮类、3种酸类、6种酯类、3种其他化合物,这些化合物是干酪中主要的挥发性风味物质。在LPC、LA、BI干酪中2-甲基丁烷、癸烷、己烷含量都低于SL干酪,而BI干酪中的含量更低。乙醇、己醇、辛醇的含量在LPC、LA、BI干酪中低于SL干酪,而壬醇和2-呋喃甲醇含量高于SL干酪,BI干酪中醇类的含量低于LPC和LA。醇类中的1-丙醇具有辛辣的酒精味道,1-丁醇具有芳香的水果味道[22]。干酪成熟过程中,醛类是不稳定的物质,容易被还原成醇类和氧化成酸类,庚醛、辛醛、癸醛、苯甲醛、2-戊烯醛、2,4-二烯醛含量高会导致干酪的不良风味[23],n-丁醛具有青草的味道,浓度高时有不愉快的味道。苯乙醛、2-甲基丁醛在LPC、LA、BI干酪中的含量低于SL,庚醛和丙醛在BI中低于SL。酮类在LPC、LA、BI干酪中的含量都低于SL,而BI干酪中的酮类低于LPC和LA,Bezerra等发现由L.paracasei菌种制作羊奶干酪成熟28 d时酮类的含量最高[24]。2-庚酮作为蓝纹干酪主要的香味物质在4种干酪中也被检测到,含量都相对较高且彼此间差异不大。2,3-丁二酮、3-羟基-2-丁酮和2-丁酮主要是微生物通过代谢柠檬酸和双乙酰而形成,2-丁酮被认为具有奶油和酯香的味道,2,3-丁二酮具有黄油、奶酪和焦糖的味道[25]。辛酸、癸酸、醋酸的含量在LPC、LA、BI干酪中高于SL干酪,这与报道的结果一致。益生菌在干酪成熟的后期更有利于生成各种酸类,LPC、LA、BI属厌氧菌,在干酪相对厌氧的环境中能很好进行残留乳糖的代谢进而生成酸类。酯类是干酪中的主要风味物质,主要通过醇(主要是乙醇)和酸的酯化反应形成,乙酯类赋予干酪水果的香味,在4种干酪检测到了常见的酯类物质,除十八醇酸丁酯和十六烷酸丁酯外,其他的酯类特别是乙酸乙酯、己酸乙酯和癸酸乙酯在LPC、LA、BI干酪中的含量明显高于SL干酪,而LPC、LA中酯类的含量又高于BI,Bezerra等研究发现由L.acidophilus制作的羊奶奶酪成熟28 d时癸酸乙酯的含量最高。柠檬烯的含量在SL干酪中较高,而吲哚和2-甲基吲哚的含量在BI干酪中含量较高。Irigoyen发现添加L.paracasei和L.plantarum干酪中的17种烃类、17 种醇类、2 种含硫化合物、11种醛类、12 种酮类、6种酸类和8 种酯类风味物质含量显著高于Lactococcuslactissubsp.lactis和Lactococcuslactissubsp.cremoris菌种制作干酪。Albenzio和Randazzo也报道干酪中的益生菌代谢形成的酶催化的生化反应对干酪质构和风味的形成影响较大,添加益生菌能够提高低脂契达干酪的风味。Banks等发现L.casei和L.paracasei可以降低契达干酪中的苦味而提高干酪的风味[26],Ryhänen等发现双歧杆菌可以使干酪生成良好的风味而避免醋酸的不良风味,添加益生菌的低脂契达干酪形成了水果的味道同时提高了其口感[27]。
3 结论
不同发酵剂菌种显著影响干酪成品的蛋白质含量、脂肪含量、pH值、出品率,对水分含量、S/M的影响不显著。BI干酪在成熟过程中WSN/TN、PTA-N/TN含量显著高于其他组干酪,成熟120 d时BI和LPC干酪组TCA-N/TN高于SL和LA组,整个成熟期间BI、LA、LPC组干酪FAA含量都显著高于SL干酪(P<0.05)。成熟120 d的LPC、LA、BI干酪中烷烃类、酮类、部分醇类(乙醇、己醇、辛醇)和苯乙醛、2-甲基丁醛的含量低于SL干酪,而酸类和酯类(除十八醇酸丁酯和十六烷酸丁酯)外的含量高于SL干酪。

