汉麻叶黄酮成分及其抑菌活性分析
闫佳佳,万璐,姜硕,许哲祥,郑春英*
(1.黑龙江大学 农业微生物技术教育部工程研究中心,哈尔滨 150500;2.黑龙江大学 生命科学学院 黑龙江省普通高校微生物重点实验室,哈尔滨 150080)
火麻仁,桑科植物汉麻(CannabissativaL.)的干燥成熟果实[1],是著名的药食同源功能性保健食品[2]。火麻仁油富含大量的不饱和脂肪酸、氨基酸、维生素、植物甾醇、CBD等酚类等成分[3],是重要的调味品[4-5]。随着对汉麻的深入研究发现,汉麻叶除了具有与火麻仁相关的活性成分外[6],还富含大量非酚类活性成分,如:黄酮、生物碱等成分,这些成分具有潜在的活性研究价值和应用前景[7],关于汉麻叶所含黄酮、生物碱等非酚类成分的研究报道相对较少[8]。
众所周知,黄酮类成分具有抗炎、抗病毒、抗肿瘤、抗氧化、抗菌、保护心肌等作用[9],是食品、药品、功能性调味品的重要生产原料[10-11]。鉴于汉麻叶中含有丰富的黄酮成分,为了充分利用汉麻资源,扩大其应用范围,本文选择汉麻叶黄酮成分作为研究对象,拟对其进行调味品方面的开发应用。植物活性成分及活性作用受种植季节、生长环境、采收时期的影响而有所差异[12-13],因此,选择黑龙江汉麻叶中黄酮成分进行分析,并进行抑菌活性筛选,为开发新型保健食品及功能性调味品奠定了基础。
1 材料与方法
1.1 材料与试剂
汉麻叶:龙大麻5号,产地黑龙江省孙吴县;7种对照品(供含量测定用):中国药品生物制品检定院;NA、NB培养基:配制方法参阅文献[14];供试菌共10株:购于黑龙江省微生物研究所,菌种现保存于黑龙江大学生命科学学院生物制药专业实验室;PDA培养基:配制方法参阅文献[15]。
1.2 仪器与设备
FL2200型高效液相色谱仪 浙江温岭福立分析仪器有限公司。
1.3 方法
1.3.1 TLC法分析汉麻叶中黄酮类成分
对照品溶液的制备:参阅文献[16-17],选择对照品。以甲醇为溶剂,分别制备1.0 mg/mL的芦丁、槲皮素、山奈酚、木犀草素、槲皮素-3-O-α-L-鼠李糖苷、牡荆素、异牡荆素对照品液。
供试品液的制备:取汉麻叶粉末5 g,加95%乙醇250 mL(料液比1∶50),超声处理30 min,过滤,滤液蒸干,水溶解,乙酸乙酯萃取,合并萃取液,回收溶解,残渣加甲醇1 mL溶解,作为供试品溶液。
TLC分析:分别吸取对照品液、供试品液各5 μL,点于同一个聚酰胺薄膜上(10 cm×10 cm),以甲醇-醋酸-水(90∶5∶5)为展开剂,展开,晾干,在紫外灯下(365 nm)观察。供试品色谱中在与对照品色谱相应的位置上显相同颜色斑点。
1.3.2 HPLC法分析汉麻叶中黄酮类成分
色谱条件:色谱柱:Venusil XBP-C18柱(4.6 mm×250 mm,5 μm,USA);流动相①:甲醇∶水∶冰醋酸为50∶50∶0.5;流动相②:甲醇∶水∶冰醋酸为46∶54∶0.5;流动相③:甲醇∶水∶冰醋酸为65∶35∶0.1,流速:1 mL/min;柱温:25 ℃;检测波长:254 nm;进样量:10 μL。
对照品溶液:同“1.3.1”。
供试品溶液:同“1.3.1”。
HPLC分析:分别吸取对照品液、供试品液各10 μL,注入HPLC,每个样品重复3次(n=3)。
1.3.3 汉麻叶抑菌活性分析
参阅文献[18],采用琼脂扩散法对汉麻叶进行抗菌活性的测定。
供试品溶液:同“1.3.1”。
分别取“1.1”项的4株革兰氏阴性供试菌和5株革兰氏阳性供试菌,接种于NA培养基(恒温37 ℃,传代培养2~3次),活化后,接种于NA培养基试管斜面(37 ℃,培养24 h);另取“1.1”项的1株供试真菌活化2~3次后,转接于PDA培养基斜面(恒温28 ℃,培养3 d);在各受试菌株试管中分别加入5 mL无菌水,充分振荡,平板菌落计数,将菌悬液浓度稀释至1×107CFU/mL,按1∶100的比例分别将菌悬液加入50 ℃左右的NA和PDA培养基中,振荡摇匀,分装(25 mL/皿,此平板已均匀摆放无菌牛津杯),冷却,取出牛津杯,并向两孔中分别加入供试品液,随行以甲醇溶剂作为空白对照,以100 μg/mL链霉素和制霉素作为阳性对照,将含供试细菌的平板置于37 ℃恒温培养箱中培养,24 h后测量各平板抑菌圈的直径;将含有供试真菌的平板放于28 ℃恒温培养箱中,3 d后取出测量抑菌圈直径(n=3)。
2 结果与分析
2.1 TLC法分析汉麻叶中黄酮类成分结果
以“1.3.1”中对照品为对照,采用TLC法分析汉麻叶中黄酮成分,结果见图1。

图1 汉麻叶黄酮成分TLC图Fig.1 The TLC chromatogram of flavonoids from hemp leaves
由图1可知,采用对照品比较法,针对汉麻叶中可能含有的黄酮成分,以TLC法进行初步鉴别,结果表明,在供试品中,在与芦丁对照品相应的位置上有相应的斑点;在与槲皮素对照品相应的位置上有相应的斑点;在与山奈酚对照品及槲皮素-3-O-α-L-鼠李糖苷相应的位置上难以判断是否具有相应的斑点;在采用TLC法分析汉麻叶中黄酮成分时,也曾改变TLC条件对汉麻叶中可能含有的黄酮成分进行分析,但可能由于黄酮成分含量较低或分析方法不够精密等原因,尚需采用HPLC法对汉麻叶样品中黄酮成分进行进一步分析。
2.2 HPLC法分析汉麻叶中黄酮类成分结果
在“2.1”分析基础上,分别选取“1.3.2”项的流动相,采用HPLC法,对汉麻叶中黄酮成分进行分析,结果见图2。

注:A为汉麻叶供试品;B为槲皮素;C为槲皮素-3-O-α-L-鼠李糖苷;D为芦丁。

注:A为汉麻叶供试品;B为异牡荆素;C为牡荆素。
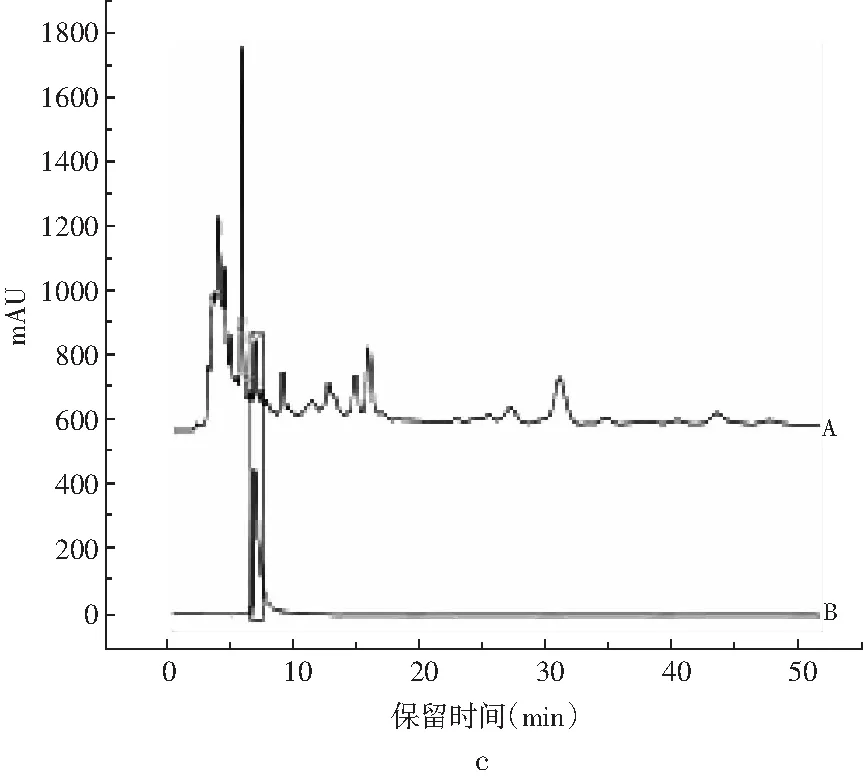
注:A为汉麻叶供试品;B为木犀草素。
由图2中a可知,采用“1.3.2”项的流动相①分析,汉麻叶供试品色谱图中,在与芦丁、槲皮素及槲皮素-3-O-α-L-鼠李糖苷对照品相同的保留时间位置上,均有相同的色谱峰出现,表明汉麻叶中可能含有上述3种黄酮成分。由图2中b可知,采用“1.3.2”项的流动相②分析,汉麻叶供试品色谱图中,在与异牡荆素、牡荆素对照品相同的保留时间位置上,均有相同的色谱峰,表明汉麻叶中可能含有上述两种成分。由图2中c可知,采用“1.3.2”项的流动相③分析,汉麻叶供试品色谱图中,在与木犀草素对照品相同的保留时间位置上,均有相同的色谱峰,表明汉麻叶中可能含有该成分。实验中未检测到山奈酚的存在;此后,采用对照品加入法对上述结果进行了确认。上述结果说明,在汉麻叶中含有大量的黄酮成分,上述结果也可为采用HPLC法梯度洗脱的方式建立汉麻叶黄酮成分一测多评的分析体系奠定基础。
2.3 汉麻叶抑菌活性分析结果
为了观察汉麻叶黄酮成分的抑菌活性,在采用“1.3.1”的供试品进行抑菌活性时,也以汉麻叶水提物作对照,结果见表1。

表1 汉麻叶抑菌活性分析结果Table 1 The analysis results of antibacterial activities of hemp leaves (n=3)
由表1可知,富含黄酮成分的汉麻叶供试品对10株致病菌均表现出良好的抑菌效果,且呈明显的量效关系,尤其对3株食源性致病菌也表现出良好的抑菌效果,结果见图3~图5。虽然汉麻叶水提物也有一定的抑菌活性,但其抑菌效果远远比不上汉麻叶醇提物,从而说明汉麻叶抑菌活性成分主要集中于汉麻叶醇提物中,而汉麻叶醇提物中富含大量黄酮成分,关于汉麻叶抑菌活性成分是否为其所含黄酮成分所致,尚需将汉麻叶黄酮成分分离出来后进行深入研究。
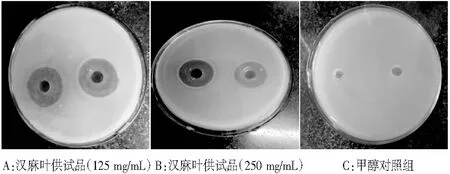
图3 汉麻叶对单增李斯特菌株的抑制作用结果Fig.3 The results of inhibition effect of hemp leaves on Listeria monocytogenes

图4 汉麻叶对大肠杆菌的抑制作用结果Fig.4 The results of inhibition effect of hemp leaves on Escherichia coli

图5 汉麻叶对金黄色葡萄球菌的抑制作用结果Fig.5 The results of inhibition effect of hemp leaves on Staphylococcus aureus
由图3~图5可知,汉麻叶提取物对3种食源性致病菌具有较好的抑菌作用,可以应用于食品及调味品中,后续研究将对汉麻叶黄酮成分进行系统分离后,进行食品、调味品的研制,并进行相应的抑菌活性分析。
3 结论
对汉麻叶黄酮成分进行分析,结果表明,在汉麻叶中含有大量的黄酮类成分;同时,对含有黄酮成分的汉麻叶样品进行抑菌活性分析,结果表明,汉麻叶具有较好的抑菌活性,尤其对3种食源性致病菌:单增李斯特菌、大肠杆菌、金黄色葡萄球菌抑菌作用良好。关于汉麻叶抑菌活性成分是否与其所含黄酮成分相关,还需进一步系统研究。鉴于汉麻叶具有淡淡的芳香苦味、良好的抑菌效果及所富含的大量黄酮类成分,上述结果对于开发汉麻叶功能性调味品奠定了基础。

