三氧化二砷载药微球治疗VX2肝肿瘤兔模型的效果分析
王文辉, 段旭华, 李 浩, 李凤尧, 琚书光, 王满周, 任建庄, 韩新巍
郑州大学第一附属医院 介入科, 郑州 450052
大多数肝脏恶性肿瘤患者确诊时已处于中晚期,受肿瘤体积、数目、转移等限制已不适合行外科手术切除,传统的经肝动脉化疗栓塞术(cTACE)目前被公认为是肝癌非手术治疗的首选方式[1]。载药微球作为一种新型的栓塞材料,可以通过电荷吸附作用将化疗药物吸附到微球内部。前期研究[2]显示,CalliSpheres载药微球(100~300 μm)对三氧化二砷(arsenic trioxide,ATO)的最佳载药时间为40 min,将规格为1 g×1瓶、粒径为100~300 μm的载药微球与60 mg (10 mg/ml,6 ml)的ATO混合均匀40 min后,可检测其内能荷载ATO量为13.8±1.49 mg,载药量达到临床所需。载药栓塞微球(callispheres beads,CB)不仅达到局部化疗和栓塞肿瘤供血动脉的双重目的,另外微球缓慢释放抗肿瘤药物能力对肿瘤持续性杀伤,还可以提高治疗指数以及药物的选择性[3]。对于不可切除的肝癌,TACE术中使用载药栓塞微球与cTACE相比有着更好地临床疗效和安全性,并且可减少介入治疗的次数,进而可以改善生活质量[4]。在活性瘤组织中,CB加载ATO(CBATO)中的ATO浓度在3 d内逐渐上升,并在3 d时达到顶峰后下降。由此得知,载药微球携载的ATO可较长时间持续的作用于局部肿瘤组织,从而起到持续抑制肿瘤的目地, 确保ATO剂量依赖和时间依赖效用的安全发挥[5]。本研究从肿瘤细胞的凋亡与增殖、肿瘤坏死体积、生存期等方面对TACE应用CBATO治疗兔VX2肝肿瘤疗效进行分析。
1 材料与方法
1.1 实验材料与动物模型 日本大耳白兔[使用许可证编号:SYXK(豫)2016-0002,生产许可证编号:SCXK(鄂)2016-0011]130只,体质量2.3~2.9 kg,雌雄不限。采用Duan等[6]报道的方法建立兔VX2肝癌模型(荷瘤种兔为华中科技大学同济医学院动物实验中心惠赠)。兔肿瘤模型建模后14 d行增强CT观察肿瘤是否形成及大小。
1.2 实验动物分组与处理 共有126只实验兔成功建立VX2肝肿瘤模型,其中有2只死于麻醉,1只死于术中,有实验兔均能耐受TACE手术。采用随机数字表法随机分为4组(每组需保证实验兔30只),分别为对照组(术中注入生理盐水10 ml)、CB组(术中注入空白微球,微球直径100~300 μm,0.1 g,江苏恒瑞)、CBATO组(术中注入ATO载药微球,微球直径100~300 μm,江苏恒瑞,ATO用量0.5 mg/kg);cTACE组(术中注入ATO超液态碘油乳化剂,ATO用量0.5 mg/kg)。采用Duan等[7]的方法制备CBATO。各实验组在12 h、3 d、7 d、14 d各处死5只实验兔取残瘤区组织进行HE染色及免疫组化等检测,剩余10只实验兔观察生存期。
1.3 兔VX2肝肿瘤TACE手术方法 实验兔术前禁饮食24 h,于左侧臀肌肌注0.2~0.3 ml/kg的速眠新Ⅱ注射液(敦化市圣达动物药品有限公司)麻醉实验兔,并将其仰卧位固定于实验台。兔右侧股动脉根部皮肤常规脱毛消毒,切开皮肤分离暴露股动脉,在减影血管造影 (Siemens Artis zeego, 德国)导向下将4.0F Cobra导管(Terumo, 日本)插至腹腔干,行腹腔干及肝固有动脉造影,明确肿瘤供血动脉及血供情况。再引入1.9F微导管(EcheconTM-14,EV3,美国)超选至肿瘤供血动脉。按照上述各治疗组治疗方法进行栓塞,栓塞终点为造影无肿瘤染色或门静脉小分支内可见碘油沉积,若仍有肿瘤染色,给予8Spheres微球栓塞(100~300 μm,江苏恒瑞)。
1.4 组织标本收集 打开各组处死实验兔的腹腔,取出肝脏组织留取图像,并取肝脏残瘤区组织置于4%多聚甲醛中固定,石蜡包埋后以4 μm厚切片,常规HE染色观察病理学改变。
1.5 肿瘤相关指标观察
1.5.1 肿瘤坏死体积、肿瘤生长率和肿瘤坏死率 术后7 d沿各组处死实验兔原发病灶长轴切开肿瘤组织,测量瘤体最大长径(a)和短径(b),按V=(1/2)ab2计算肿瘤总体积(CV)。分别测量各组瘤体切面坏死区长径(c)和短径(d)。计算术后7 d肿瘤生长率、肿瘤坏死率。肿瘤生长率=术后肿瘤体积/术前肿瘤体积×100%,肿瘤坏死率=坏死面积/肿瘤面积×100%。
1.5.2 肿瘤细胞凋亡百分比和增殖指数 每个样品取5个区域,采用TUNEL-DAPI双染色法(Roche,德国)检测肿瘤细胞的凋亡。通过计算每个高倍镜视野(×200)的凋亡阳性细胞阳性百分率,对结果进行半定量分析。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)检测肿瘤细胞增殖活性。采用免疫组织化学染色检测残瘤区PCNA表达,计数每张切片中5个高倍镜视野(×200)内200个细胞中PCNA阳性细胞数,PCNA阳性细胞表现为细胞核内出现棕黄色或棕褐色颗粒沉积,计算增殖指数(proliferation index,PI),其中PCNA阳性细胞所占百分比即为PI。
1.6 伦理学审查 本实验经过河南省动物伦理委员会批准,批号:科研-2017-03,符合实验室动物管理与使用准则。
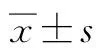
2 结果
2.1 CBATO组兔VX2肝肿瘤建模过程 兔肝脏VX2肿瘤植入14 d增强CT动脉期可见强化灶(图1a); 肝动脉造影实质期显示肝左外叶内占位性病变(图1b);注入CBATO栓塞后造影显示原占位性病变无肿瘤供血,栓塞彻底(图1c);术后7 d,可见栓塞后的肿瘤组织(图1d);沿肿瘤直径最大径线切开肿瘤组织,可见肿瘤组织坏死彻底(图1e)。
2.2 术后各组HE染色 术后7 d,在CBAT0组中可见单个栓塞微球在肿瘤细小血管内(图2)。对照组中HE染色可见明显的肿瘤组织,cTACE组和CB组HE染色中可见肿瘤组织,少于对照组。
2.3 肿瘤坏死体积、肿瘤生长率、肿瘤坏死率的比较 荷瘤兔肿瘤大小为11.52~16.80 mm,平均(12.58±3.50) mm,各组间差异均无统计学意义(P值均>0.05)。术后7 d,CBATO组、CB组、cTACE组及对照组残瘤与坏死区总体积分别为(1.61±0.35)cm3、(3.03±0.51)cm3、(2.65±0.53)cm3及(3.93±0.66)cm3,CBATO组与cTACE组、CB组相比差异均有统计学意义(P值分别为0.009、0.016);cTACE组与CB组比较差异无统计学差异(P=0.347)。术后7 d,CBATO组的肿瘤生长率明显低于其他3组(P值均<0.05),而肿瘤坏死率显著高于其他3组(P均<0.05)(表1)。
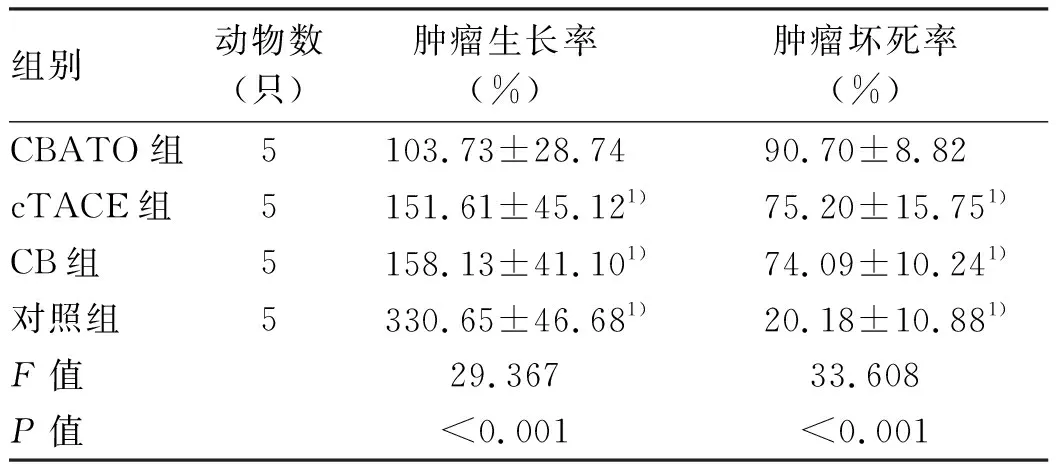
表1 术后7 d不同组肿瘤生长率和肿瘤坏死率比较
2.4 肿瘤细胞PI、凋亡细胞百分比比较 术后不同时间点各组肿瘤细胞PI和凋亡百分比差异均有统计学意义(P值均<0.05)(表2、3);每组在不同时间点肿瘤细胞PI差异均无统计学意义(P值均>0.05),CBATO组、cTACE组和CB组在不同时间点肿瘤细胞凋亡百分比比较差异均有统计学意义(F值分别为18.759、17.250、27.572,P值均>0.05);术后不同时间点,CBATO组残留细胞PI和凋亡百分比与其他3组比较,差异均有统计学意义(P值均<0.05)。各组典型肿瘤细胞增殖染色和凋亡染色见图3、4。
2.5 生存期的比较 CBATO组、CB组、cTACE组及对照组中位生存时间分别为26、18.5、22、15.5 d,术后35 d实验兔均死亡。CBATO组生存时间与cTACE组、CB组及对照组相比明显延长(χ2值分别为3.95、8.99、13.47,P值分别为0.049、0.003、<0.01)。CB组与cTACE组较对照组生存时间延长,但两组间差异无统计学意义(P=0.137)(图5)。
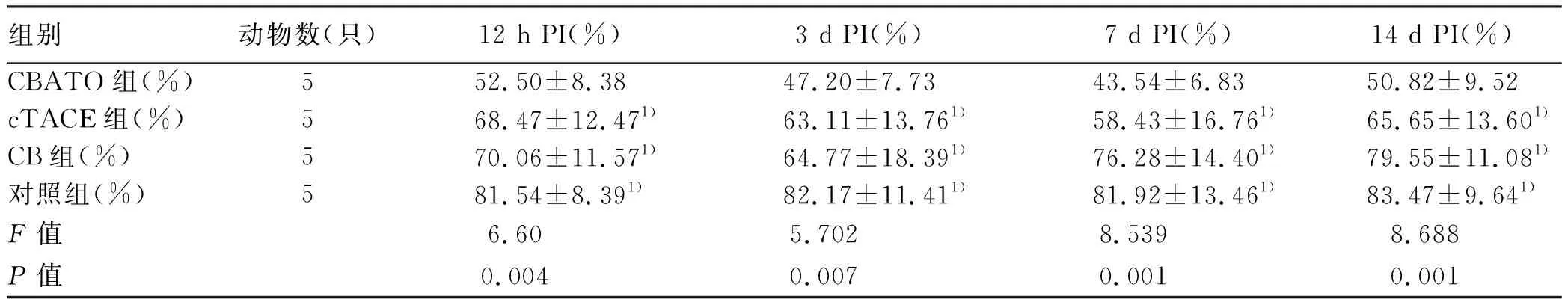
表2 术后各组残瘤细胞PI的比较

表3 术后各组瘤细胞凋亡百分比比较
3 讨论
cTACE作为首先出现的肝癌介入治疗方式,疗效确切。但也存在以下不足:碘油的乳化剂中化疗药物浓度无法在受控的情况下持续释放药物;因不能彻底栓塞肿瘤,需多次栓塞,随着治疗次数增多不仅增加了患者的治疗费用和心理负担,而且会加重患者的肝硬化和肝损伤[8]。cTACE多采用碘化油作为栓塞材料栓塞肿瘤血管,但术后患者病灶内碘化油会大量缺失,造成这种情况的原因可能是碘化油栓塞不彻底,受肿瘤组织周围侧支循环冲刷所致,这样不仅会导致肿瘤疗效下降,还可能导致碘化油扩散到其他组织,引发患者多种不良反应[9]。载药栓塞微球是在cTACE基础上的一项尝试和创新,其用于原发性肝癌及转移性肝癌的治疗,已取得良好的疗效[10]。
载药微球被作为TACE术中化疗药物进入病灶的载体,因其可在肿瘤内持续缓慢释放化疗药物而被广泛使用。李浩等[5]研究证明了载药微球与碘油相比,可以在肿瘤组织中持续缓慢释放化疗药物,较长时间维持肿瘤组织内较高浓度的化疗药物,且不会增加实验兔的肝肾毒性。相比较碘油,载药微球不仅可以更彻底的栓塞肿瘤血管,并且缓释的化疗药物也可以持续作用于肿瘤组织且较少药物进入全身循环系统,而使肿瘤组织更彻底的坏死[11]。与cTACE 相比,TACE术中使用载药栓塞微球的安全性、有效性更为理想,Duan等[12]研究证明了TACE术中应用CBATO 治疗原发性肝癌安全有效、近期临床疗效好。
Liu等[13]在cTACE术中采用20 mg ATO与碘油混合治疗原发性肝癌,证实其具有更好的安全性、有效性以及不良反应小等优点。ATO能够抑制细胞凋亡调控基因Bcl-2的表达,进而控制肝癌细胞的增生和繁殖,促使肿瘤细胞的周期阻滞、诱导肿瘤细胞的分化、抑制肿瘤内血管的形成[14]。ATO被认为通过抑制基质金属蛋白酶9表达,从而抑制肿瘤细胞侵袭和转移[15]。ATO通过下调血管内皮生长因子的表达抑制肿瘤血管的形成、肝癌的生长和远处转移[16]。TACE术后肝癌残余组织内血管内皮生长因子表达增强,微血管密度增高,预示肿瘤新生血管增生[17]。CBATO缓慢持久的释放化疗药物,可与栓塞创造的缺血缺氧环境结合,更好地发挥抑制肿瘤细胞生长、促进肿瘤细胞凋亡及抑制肿瘤转移的能力。因此本实验中CBATO组取得更长的中位生存期。本研究发现CBATO组肿瘤细胞凋亡程度明显高于cTACE组,而肿瘤细胞增殖则明显减少,证实了肿瘤内持续高浓度的ATO和栓塞后缺血、缺氧环境协同控制肿瘤效果更好。
本研究通过对各实验组肿瘤栓塞的治疗效果、肿瘤细胞的增殖和凋亡、肿瘤生长率和坏死率以及肿瘤生长等方面进行评估,发现TACE术中应用空白微球和ATO碘油乳化液虽能够起到一定的栓塞效果,促使肿瘤细胞凋亡,而应用CBATO能够更加有效提高肿瘤细胞凋亡、抑制肿瘤细胞增殖。因空白微球、ATO碘油乳化液在药物的释放和肝动脉栓塞上均有欠佳的表现,对比得出CBATO在肝癌治疗的方面具有更好的疗效。
综上所述,TACE术中应用CBATO可明显提高兔肝VX2肝肿瘤的坏死率,促进肿瘤细胞的凋亡,抑制肿瘤细胞增殖并延长实验动物的生存期。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:王文辉负责动物实验,标本检测,收集数据,资料分析,撰写论文;李浩、李凤尧、琚书光参与动物实验,收集数据;王满周参与标本检测;段旭华、任建庄、韩新巍负责拟定课题设计,写作思路,指导撰写文章并最后定稿。

