基于生物信息学筛选红景天苷对大鼠缺血/再灌注神经保护作用的相关基因
官喜龙,徐 静,陈轶尘,杨 婧
(1.鹰潭市人民医院麻醉科,江西 鹰潭 335000;2.宁波市医学科学研究所,浙江 宁波 315000;3.浙江大学医学院附属第一医院麻醉科,浙江 杭州 310002)
脑卒中是最常见的心血管疾病疾病之一,87%的中风可被归类为缺血性脑卒中,已成为全球范围内的严重健康问题[1]。目前除溶栓治疗外,针对缺血性中风引起的神经功能损伤尚无有效的治疗手段,因此迫切需要开发用于治疗脑卒中的新型药物,对脑卒中病理过程涉及的分子机制进行更深入的探索可能会找到对抗这种复杂疾病的新方法。红景天苷(salidroside,Sal)是大花红景天的主要活性成分,是一种苯丙烷类糖苷化合物,安全性高且药理作用广泛,包括抗氧化应激、抗疲劳、抗炎等作用[1]。近年来有研究表明红景天苷预处理能够明显减少大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型的梗塞面积,预防脑水肿,改善神经功能,其潜在分子机制涉及多种信号传导途径(如PI3K/Akt/HIF、GSK-3β/Nrf2信号通路)[2]。
微阵列技术可以快速筛选出与脑卒中相关的差异基因表达信息。结合生物信息学分析,可以分析红景天苷预处理前后对影响脑组织缺血/再灌注的差异表达基因在脑卒中发病中的功能途径。Lai等[3]最初在2015年的GSE52001数据集中筛选了与红景天苷介导的神经保护作用相关的基因表达。但是该研究仅关注并研究了其中一些基因的功能。为了更全面地了解红景天苷对抗脑缺血/再灌注损伤的发病机理,我们使用了多种生物信息学技术来重新分析GSE52001数据集中的部分数据。这项工作将提供脑卒中在分子水平上病理生理学的进一步见解,并探索新的潜在分子靶标。
1 材料与方法
1.1 微阵列数据来源和差异基因的筛选从高通量基因表达数据库(gene expression omnibus,GEO)(https://www.ncbi.nlm.nih.gov/geo/)下载微阵列表达数据。全基因组微阵列表达谱由Agilent GPL14746平台提供,因为经过红景天苷预处理的大鼠缺血脑组织中Egr2、Egr4和Arc等早期基因在1h的表达上调最明显,因此本文重点分析了缺血脑组织和经红景天苷预处理1h的缺血脑组织的测序数据。根据原始数据的注释信息,将探针转换为相应的基因名。当多个探针对应同一个基因时,仅筛选具有最高平均表达水平的探针。使用R/Bioconductor Limma软件包对每个实验的基因表达数据进行预处理标准化。线性模型拟合后,使用贝叶斯线性模型可以识别差异基因。P<0.05和|logFC|>1作为差异基因的截止标准。分别使用R软件包“pheatmap”和“ggplot2”进行热图和火山图的可视化作图。
1.2 差异基因的富集分析本项研究中,使用R语言对差异基因进行了的基因本体论(gene ontology,GO)富集和《京都议定书基因与基因组百科全书》(The Kyoto Encyclopedia of Genes and Genomes,KEGG)相关途径分析。另外使用R中的“clusterProfiler”包进行了基因集富集分析(gene set enrichment analysis,GSEA),使用ggplot2包在R语言中进行了可视化作图。
1.3 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建和可视化以及核心基因的确定单个基因并不能调节生物学功能,蛋白质-蛋白质相互作用是细胞中生物学过程的主要参与者,使用STRING数据库(https://string-db.org/)能够找到的蛋白质的全面信息,用于评估蛋白质-蛋白质相互作用网络信息。随后,通过Cytoscape软件(版本3.7.1)构建并可视化了PPI网络。使用Cytoscape中的MCODE(分子复合物检测)插件分析来筛选PPI网络的最重要模块。选择标准如下:MCODE score ≥3, degree cutoff=2, node score cutoff=0.2 and max depth=100,使用Cytoscape软件(版本3.7.1)构建了可视化网络。
1.4 TF-DEGs-microRNA网络构建将这些DEGs上传到NetworkAnalysts,从ENCODE数据库预测针对DEGs的TF,TarBase预测与DEGs相关的microRNA,最后在Cytoscape中建立TF-DEGs-microRNA网络并将其可视化。
2 结果
2.1 差异表达基因将芯片归一化处理后(Fig 1A),通过R语言的Limma软件包计算,将P<0.05和| logFC |> 1定义为差异基因的筛选标准。总共筛选出250个DEGs,包括82个上调的DEGs和168个下调的DEGs。DEGs由火山图(Fig 1B)和热图(Fig 1C)展示。
2.2 差异基因的功能富集分析为了进一步研究这些差异基因的功能,通过R语言进行了GO术语和KEGG通路分析。这些差异基因均分为3个主要功能类别,即生物过程(biological processes,BP)、分子功能(molecular function,MF)和细胞成分(cellular components,CC)。结果表明,这些差异基因主要参与类固醇代谢、激素代谢和白细胞介素1β(IL-1β)等生物学过程(Fig 2A)。在分子功能(MF)层面,主要与受体配体活性、神经递质结合和激素活性相关(Fig 2B)。在细胞组分(CC)分析中,DEGs主要富集在细胞外基质和胶原蛋白细胞外基质(Fig 2C)。在KEGG数据库中发现这些差异基因和神经活性配体-受体相互作用、钙信号通路和PPAR信号通路密切相关(Fig 2D)。此外,我们对微阵列中的所有基因进行了GSEA分析。GSEA分析的结果表明,红景天苷预处理在大鼠脑缺血模型中主要影响了“雌激素代谢”、“脂肪酸合成”、“IL6-JAK-STAT3信号通路”以及“干扰素γ”(Fig 3A-D)。
2.3 PPI网络构建和关键模块分析为了研究这些DEGs之间的蛋白质相互作用及其参与调控的关键基因。在STRING(V11.0)中构建了PPI网络,使用软件工具Cytoscape对网络进行可视化,并试用 Cytoscape中MCODE进行的模块分析,从PPI网络中筛选出一个最重要模块(Fig 4),共有20个基因。 我们发现Egr2、Nr4a1、Egr1和Fos与排名前十的显著变化的差异基因重叠。
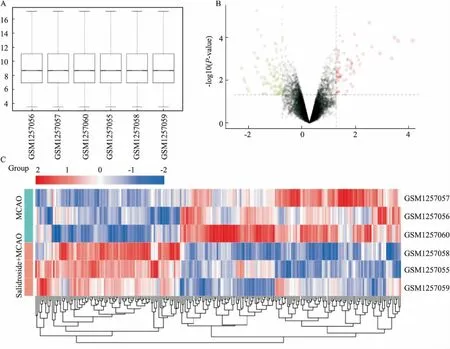
Fig 1 Gene chip quality verification and DEGs screening
2.4 TF-DEGs-microRNA相互作用网络挑选出共同靶向microRNA和TF的DEGs,提取其相关调控因子,并导入至然后在Cytoscape中构建与TF-microRNA相互作用的网络(Fig 5)。我们预测到TAL1和mir-19a-3p能够调节Nr4a1的表达。
3 讨论
本项研究中,一共筛查出250个差异基因,包括包括82个上调的DEGs和168个下调的DEGs。对这些差异基因进行进一步分析,确定了红景天苷参与脑保护作用的潜在作用分子。前10个DEGs(Egr2、Arc、Cort、Egr4、LOC689064、Nr4a1、Egr1、Sik1、Fos和Tnfaip6)被认为是红景天苷对缺血/再灌注脑保护过程的关键基因。PPI网络显示了差异基因之间的相互作用。网络中的关键节点可能是红景天苷在缺血/再灌注的病理过程中起关键作用的分子。通过对PPI网络图中的各个节点的计算节点信息构建出最重要的聚类模块,该模块一共有20个差异基因组成,其中有4个与前10个差异基因相同(Egr2、Nr4a1、Egr1和Fos)。
Nr4a1 (Nur77)是类固醇甲状腺受体家族中孤核受体NR4A亚家族中的一员。目前尚未发现其内源性配体,因此成为孤核受体。作为一个核转录因子,Nr4a1与许多细胞内途径相关,如增生性疾病、代谢性疾病和癌症等[4]。已有大量研究表明,Nr4a1参与多种疾病的病理生理过程,如肿瘤生长、炎症反应、脂肪形成以及血管重塑等[5]。周浩等[6]发现,心脏微血管缺血/再灌注损伤后Nr4a1明显上调,并且其水平与微血管塌陷,内皮细胞凋亡和线粒体损伤呈正相关。另一项研究表明,Nr4a1在再灌注脑组织中显着增加,较高水平的Nr4a1能够降低线粒体动作电位,诱发细胞氧化应激,中断ATP生成,并启动caspase-9依赖性细胞凋亡。并且敲除Nr4a1可减少脑梗死面积并抑制神经元凋亡[7]。另外,小胶质细胞中的Nr4a1作用于 NF-κB/p65信号通路促进中枢炎症因子的表达,从而加剧了缺血在灌注的脑损伤[8]。以上研究结果提示,Nr4a1再组织缺血/再灌注的病理过程中的关键分子。大量的研究支持红景天苷对缺血/再灌注脑保护作用[9]。已知基因的功能受上游转录因子和下游microRNA调控,为了进一步分析Nr4a1参与脑保护的分子机制,我们利用生物信息学技术,整合了多个数据库,最终构建了TF-DEGs-microRNA的协同调解网络。其中Nr4a1与TAL1和mir-425-5p存在相互调节关系。TAL1是一种转录因子,主要识别GATA的启动子序列。主要在红细胞和红细胞相关的细胞系中表达,目前研究认为,TAL1可以促进类红细胞向红细胞的分化[10]。miRNA是内源性非编码RNA,其功能是降解或抑制靶基因的翻译过程,从而在转录后水平调节基因表达。已有多项研究表明,抑制mir-19a-3p可缺血性/再灌注脑损伤[11]。TAL1是否能够调控Nr4a1的表达,Nr4a1是否为mir-19a-3p的靶基因,这部分研究内容尚处于空白状态。因此我们的研究结果为红景天苷在脑保护作用的研究中提供了新的思路。

Fig 2 GO enrichment analysis of DEGs and KEGG
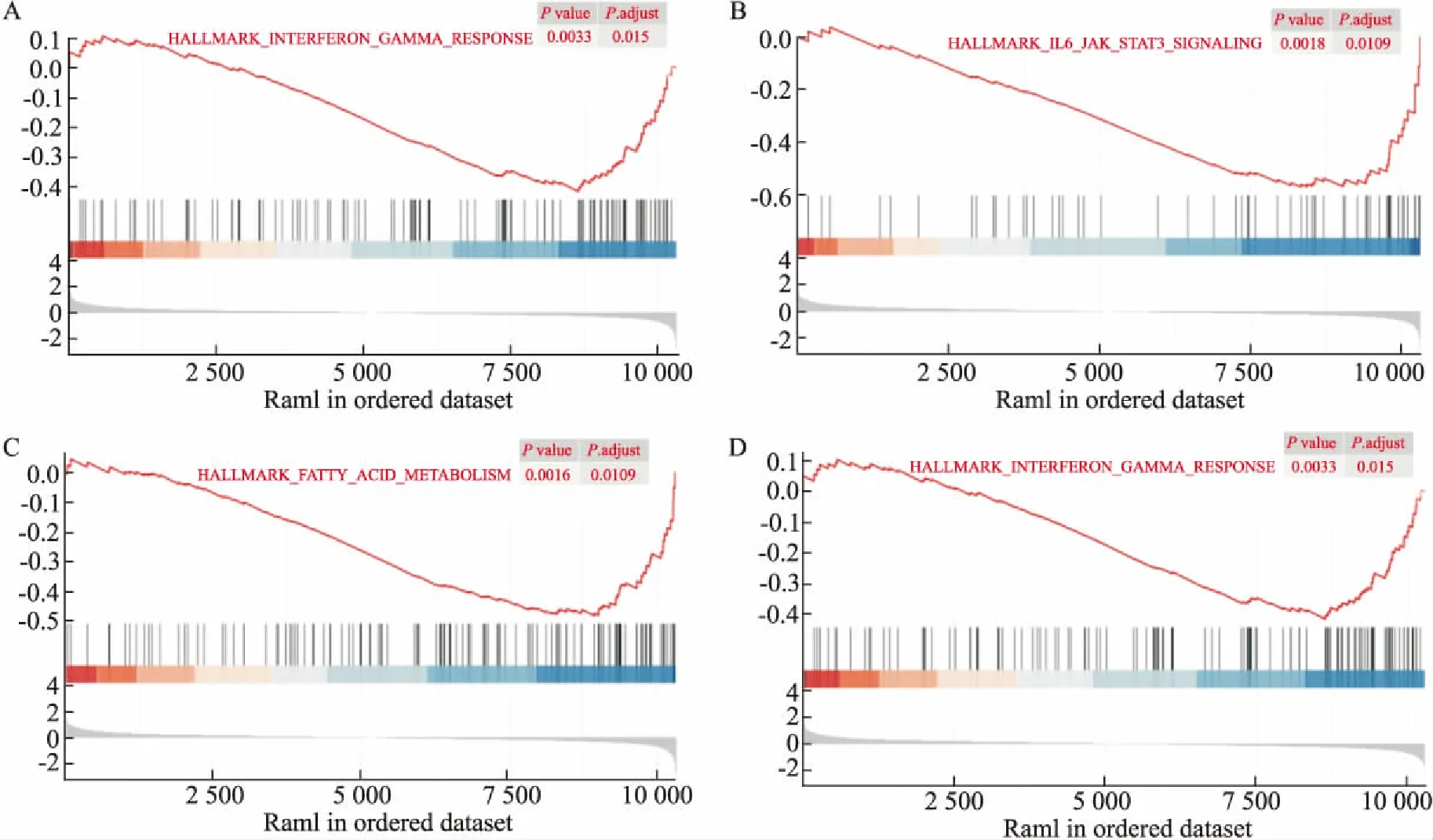
Fig 3 GSEA analysis of all genes
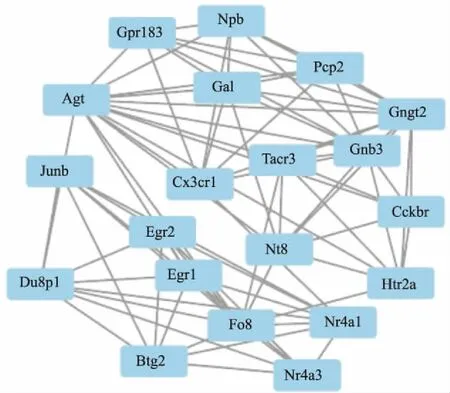
Fig 4 PPI network reconstruction and key module screening
大脑缺血状态会诱导某些早期基因的表达,本项研究发现,缺血/再灌注模型中能够明显调节几种相关基因的转录(Egr1、Egr2、Egr4和Arc等)。有研究报道这些基因参与神经元的突触可塑性。早期基因Arc是神经元突触可塑性的关键调节因子,参与维持LTP和长期记忆的巩固[11],并且对突触活性高度敏感,也可以通过突触可塑性刺激诱导早起生长反应基因Egr家族基因的表达[12]。因此,我们的数据支持红景天苷可以通过参与Egrs和Arc来增强缺血性脑损伤后突触可塑性的观点。另外一项研究结果发现,红景天苷介导的神经保护作用与早期生长反应基因(Egrs)的诱导有关[3],与我们的生物信息学分析一致,并支持了我们的分析结果。
为了获得对这些差异基因的全面理解,我们使用多种生物信息学技术分析这些差异基因。GO的生物学过程主要包括类固醇代谢、激素代谢和IL-1β的产生。此外KEGG富集分析表明,这些差异基因与神经活性配体-受体相互作用、钙信号通路和胆固醇代谢相关。多项研究表明,在研究脑缺血后的损伤机制和预后时,类固醇都是重要的考虑因素。临床研究表明,由于雌激素的保护作用,男性的中风发生率显著高于女性,且女性绝经后的中风发生率也远高于绝经期。动物研究和临床研究一致,在缺血/再灌注模型中,雌性成年大鼠的梗死面积远远小于雌性成年大鼠[13]。值得注意的是,糖尿病模型的大鼠对缺血的易感性也远小于对照组,因为糖尿病大鼠雌激素代谢障碍,体内雌激素水平较高[14]。以上研究表明,内源性雌激素对脑卒中的保护作用。
除了雌激素,孕酮等类固醇激素也降低了女性中风的发生率。另一方面,动物研究也支持了类固醇激素的脑保护作用。孕酮治疗可减少缺血性梗塞的程度并促进愈后,其潜在的分子机制包括孕酮能够减少血脑屏障的破坏和减轻脑水肿。脑缺血后,会出现急性和长期炎症反应,包括小胶质细胞和星形胶质细胞的早期活化,促炎性细胞因子和趋化因子的合成和释放以及嗜中性粒细胞、T细胞和巨噬细胞向脑实质的浸润。这一系列级联反应加速了神经元的死亡和脑损伤的程度[15]。孕酮治疗可调节小胶质细胞的密度和极化,并减少促炎性细胞因子和一氧化氮合酶产生。此外,孕酮治疗还可以减少脑线粒体功能障碍,可增加神经元,少突胶质细胞及其前体的密度等[16]。以上研究表明了孕酮的脑保护作用且上述证据与KEGG分析相符。
为了验证GO和KEGG途径富集分析的一致性,接下来对所有基因进行了GSEA分析。分析表明,红景天苷预处理的脑缺血模型主要影响了雌激素代谢、脂肪酸代谢和炎症反应和干扰素通路密切相关[17]。
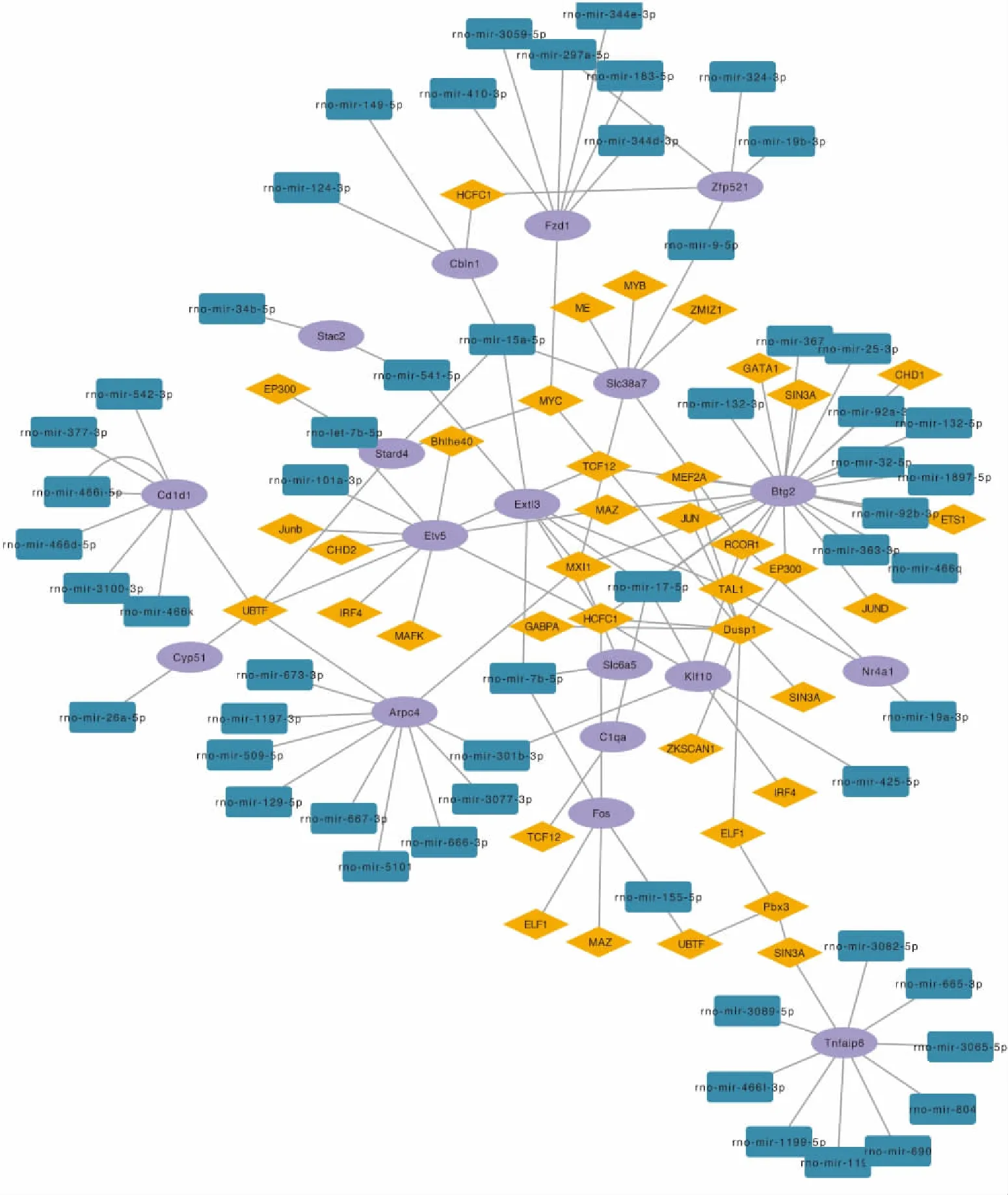
Fig 5 TF-DEGs-microRNA interaction network
这项研究的主要目的是鉴定与红景天苷预处理的脑缺血模型相关的候选基因,为红景天苷的脑保护作用提供潜在的分子靶标。通过多种生物信息学分析发现其主要通过类固醇代谢、激素代谢和炎症因子水平等方面发挥脑保护作用。并鉴定出红景天苷预处理对抗脑卒中的关键候选基因。尽管此研究中鉴定的基因在先前的研究中得到了证实,但仍需要进一步的研究来探索这些基因和途径的具体调控机制。
——题《圣山系-金巅》

