TGF-β1通过ERK1/2通路上调人肝星状细胞程序性死亡配体1的表达
李培培,鲍士祥,金 帅,常 伟,路景涛,,魏 伟
(安徽医科大学1. 临床药理研究所、2. 生命科学学院,安徽 合肥 230032)
肝星状细胞(hepatic stellate cells,HSCs)是肝脏主要的间质细胞之一,在肝纤维化和肝癌的发生、发展中起了重要作用。正常时HSCs作为储脂质细胞占肝脏细胞总数8%~13%,主要参与体内维生素A、胶原等基质的代谢。静止状态的HSCs,不表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),具有低增殖活性,低合成胶原能力。肝损伤时,在肝炎病毒或细胞因子作用下,静止的HSCs被激活,脂质消失,表达α-SMA,发生形态学改变,转化为激活的HSCs(aHSCs)。HSCs激活是肝纤维化形成并发展为肝癌核心环节[1],aHSCs在“肝炎-肝纤维化/肝硬化-肝癌”肝癌发生过程中发挥重要的作用。文献报道,aHSCs可增加肿瘤组织中骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)和调节性T细胞(regulatory T cell,Treg),从而促进肝癌的发展[2]。aHSCs通过免疫调节作用,可抑制T细胞反应、诱导T细胞凋亡、减弱T细胞对肿瘤细胞的杀伤[3]。
B7家族抑制性分子程序性死亡配体1(programmed death ligand-1,PD-L1)是近来发现的B7超家族I 型跨膜糖蛋白,在促进活化T细胞凋亡和抑制活化的T细胞增殖等方面有重要的作用。PD-L1表达在多种免疫细胞和外周组织,如内皮细胞、肝细胞、肝星状细胞和多数肿瘤细胞中[4]。程序性死亡因子1(programmed death factor 1,PD-1)是属于CD28/CTLA-4家族的PD-L1的受体,主要表达在T细胞表面。PD-L1与PD-1结合后能产生负性调节作用,导致T细胞反应下降,诱导T细胞凋亡,减弱T细胞对肿瘤杀伤,促进肿瘤发生、发展[5]。PD-L1的表达与多种肿瘤的进一步发展和预后复发有关,因此PD-L1临床应用价值可作为肿瘤预后的指标。文献报道PD-L1在aHSCs表面高表达,参与aHSCs的免疫调节,诱导肝癌免疫耐受,促进肝癌发生、发展[6]。
转化生长因子β1(transforming growth factor β1,TGF-β1)是一种细胞因子,在肝癌微环境中的大量存在,可调节细胞分化和生长,抑制免疫功能,促进肝癌发生与发展[7]。大量研究表明,TGF-β1作为HSCs活化中的关键因子,可促进HSCs增殖,影响HSCs分泌的细胞因子,促进肝癌发展[8]。但TGF-β1能否通过上调HSCs表面PD-L1的表达,抑制免疫功能,促进肝癌发生与发展,未见文献报道。本文研究了TGF-β1对HSCs表面PD-L1表达的影响及可能的作用机制。
1 材料与方法
1.1 材料
1.1.1细胞株 人肝星状细胞系LX-2,购于中南大学湘雅医学院。
1.1.2主要试剂 重组人TGF-β1(批号0611209-1)购于美国Peprotech公司;PD-L1抗体(批号13684S)、ERK1/2单克隆抗体(批号4695)、p- ERK1/2单克隆抗体(批号9101)购于美国CST公司;PE标记的PD-L1流式抗体(批号329706)购于美国Biolegend公司;U0126(批号U120)购于美国Sigma公司;胎牛血清(FBS)、RPMI-1640培养液购于加拿大WISENT公司;聚偏氟乙烯微孔转移膜(PVDF)购于美国Millipore公司;ECL化学发光显影试剂盒购于美国 Thermo 公司。
1.1.3主要实验仪器 FC500 流式细胞仪:Beckman Coulter 公司;CKX41倒置显微镜:日本Olympus光学工业株式会社;CO2培养箱:美国Thermo Fisher Scientific;WB显影仪:美国Thermo Scientific。CP225D电子分析天平: 德国Sartorius仪器公司产品。
1.2 实验方法
1.2.1TGF-β1刺激LX-2细胞 取对数生长期的LX-2,0.25% 的胰酶消化,细胞计数,将1×109个·L-1细胞接种于6孔板,毎孔1 mL,5% CO2,37 ℃培养;4 h后弃培养液,加入含有TGF-β1(0、5、10、20 μg·L-1)的培养基培养。
1.2.2流式细胞术检测PD-L1 TGF-β1(5、10、20 μg·L-1)刺激48 h或TGF-β1(10 μg·L-1)刺激24,48,72 h后,0.25% 的胰酶消化LX-2细胞,轻轻吹打分散后,加入到离心管中,1 500 r·min-1离心10 min,弃上清;PBS洗涤2次,加入流式管中,每管100 μL细胞悬液;将PD-L1抗体按抗体说明书,用PBS稀释成适当比例,加入流式管,轻轻震荡混匀,室温避光孵育30 min;补加300 μL PBS,流式细胞仪检测细胞荧光强度;数据采用FlowJo 软件进行分析。
1.2.3Western blot检测LX-2细胞PD-L1、ERK1/2和p-ERK1/2表达 TGF-β1(0、5、10、20 μg·L-1)或TGF-β1 (10 μg·L-1)加 U0126 (5 μmol·L-1) 刺激48 h后,弃上清,4 ℃预冷的PBS洗涤2次。弃PBS后,将细胞置于冰上,100 μL裂解液冰上裂解30 min;4 ℃,12 000 r·min-1离心15 min,吸取上清;蛋白定量,煮沸10 min,-20 ℃保存备用。上样,110V电泳1 h,200 mA电流转移2 h;PVDF膜放入0.05% Tween-20的PBS(PBST)中37 ℃封闭2 h;加PD-L1(1 ∶500)、ERK1/2(1 ∶500)、p-ERK1/2(1 ∶500)、β-actin(1 ∶1 000)一抗4℃孵育过夜;PBST洗10 min ×3次;加入羊抗鼠或羊抗兔IgG二抗(1 ∶5 000),室温孵育2 h,凝胶成像系统扫描,Image-Pro Plus软件分析。
2 结果
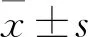
2.1 TGF-β1上调LX-2 细胞表面PD-L1的表达流式结果显示,与对照组相比,不同浓度的5、10、20 μg·L-1TGF-β1刺激LX-2细胞48 h后,明显增加了LX-2细胞表面的PD-L1表达(Fig 1A,1B)。同时,10 μg·L-1TGF-β1刺激LX-2细胞 24、48、72 h,时间依赖性增加了细胞表面PD-L1的表达水平(Fig 1C,1D)。
2.2 TGF-β1增加LX-2细胞p-ERK1/2的表达Western blot结果显示,与对照组相比,10、20 μg·L-1TGF-β1明显增加LX-2细胞中p-ERK1/2的表达(P<0.01或P<0.05),但5、10、20μg·L-1TGF-β1对ERK1/2的表达没有明显影响(Fig 2A)。10、20 μg·L-1TGF-β1明显增加p-ERK1/2 / ERK1/2的比值。提示TGF-β1上调LX-2细胞表面PD-L1的表达可能与ERK1/2通路有关。
2.3 U0126下调TGF-β1诱导的LX-2细胞表面PD-L1的表达以上结果表明TGF-β1上调LX-2细胞表面PD-L1的表达可能与ERK1/2通路有关,为了进一步确定TGF-β1上调LX-2细胞表面PD-L1的表达与ERK1/2通路上调有关,TGF-β1刺激LX-2细胞,加入ERK1/2通路特异性阻断剂U0126,流式细胞术及Western blot检测PD-L1表达,Western blot检测p-ERK1/2和ERK1/2的表达。结果显示,TGF-β1增加LX-2表面PD-L1和p-ERK1/2的表达(P<0.01),U0126能够下调TGF-β1上调的LX-2细胞表面PD-L1和p-ERK1/2的表达(P<0.01,P<0.05)(Fig 3A-3F)。提示TGF-β1通过ERK1/2通路上调LX-2细胞表面PD-L1的表达。
3 讨论
肝星状细胞、淋巴细胞、上皮细胞、细胞因子、肝癌细胞等构成HCC微环境,在HCC发生、发展中的发挥了重要作用。HCC组织中,肝血窦癌细胞旁、坏死灶周边及肝癌胞膜下均可见HSCs数量明显增多。肝癌细胞可诱导HSCs活化,同时活化的HSCs又反作用于肝癌细胞,呈级联放大效应,形成利于肝癌生长的微环境,最终促进肝癌细胞生长、侵袭及转移[9]。近年来文献报道aHSCs有较强的免疫调节作用,可表达多种免疫相关分子,直接参与局部免疫调节[10]。同时,aHSCs抑制T细胞反应、减弱T细胞对肿瘤细胞的杀伤,提高肿瘤组织中Treg和MDSCs比例,从而促进肿瘤的发生发展[11]。
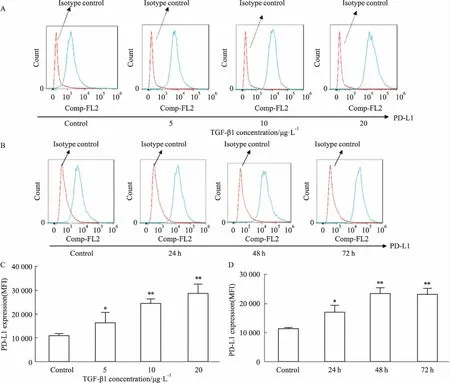
Fig 1 TGF-β1 up-regulated PD-L1 expression on LX-2
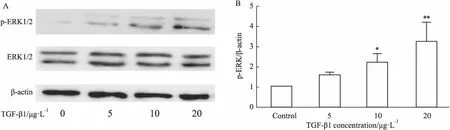
Fig 2 TGF-β1 increased p-ERK1/2 expression in LX-2
Fig 3 U0126 reduced PD-L1 expression in LX-2
PD-L1是近年发现的B7家族的主要新成员之一,与癌旁组织和正常组织相比,肝癌组织中PD-L1表达的水平明显升高。PD-L1的阳性表达与癌组织分化程度、侵袭转移相关,并成为肿瘤预后判断新的生物学指标。文献报道aHSCs表达的PD-L1可与活化T细胞表达的PD-1结合,抑制T细胞反应,诱导T细胞凋亡,最终诱导肝癌免疫耐受,促进肝癌发展[12]。在肝癌微环境中,TGF-β1为大量存在的细胞因子之一,TGF-β1可激活癌症相关的纤维化细胞、HSCs细胞、肿瘤相关的巨噬细胞[13]。TGF-β1促进HSCs增殖和激活,促进肝癌发展[14]。我们前期研究发现,TGF-β1可上调DC表面PD-L1的表达,减弱T细胞对肝癌细胞的杀伤,促进肝癌的发生、发展。但TGF-β1是否能诱导HSCs上PD-L1表达,并促进肝癌的发展目前未见报道。由此我们采用流式细胞仪和Western blot方法检测了TGF-β1对人肝星状细胞LX-2细胞PD-L1表达的影响。结果显示TGF-β1明显上调LX-2细胞PD-L1的表达。接着我们考察了TGF-β1上调LX-2细胞PD-L1的表达的机制。文献报道,TGF-β1可以通过MAPK通路促进肝纤维化的形成[15]。哺乳动物存在3种不同的MAPK通路,包括细胞外调节激酶ERK1/2通路、c-Jun氨基末端激酶JNK通路和p38 MAPK通路,其中TGF-β1主要激活HSCs上ERK1/2通路[16]。文献同时报道诱导细胞 PD-L1表达与MEK/ERK1/2通路、PI3K/AKT通路、NK-κB、JAK/STAT 信号通路和STAT-3有关[17-18],由此推测TGF-β1上调LX-2细胞表面PD-L1表达可能与ERK1/2和p-ERK1/2表达有关。Western blot和流式细胞术结果显示,TGF-β1能明显增加LX-2细胞中p-ERK1/2表达,而对ERK1/2没有影响。推测TGF-β1增加LX-2细胞中ERK1/2磷酸化。为了进一步证明TGF-β1/ERK1/2是否参与调控LX-2细胞表面PD-L1表达,我们使用ERK1/2特异性阻断剂U0126。流式和Western blot结果显示,U0126阻断LX-2细胞中ERK1/2通路后,PD-L1在LX-2细胞表面的表达明显减少。以上结果表明TGF-β1通过ERK1/2通路上调LX-2细胞表面PD-L1的表达,本研究将为HCC的发病机制和免疫治疗提供理论依据。

