肠道菌群与药物相互作用机制的研究进展
张雅婷,孙月梅,张娟红,霍 妍,李 雪,李文斌,赵安鹏,王 荣
(1.兰州大学药学院,甘肃 兰州 730000;2.中国人民解放军联勤保障部队第九四○医院全军高原医学重点实验室,甘肃 兰州 730050)
人体的胃肠道,尤其是结肠中,富集着数以亿万计的肠道菌群,这些微生物所编码的基因组是人体本身基因的50~100倍,有“被遗忘的器官”之称。全息进化理论深刻揭示了肠道菌群和人体的共生关系,二者将作为共生体一起适应环境的变化[1]。人体的多种疾病和病理状态如肠易激综合征、代谢性疾病、精神疾病和癌症等都和肠道菌群有关,其中肥胖、心脑血管疾病和糖尿病等已证明和肠道微生物有着直接的联系。此外,肠道菌群作为人体的一个“隐形器官”,其在药物代谢方面发挥的作用受到越来越多的关注。肠道是药物吸收的主要场所之一,口服药物被吸收入血之前,首先会暴露于肠道菌群中,丰富的肠道微生物通过分泌水解酶,裂解酶,氧化还原酶和转移酶等丰富酶系和生物活性分子来影响药物的吸收和代谢,从而改变药物的效能和毒性[2]。成年人的肠道微生物群通常是一个动态平衡的微生态系统,存在的优势菌门通常为厚壁菌门,拟杆菌门,变形菌门和放线菌门等。但肠道微生物的组成和功能会受到多方面因素的影响,如宿主的遗传、年龄、性别、饮食、疾病、药物等,本课题组前期也研究了高原环境下肠道菌群的变化以及对药物代谢的影响[3]。尽管对药物与肠道菌群之间的关系的研究已成为较受关注的热点,但是对其机制还了解不多。因此,研究肠道菌群-药物相互作用的机制具有重要意义。
1 药物对肠道菌群的影响
众所周知,抗生素作为抗菌药物会对人体携带的菌群产生影响及损伤,人们对抗生素如何影响肠道菌群也有了越来越深入的了解。除此之外,有很多非抗生素药物也会对肠道菌群产生影响,Maier等[4]用40种代表性肠道细菌菌株对市售的1 000种药物进行筛选,其中有27%的非抗菌药物也展现出抗菌活性。Vich等[5]在临床分析中,从41种药物中鉴定出19种药物和粪便宏基因组特征存在关联,除抗生素外,质子泵抑制剂、二甲双胍与菌群组成和微生物通路关联性最强;此外,非甾体抗炎药,非典型抗精神病药也和微生物变化有关。因此,了解药物对肠道菌群的作用机制是很有必要的。
1.1 抗生素类药物对肠道菌群的影响肠道菌群大部分是对人体无害的,其种类、数量以及分布通常处于一种稳态,这种自发的稳态形成了对病原菌一定的抵御能力,在维持人体健康以及发挥正常生理功能中发挥着重要作用。抗生素类药物会造成肠道菌群的失衡,且不同抗生素不同的作用机理使其在作用于人体复杂的生态系统后,对肠道菌群组成产生的影响不尽相同。
在一项安慰剂对照的实验中,研究者对12名健康受试者进行了头孢吡肟对肠道菌群影响的研究,连续8d用头孢吡肟治疗后,观察到粪便中的大肠杆菌和双歧杆菌的数量减少,而拟杆菌属和梭状芽孢杆菌的数量略有增加[6]。在研究结束后20~48 d,受试者粪便细菌数量回复正常。厄他培南属于碳青霉烯类抗生素,在对健康受试者的研究中发现,厄他培南在粪便中有较高的回收浓度,但是对肠道菌群产生了比较大的影响[7]。厄他培南显著减少了厌氧菌(乳酸菌、双歧杆菌、梭状芽孢杆菌和拟杆菌)的数量,大肠杆菌的数量也有所降低,而肠球菌的数量却增加了。厄他培南治疗7 d后,受试者肠道菌群在d 21~35恢复正常。Nord等[8]对健康受试者连续7d使用抗生素(包括头孢洛林,头孢吡普,特拉万星和替加环素)后,发现替加环素对人体肠道菌群数量的变化产生更广泛的影响,即肠球菌,双歧杆菌和大肠杆菌的数量减少,其他肠杆菌和酵母菌数量增加,但是头孢吡普,头孢洛林和特拉万星均未在粪便中检出,且引起肠道菌群变化量较小,即未对人体的生态环境产生明显影响。
1.2 非抗生素类对肠道菌群的影响
1.2.1降糖降脂类药物对肠道菌群的影响 肠道菌群失调是导致高血糖,高血脂症等与肥胖相关的代谢性疾病的重要因素。二甲双胍是被广泛应用于治疗二型糖尿病(T2D)的一线药物,其作用原理仍未被完全了解。根据目前研究,二甲双胍可通过不同的机制发挥其多效性[9]:在分子水平上,二甲双胍可通过参与肝脏糖异生中的自主调节,抑制线粒体呼吸链复合物,抑制线粒体甘油-3-磷酸脱氢酶,发挥长期降糖效果;同时影响代谢器官中不同的常驻型免疫细胞,改善特定组织的胰岛素敏感性。在生理水平,二甲双胍调节胆汁酸的肠肝循环胆汁酸的再循环,促进分泌肠道胰高血糖素样肽1,产生降低血糖的作用。肠道菌群是二甲双胍作用的新靶点,其中涉及到一些新的治疗机制。
T2D患者体内有着显著的菌群失调的现象,二甲双胍可以改变菌群组成和数量,影响肠道代谢物的产生从而产生降糖效果。根据Forslund等[10]的研究,二甲双胍增加了埃希氏杆菌的数量,增加产短链脂肪酸(SCFA)菌的数量从而发挥药效。Sun等[11]对菌群-胆汁酸-法尼酯X受体(FXR)轴进行了研究,T2D患者经二甲双胍治疗后,肠道菌群中脆弱拟杆菌显著减少,肠道中的甘氨熊去氧胆酸(GUDCA)和牛磺熊去氧胆酸(TUDCA)水平上升,GUDCA和TUDCA是FXR拮抗剂,可抑制肠道FXR信号,改善血糖稳态。肠道菌群和药物及人体之间存在复杂的相互作用,二甲双胍除了直接作用于人体的降糖途径,还会通过直接影响肠道菌群来对人体产生间接的降糖效果,以上研究促进了对二甲双胍以肠道菌群介导的降糖机制的了解。
他汀类药物是治疗心血管疾病的常用药。在以高血脂小鼠为模型的研究中发现,阿托伐他汀和瑞舒伐他汀不仅观察到相似的药代动力学,功效和副作用,更引起了肠道菌群的相似变化,即显著增加了拟杆菌属、丁酸单胞菌属和黏蛋白杆菌属的丰度[12]。拟杆菌(Bacteroidetes)和厚壁菌(Firmicutes)是肠道主要的细菌门,其比例与肥胖相关的代谢紊乱有关,随着他汀类药物治疗引起的代谢改善,观察到F / B比降低;拟杆菌和丁酸菌属是产生丁酸的细菌,丁酸是主要的SCFAs之一,而SCFAs对宿主能量代谢具有改善作用。
1.2.2口服益生菌类对肠道菌群的影响 根据世卫组织2002年提出的对益生菌的定义,益生菌被定义为:当给予足够的量时可以对宿主带来健康益处的活的微生物。口服益生菌会影响肠道菌群组成和数量,从而对肥胖等代谢性疾病、精神疾病、癌症、口腔疾病等产生一定的防治效果。
肥胖是很多代谢类疾病如心血管疾病,糖尿病的源头,肠道菌群可以改变以能量代谢平衡为中心的多种代谢途径,从而影响肥胖的发生发展。饮食中的膳食纤维经结肠特定厌氧菌代谢后产生的短链脂肪酸(SCFAs), SCFAs及其受体途径,被认为是饮食与肠道微生物-宿主稳态的一个重要环节。肠细胞表面的G蛋白偶联受体GPR41和GPR43被SCFAs特异性激活时可以促进肠道分泌酪酪肽(PYY)和胰高血糖素样肽-1(GLP-1),PYY可诱导饱腹感和能量消耗,GLP-1可诱导肥胖个体的胰岛素分泌和脂肪减少;脂肪细胞上受体GPR43与SCFAs结合后促使细胞分泌瘦素,使机体增加能耗,减少摄食,进而促使减轻体重[13]。肠道中可分泌产生SCFAs的菌有:拟杆菌类、乳杆菌类、双歧杆菌类、瘤胃球菌类等。口服益生菌类可以通过影响肠道菌群组成及代谢影响SCFAs的产生,从而影响此类代谢疾病。Shin等[14]将大鼠随机分成:平衡饮食组、平衡饮食+益生菌配方(DG)组、高脂饮食(HFD)组、HFD+DG组进行试验,发现DG组大鼠SCFAs来源菌的量显著增加,如拟杆菌门、乳杆菌属和双歧杆菌的相对丰度明显增加,而厚壁菌门的相对丰度显著降低。因此,给药8周后,DG有效地降低了HFD诱导的体重增加。这项研究支持了使用益生菌影响肠道菌群从而治疗肥胖的观点,而益生菌对精神疾病,癌症等方面的作用及其相关机制还需进一步深入佐证和研究。
2 肠道菌群对药物的影响
2.1 肠道菌群对中药成分代谢的影响肠道菌群对中药成分的代谢主要是通过分泌各种代谢酶来完成的,人体肠道细菌种类繁多,其分泌的主要酶的类型有糖苷酶,硝基还原酶,偶氮还原酶等。肠道菌群对中药成分的代谢以水解为主,氧化和还原为辅。经过肠道菌群代谢之后,中药成分结构会发生脱氢,脱羟基,脱糖基等变化,转化成不同的代谢产物。中药成分会转化为相应新的活性代谢产物,从而发挥其药理疗效[2]。目前对肠道菌群对不同中药成分代谢的研究有黄酮类、皂苷类、生物碱类、蒽醌类、单萜类、甾体类、木脂素类化合物等。Tab 1中展示了一些代表性化合物的代谢反应,并给出了相关代谢菌[15-19]。
2.2 肠道菌群对化学药物代谢的影响肠道菌群对药物有多种修饰作用,其中最主要的为还原作用和水解作用,此外还可以产生脱烷基、去甲基、脱羧、乙酰化、去氨基、解偶联等,可以给药物带来活化、再活化、失活、毒化等影响。例如,洛伐他汀K (MK)是一种天然产生的他汀类药物,只有以β-羟基酸(MKA)的形式存在时才有降脂效果。根据Beltrán等[20]的报道,肠道微生物不会将MK激活为MKA,反而可能通过降解活性代谢物MKA而阻碍降脂作用。所以从这一点可以认为某些肠道菌群不利于MK发挥降脂作用。Zhang等[21]将肠道菌群对近30种多种药物的代谢作用进行了统计,经肠道菌群代谢后的化学成分的生物利用度也会有所变化,其变化趋势通常与活性变化趋于一致。肠道菌群对化学药物及部分天然活性因子产生的影响主要如Tab 2所示。
3 肠道菌群对药物作用的影响机制
3.1 肠道菌群对药物代谢的直接影响人体和肠道菌群作为密不可分的共生体,通过微生物群落—宿主共代谢形成了对药物共代谢的能力。宿主药物代谢体系主要通过Ⅰ相代谢及Ⅱ相代谢来完成。Ⅰ相代谢为暴露基团反应,相关反应主要为氧化,还原和水解,相关酶为P450酶系。Ⅱ相代谢为结合反应,相关反应为葡萄糖醛酸化、磺化、乙酰化等,相关酶为β-葡萄糖醛酸酶、磺基转移酶、尿苷5′-二磷酸葡萄糖醛酸基转移酶/UDP-葡萄糖醛酸基转移酶(UGT)、氮乙酰转移酶和葡萄糖硫酮硫转移酶等。除了宿主分泌的代谢酶之外,肠道微生物分泌的多种代谢酶也在微生物-宿主共代谢中发挥着重要的作用。
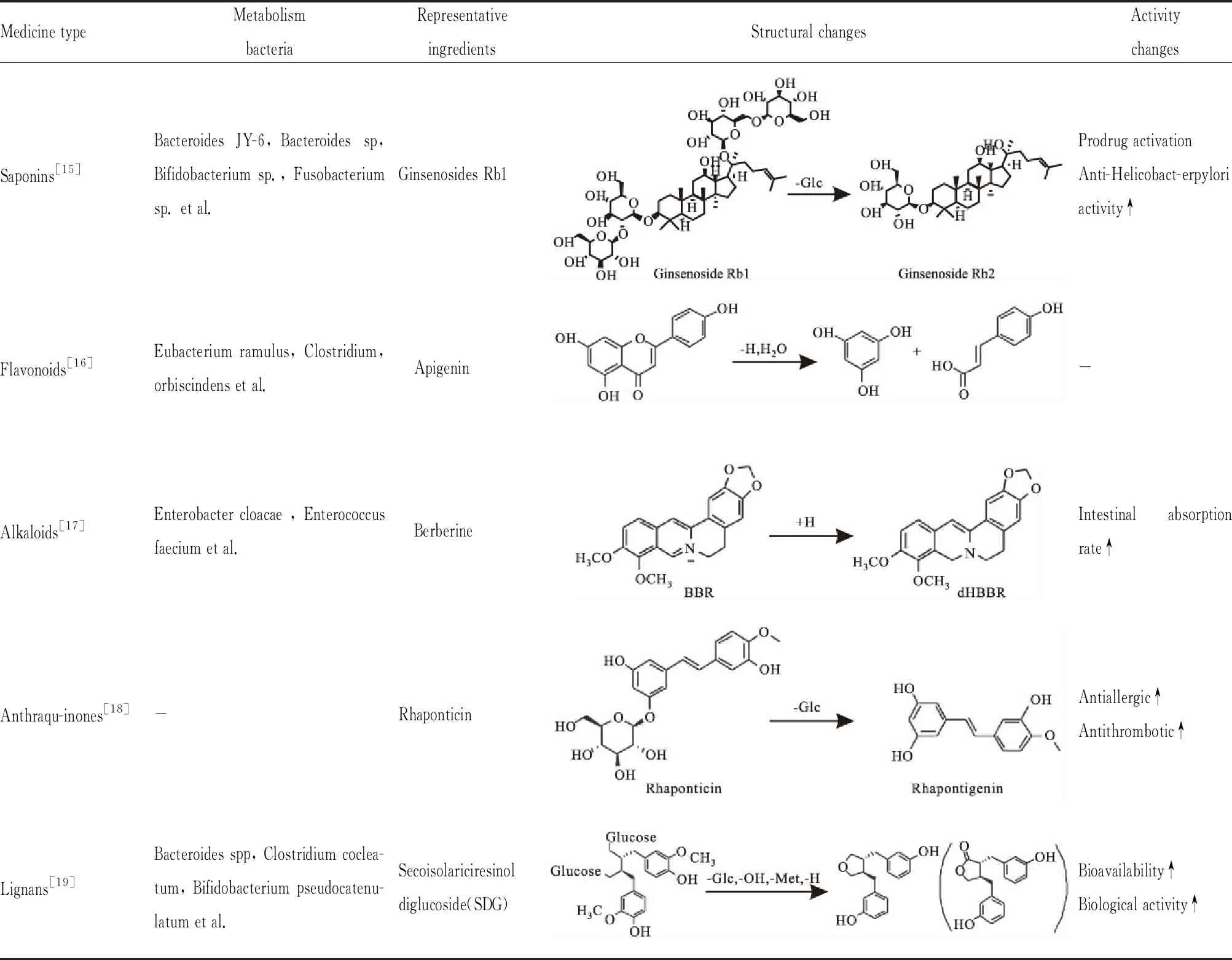
Tab 1 Pathways of representative active components of Chinese medicine metabolized by gut microbiota

Tab 2 Effects of intestinal flora on metabolism of drugs and natural active factors
含有5-氨基水杨酸(5-ASA)骨架类药物在临床上常被用于治疗轻、中度溃疡性结肠炎,巴柳氮、奥沙拉嗪、柳氮磺吡啶等都属于5-ASA药物,且这些药物的化学结构中都含有偶氮键,柳氮磺吡啶经偶氮还原酶代谢可产生磺胺吡啶和5-氨基水杨酸,从而产生抗炎活性,如Fig 1所示。偶氮还原酶是人体肠道菌群广泛存在的一种代谢酶,因此可以对柳氮磺吡啶产生直接的代谢作用[22]。
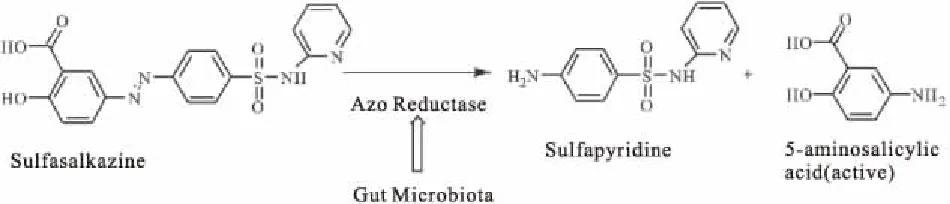
Fig 1 Metabolism of salazosulfapyridine by gut microbiota
伊立替康(CPT-11)是一种结直肠癌化疗药物,主要作用是抑制细胞中的扑拓异构酶Ⅰ,通常以静脉滴注的方式使用,严重腹泻是60%~80%接受伊立替康治疗的患者的剂量限制性副作用。CPT-11进入人体后,首先在肝脏被羧酸酯酶(CEs)转化成具有抗肿瘤活性的SN-38。大部分SN-38会与葡萄糖苷在肝脏葡萄糖醛酸转移酶(UGT1A1)的作用下结合为无活性的SN-38G。SN-38G经胆汁排泄入肠后,容易在肠道微生物产生的β-葡萄糖醛酸苷酶作用下解偶联重新转化为SN-38,SN-38 对肠上皮细胞有毒害作用,其在胃肠道累积会导致患者发生严重腹泻[23]。如Fig 2所示。当给予抗生素治疗时,通过对肠道菌群的抑制可以减少β-葡萄糖醛酸苷酶的产生,从而减少了SN-38G向SN-38的转化,伊立替康的毒副作用大大减轻。
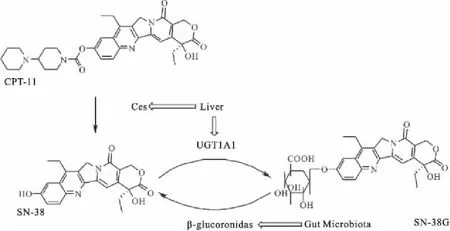
Fig 2 Metabolism of irinotecan by gut microbiota
3.2 肠道菌群对药物代谢的间接影响
3.2.1肠道菌群产生途径中间体影响药物代谢 扑热息痛(APAP)是一种广泛应用的解热镇痛药物,但是扑热息痛过量所导致的肝毒性是导致急性肝衰竭的主要原因[24]。当低剂量时,APAP主要通过硫酸化和葡萄糖醛酸化代谢,而毒性途径主要通过肝脏分泌的谷胱甘肽(GSH)来消除。当肝细胞中APAP浓度升高,大部分APAP会被细胞色素P450酶系的CYP2E1酶代谢成N-乙酰基-对苯醌亚胺(NAPQI)[25],NAPQI具有毒性,可以通过与GSH 结合而解毒,但当GSH不足时,或活性代谢产物的积累会导致肝毒性,进一步造成肝损伤。根据大量临床研究,APAP导致的肝毒性呈昼夜节律性即晨重暮轻[26]。根据这一现象,Gong等[27]研究并揭示了肠道菌群和APAP过量导致的肝毒性之间的联系。首先,当给予小鼠抗生素时可缓解APAP导致的肝损伤,这证明了肠道菌群和APAP肝毒性之间的依赖性关系。对小鼠肠道菌群进行代谢组学分析后,发现其代谢产物之一1-苯基-1,2丙二酮(PPD)同样呈现昼夜节律性,且PPD和APAP对肝损伤有协同作用。在进一步研究后,作者证明了其中机制,肠道微生物产生的PPD和APAP存在对GSH的竞争消耗途径,当PPD对肝脏中的GSH消耗过多后,造成APAP活性代谢产物积累,从而导致严重肝损伤。这项研究说明,肠道菌群通过分泌代谢产物可以间接影响药物肝毒性。
3.2.2肠道菌群引起宿主药物代谢酶及相关转运体的基因改变 微生物定居会引起宿主基因表达的改变。肠道菌群的存在既可以改变参与药物代谢的关键宿主酶,又可以影响相关转运体的表达[28-30]。在药物代谢中,CYP450酶系发挥着重要作用,同时肝脏脏中的异种代谢主要受核受体(NRs)的调控,主要是雄甾体受体(CAR)和孕烷X受体(PXR)。Toda等[30]对比了无菌(GF)小鼠和无特定病原体(SPF)小鼠肝脏中CYP450酶基因的表达,发现大多数CYP同工酶在GF小鼠的肝脏中表达水平更高,PXR和组成型CAR在GF小鼠肝脏中也表达更高。Björkholm等[29]以GF小鼠和SPF小鼠为实验对象来探究肝脏基因谱表达和肠道菌群的关系,肠道菌群的存在可影响高达112个基因的差异表达,其中编码CYP450相关酶系的POR基因具有较大差异;在GF小鼠中也观察到更高水平的核受体CAR,其潜在机制可能是由于胆红素、一级胆汁酸和类固醇激素作为CAR的激活剂增了加了其表达。这些差异可以带来药物代谢水平上的不同,例如Hooper等[28]分别对GF小鼠和SPF小鼠用戊巴比妥进行麻醉诱导实验,发现GF小鼠具有更高的CYP450表达,且GF小鼠从麻醉中恢复的速度比常规小鼠快35%。
4 结论和展望
越来越多的研究证明,肠道菌群和药物之间存在广泛的相互作用,且这种相互作用会对药代及药效产生重大影响,深入了解这种作用,可以为临床上的个体化用药以及药物联用提供更合理的指导。随着科研技术的发展以及研究的进一步深入,在对肠道菌群-药物之间复杂的相互作用机制的探索上也已取得很大进展,但是我们也面临着一些挑战。首先,当下我们为了明确药物的特定作用,多采用无菌动物或假无菌动物。无菌动物价格昂贵;假无菌动物经抗生素治疗后,本身生理状态尤其肠道状态已受到较大干扰,因此要将抗生素的影响和药物的影响加以区分。其次,由动物实验推及人的结果难以预料,如同人体的肠道菌群存在较大的个体化差异一样,动物与人,包括不同的动物品系的肠道菌群也同样存在着差异,而当药物试验从动物转移到人身上时,带来的效果存疑,甚至可能相反。最后,肠道微生物调控药物代谢的机制极其及其复杂,这不仅仅依赖于技术创新如16sRNA、宏观基因测序、代谢组学分析等,更需要药理学、毒理学、分子生物学、分析化学等多种学科知识的综合。现在已有对40余种药物和天然化合物与肠道菌群关系的研究,这对成千上万的药物来说如同沧海一粟,我们需要更加迫切地确定肠道菌群在人体中的作用,以期生产更好药效和更低毒性的药物,推动药物的合理设计。

