食管鳞癌多药耐药细胞建立及干性和上皮间质转化表型鉴定
刘其伟,晁玮霞,焦叶林,张月静,刘瑞敏,齐义军
(1. 许昌学院医学院细胞行为学重点实验室,河南 许昌 461000;2. 河南科技大学医学院临床医学院,第一附属医院,肿瘤医院,河南省肿瘤表观遗传重点实验室,河南 洛阳 471003;3. 洛阳市第一人民医院病理科,河南 洛阳 471003;4. 河南大学医学院细胞与分子免疫学重点实验室,河南 开封 475000)
食管鳞癌(esophageal squamous cell carcinoma,ESCC)是中国食管癌的主要组织学类型[1]。ESCC早期症状不典型,因此大部分首次确诊的ESCC患者已发展至中晚期[2]。化疗是目前ESCC综合治疗方案的重要手段之一,但是,原发性耐药或获得性耐药是导致ESCC治疗失败、ESCC患者死亡的主要原因[3]。更重要的是,化疗耐药细胞具有更强侵袭、转移能力,使ESCC进展加速[4]。因此,防止或逆转ESCC多药耐药性对于提高化疗疗效十分重要。
肿瘤的化疗方案包括多种化疗药物,ESCC患者对一种化疗方案产生耐药后,可再次选择其它化疗方案继续进行化疗。尽管肿瘤细胞对一种化疗药物产生耐药性后,通常也获得了多药耐药性(multidrug resistance,MDR),但这与肿瘤细胞在多种化疗药物作用后产生的MDR并不完全一致。因此,应用多种化疗药物建立ESCC多药耐药细胞模型,对于深入探讨ESCC化疗耐药发生的分子机制,筛选鉴定ESCC耐药标志物分子、耐药分子靶点具有重要临床价值。
1 材料与方法
1.1 试剂紫杉醇(paclitaxel,PTX,Sigma,货号SML2017-5MG);顺铂(cisplatin,CDDP,Sigma,货号P4394-25MG);5-氟尿嘧啶(5-fluorouracil,5-FU,Sigma,货号F6627-1G);阿霉素(doxorubicin,DOX,Sigma ,货号D1515-10MG),长春新碱(vincristine,VCR,Sigma,货号V0400000-1EA)。
1.2 细胞培养和多药耐药细胞株含10%血清的RPMI 1640培养基培养人ESCC EC9706细胞,对数生长期细胞用含2.5 mg·L-1PTX培养基培养3 d后,更换为不含PTX培养基继续培养,待细胞活力恢复后,再加入含相同浓度PTX培养基培养至细胞能够在含2.5 mg·L-1PTX培养基中稳定生长。用同样方法将PTX浓度依次提高至5、7.5、10 mg·L-1,建立耐10 mg·L-1PTX耐药细胞株EC9706/PTX。根据EC9706/PTX对5-FU、CDDP、DOX和VCR的化疗药物敏感性,依次用5-FU和CDDP处理EC9706/PTX细胞,最终建立MDR细胞株EC9706/PDFC。本实验所用5-FU和CDDP的药物浓度梯度分别为5、10、15、20、25 mg·L-1和1、2、3及4 mg·L-1。EC9706/CDDP和EC9706/PTX分别是对单个化疗药物CDDP和PTX耐药的细胞株,用含10%血清的RPMI 1640培养基培养。
1.3 MTT法测定细胞活性对数生长期EC9706/PDFC细胞消化后,以1×107·L-1细胞数接种于96孔板中,24 h后更换为含不同浓度PTX、CDDP、5-FU、DOX、VCR的培养基,每个浓度有3个复孔,并设空白对照。72 h后加入5 g·L-1MTT (20 μL/孔),4 h后加入二甲基亚砜,混合均匀后用多功能酶标仪在550 nm处检测各孔吸收度值。确定50%细胞存活的药物浓度(IC50)以及耐药指数(RI)。
1.4 细胞形态学变化及侵袭实验对数生长期EC9706和EC9706/PDFC细胞,倒置显微镜下观察细胞形态并进行拍照。Matrigel包被Transwell小室水化2 h,分别将无血清RPMI 1640培养基重悬的1×105个EC9706和EC9706/PDFC接种于Transwell小室上层,小室下层加入含20%血清的1640培养基,培养箱中继续培养30 h终止。PBS清洗Transwell小室,甲醛固定,结晶紫染色,镜下计数细胞并拍照。
1.5 细胞生长曲线及成球实验采用MTT法测定EC9706和EC9706/PDFC d 2至d 8等时间点细胞活性,绘制细胞生长曲线。对数生长期EC9706和EC9706/PDFC细胞,胰酶消化后,分别将5 000细胞接种于超低吸附6孔板内,应用干细胞培养基培养两周后,计数成球细胞数。
1.6 细胞周期测定对数生长期EC9706和EC9706/PDFC细胞胰酶消化后各取2×106个细胞,4 ℃预冷PBS洗涤2次,加入1 mL预冷70%浓度乙醇,4 ℃固定2 h,PBS清洗1次,离心后于细胞团块中加入100 μL的RNase A,重悬细胞后37 ℃孵育30 min,400 μL PI于4 ℃避光孵育30 min,流式细胞仪检测。
1.7 Q-PCR检测干性和EMT相关分子表达收集对数生长期EC9706和EC9706/PDFC细胞,TRIzol法提取RNA,OD 260/280比值确定RNA纯度,计算RNA浓度后,取2 μg RNA,将RNA反转录成cDNA(invitrogen, C28025-32)。Q-PCR检测OCT3/4、ALDH1A1、BM1和β-catenin等肿瘤干细胞(cancer stem cells,CSCs)及E-cadherin、N-cadherin、Vimmentin、Fibronectin等上皮-间质转化(epithelial mesenchymal transition, EMT)分子mRNA表达。本实验所用PCR引物序列见Tab 1。
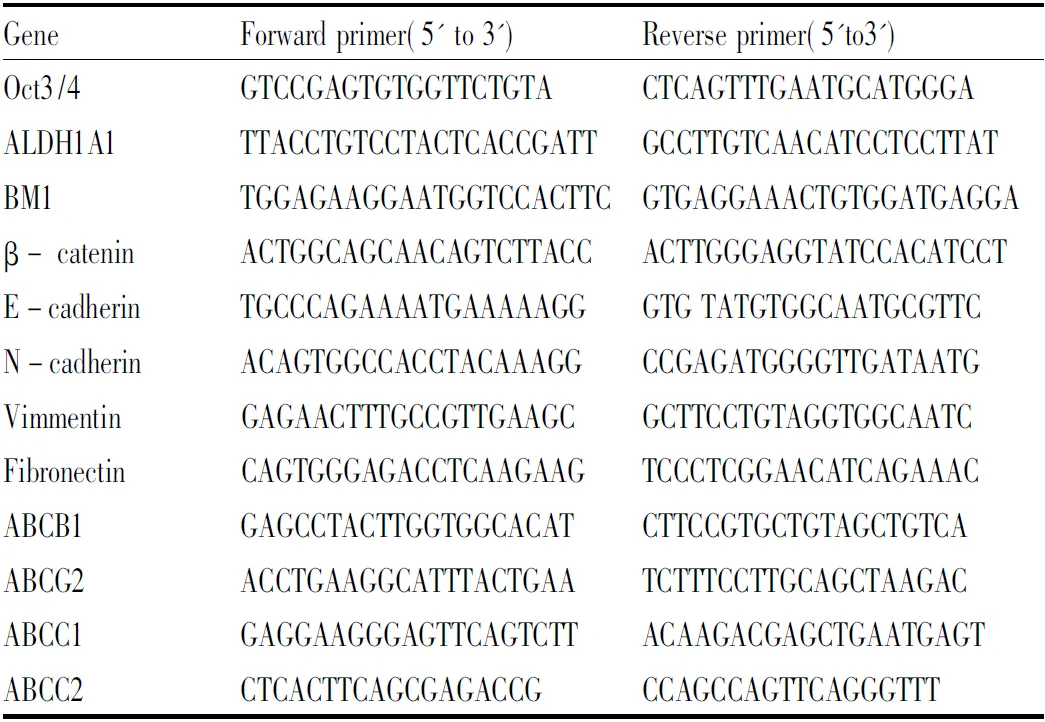
Tab1 Primers used for quantitative real time PCR
1.8 Western blot检测干性及EMT相关分子表达50 μg EC9706/PDFC和EC9706细胞蛋白进行12% SDS-PAGE电泳分离,电转至PVDF膜,5%脱脂奶粉封闭1 h,相应一抗4 ℃孵育过夜,二抗(1 ∶10 000)室温孵育1 h,ECL显色检测目的条带。本实验所用一抗包括:OCT3/4(CST,2890)、ALDH1A1(CST, 36671)、BM1(abcam,ab40800)、β-catenin(CST,8480)、E-cadherin(CST,3199S)和Fibronectin(CST,26836)。
1.9 多药耐药性表型稳定性复苏已冻存3年的EC9706/CDDP、EC9706/PXT和EC9706/PDFC等细胞,待细胞生长稳定后,分别加入3 mg·L-1CDDP、10 mg·L-1PTX、CDDP和PTX联合培养,收集药物持续作用两周停药48 h及持续作用两周细胞样本。提取RNA并反转录,检测ABC家族ABCB1、ABCG2、ABCC1、ABCC2等4个分子在EC9706和各耐药细胞中的表达特征。
2 结果
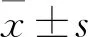
2.1 EC9706/PDFC耐药指数PTX、5-FU、CDDP、DOX、VCR等不同浓度化疗药物处理EC9706/PDFC和EC9706细胞72 h后,MTT法检测各组细胞活性,获得EC9706/PDFC和EC9706细胞对各种药物的IC50值,计算EC9706/PDFC对各种化疗药物的RI(Tab 2)。结果显示,EC9706/PDFC对PTX、DOX、CDDP产生高度耐药性,对5-FU和VCR产生中度耐药性。
2.2 细胞形态及侵袭倒置显微镜可见EC9706细胞大小基本一致,成铺路石样,部分为圆形,而EC9706/PDFC细胞大小不一,呈梭形或多角形,多有突起(Fig 1A)。Transwell小室检测细胞侵袭能力,与亲本细胞EC9706相比,EC9706/PDFC穿过Transwell小室基底膜Matrigel的细胞数明显增多(Fig 1B,P<0.01)。
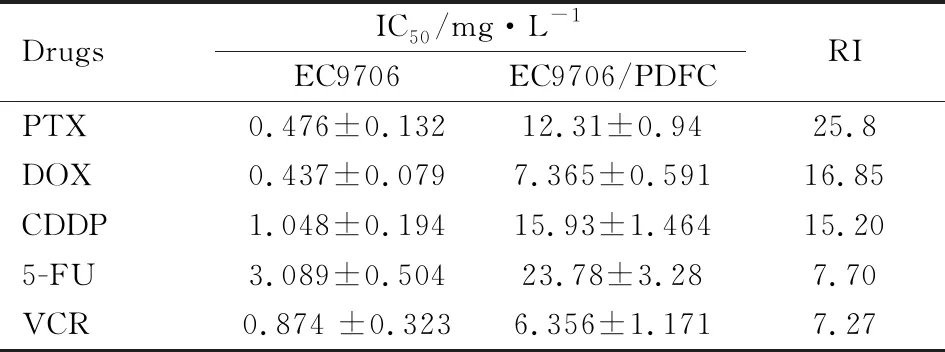
Tab 2 The resistance index of EC9706 and EC9706/PDFC to different chemotherapy drugs
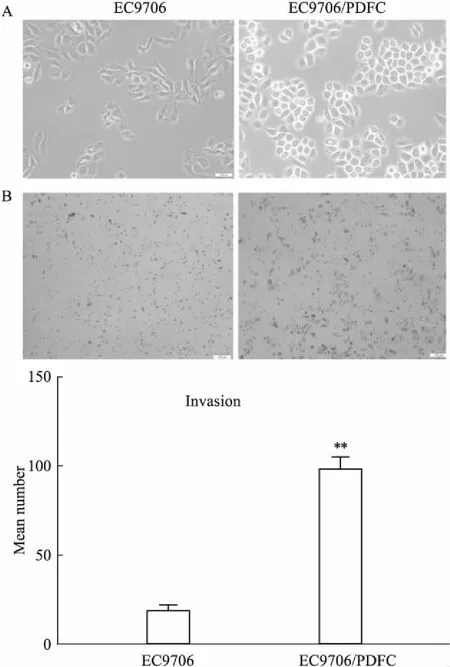
Fig 1 Microscopic morphology of EC9706 and EC9706/PDFC cells (A) and invasive potential of EC9706 and EC9706/PDFC cells
2.3 细胞增殖及干性成球能力MTT法检测EC9706和EC9706/PDFC的细胞活性,绘制细胞生长曲线,发现EC9706/PDFC增殖能力显著低于EC9706(Fig 2A,P<0.05)。EC9706和EC9706/PDFC细胞于超低吸附状态下培养两周,发现EC9706/PDFC形成的干性细胞球数目明显多于EC9706细胞。
2.4 EC9706和EC9706/PDFC细胞周期分析EC9706/PDFC的S期细胞明显低于EC9706,两个细胞株中S期细胞分别为17.56%和23.29%(P<0.05),G0-G1期细胞分别为66.6%和62.64%,G2-M期细胞分别为15.84%和14.07%。见Fig 3。
2.5 干性和EMT相关分子表达与EC9706细胞相比,MDR细胞EC9706/PDFC中OCT3/4、ALDH1A1、BM1和β-catenin等分子mRNA表达水平明显升高,而上皮相关分子E-cadherin表达降低,间质相关分子N-cadherin和Fibronectin表达升高,Vimmentin表达无显著变化,见Fig 4。与q-PCR检测结果一致,Western blot结果表明,EC9706/PDFC中OCT3/4、ALDH1A1、BM1、β-catenin等干性分子蛋白表达明显高于EC9706细胞,E-cadherin表达下调而Fibronectin表达上调,见Fig 5。
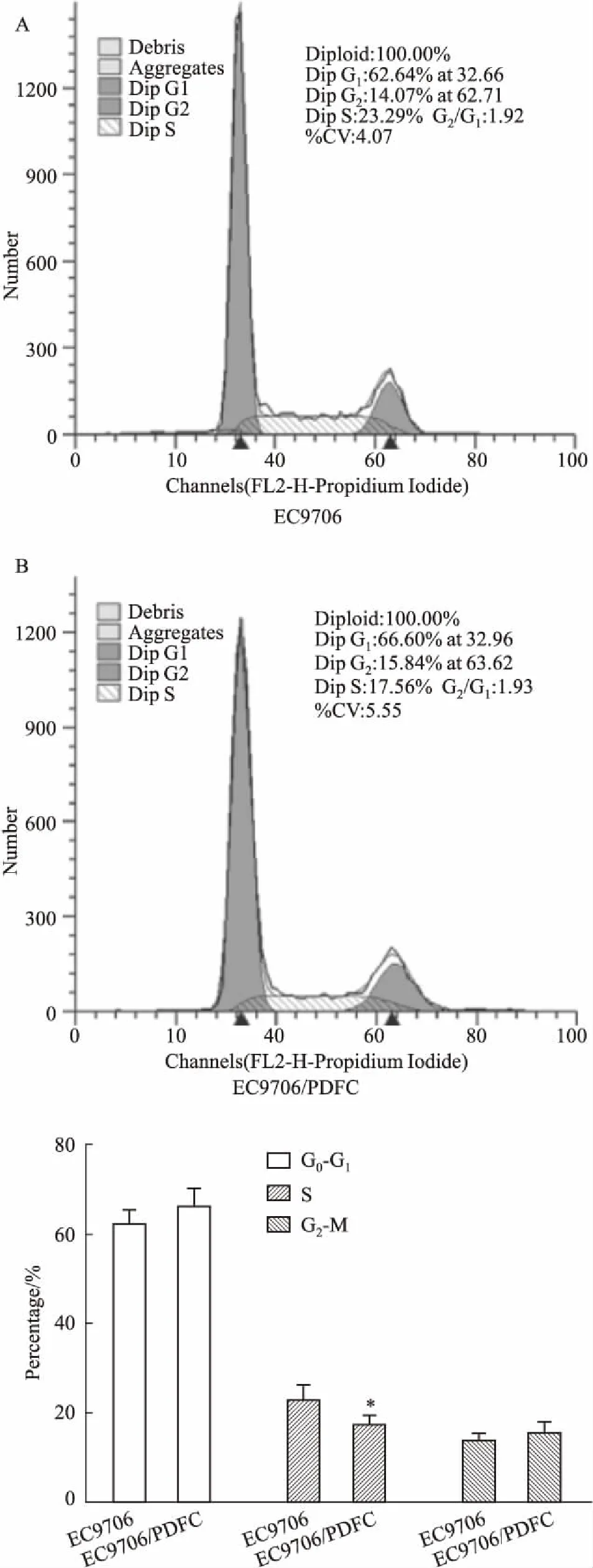
Fig 3 The cell cycle distributions of EC9706 (A) and
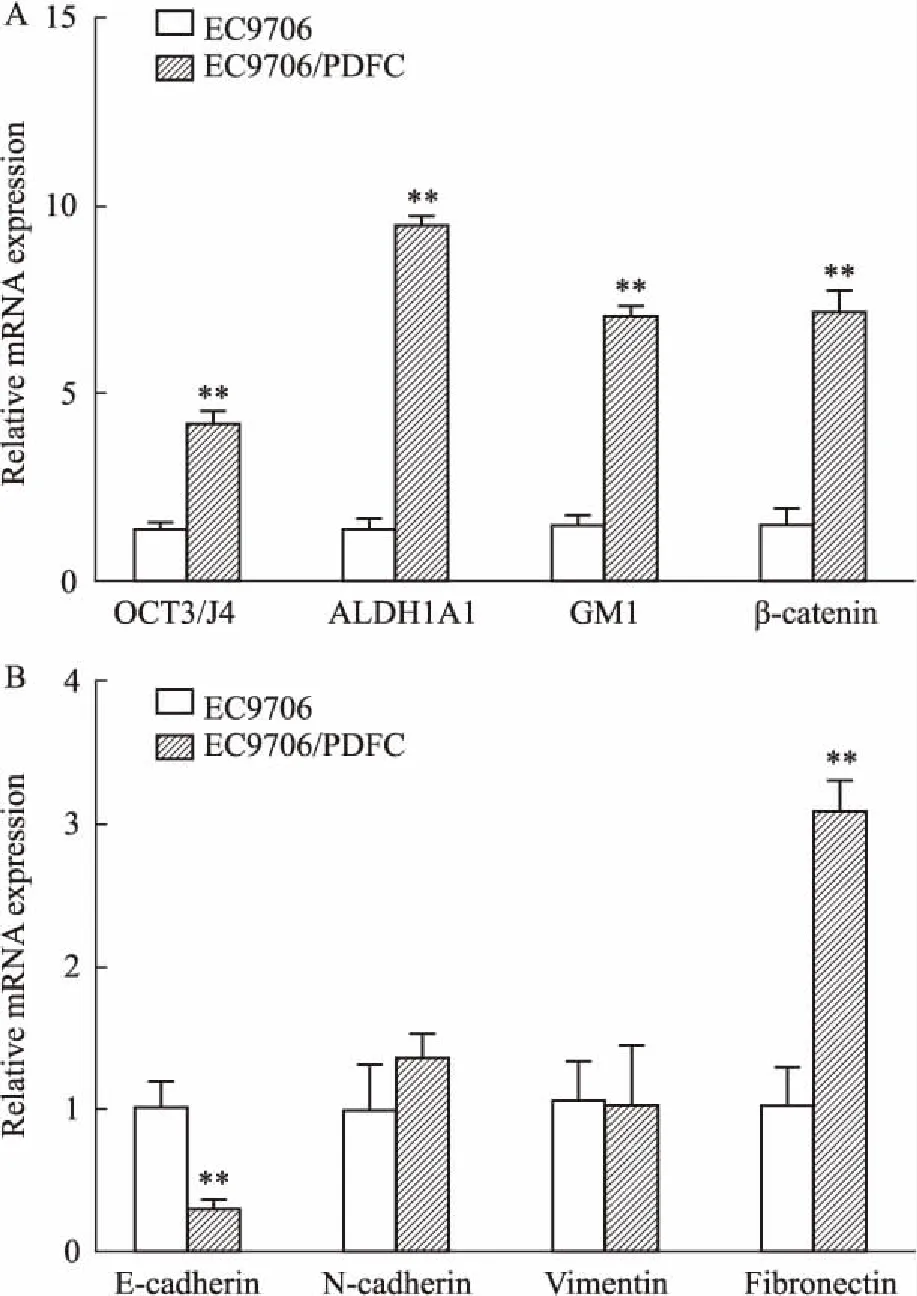
Fig 4 mRNA expression levels of molecules related to stem cell (A) and epithelial-mesenchymal transition (B) in EC9706 and EC9706/PDFC quantified by
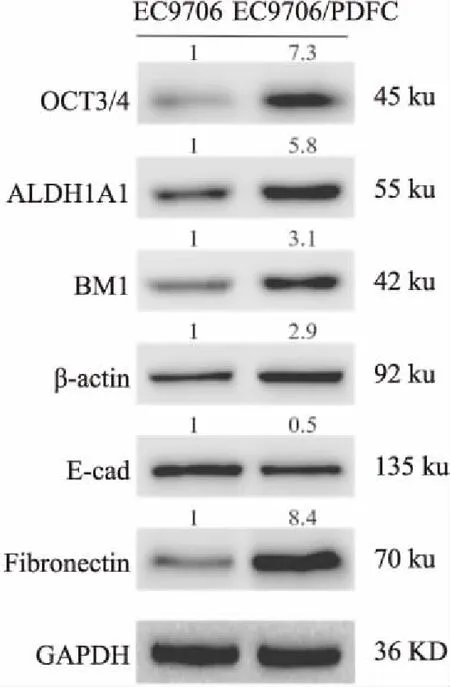
Fig 5 Differential protein expression levels
2.6 多药耐药性表型稳定性ABC转运蛋白家族介导的药物外排是MDR产生的关键机制,因此,本实验检测了ABC家族ABCB1、ABCG2、ABCC1、ABCC2等4个分子在已冻存3年的EC9706/PDFC、EC9706/PTX、EC9706/CDDP中的表达。与母本EC9706细胞相比,ABCB1在3个耐药细胞中表达均增高,药物持续两周后停药48 h或持续2周作用使EC9706/PDFC和EC9706/PTX细胞中ABCB1表达进一步升高,但使EC9706/CDDP细胞中ABCB1表达降低至EC9706细胞中的表达水平。3个耐药细胞中ABCC1与ABCB1表达模式类似,但表达增高幅度低于ABCB1。与ABCB1和ABCC1表达模式完全不同,ABCG2在EC9706/PDFC、EC9706/PTX、EC9706/CDDP细胞中表达均低于EC9706细胞,2种不同的药物处理方式均使ABCG2表达升高。EC9706/CDDP细胞中ABCC2表达增高显著(比EC9706增高4.2倍),2种不同给药方式使其表达明显降低,但EC9706/PDFC和EC9706/PTX中增高不明显,持续的药物处理方式使ABCC1稍微增加。见Fig 6。
3 讨论
虽然根治性手术治疗是早期ESCC的首选治疗手段,但治疗效果仍然不理想,5年总体生存率仅为40%[5]。与单纯手术治疗相比,新辅助放化疗联合手术治疗能够明显提高局部晚期ECSS患者的完全切除率和总体生存期。失去手术治疗机会的中晚期ESCC患者,同步放化疗能够有效缓解局部症状,防止远处转移和肿瘤复发,放化疗效果良好的患者可达到与手术治疗相似的生存率。然而,对放化疗产生抗性是临床ESCC治疗失败的主要原因之一[6]。
化疗是ESCC综合治疗的重要手段之一,目前常用的化疗药物包括CDDP、5-FU、PTX、DOX、VCR等,同时或序贯性联合应用多种化疗药物是目前肿瘤治疗常用策略之一。CDDP是ESCC联合化疗方案的首选基础药物,铂类和氟尿嘧啶类药物联合是ESCC的标准治疗方案之一。这些细胞毒性药物具有不同抗肿瘤机制,例如,CDDP与DNA分子内和分子间交联形成加合物,抑制DNA复制,引起细胞凋亡[7];5-FU通过抑制胸腺嘧啶核苷酸合成酶而抑制DNA的合成;PTX靶向微管,促进微管蛋白聚合抑制解聚,保持微管蛋白稳定,使有丝分裂异常或停止而导致细胞死亡。显然,ESCC临床治疗过程中ESCC细胞产生耐药性,是在多种化疗药物的作用下形成的。
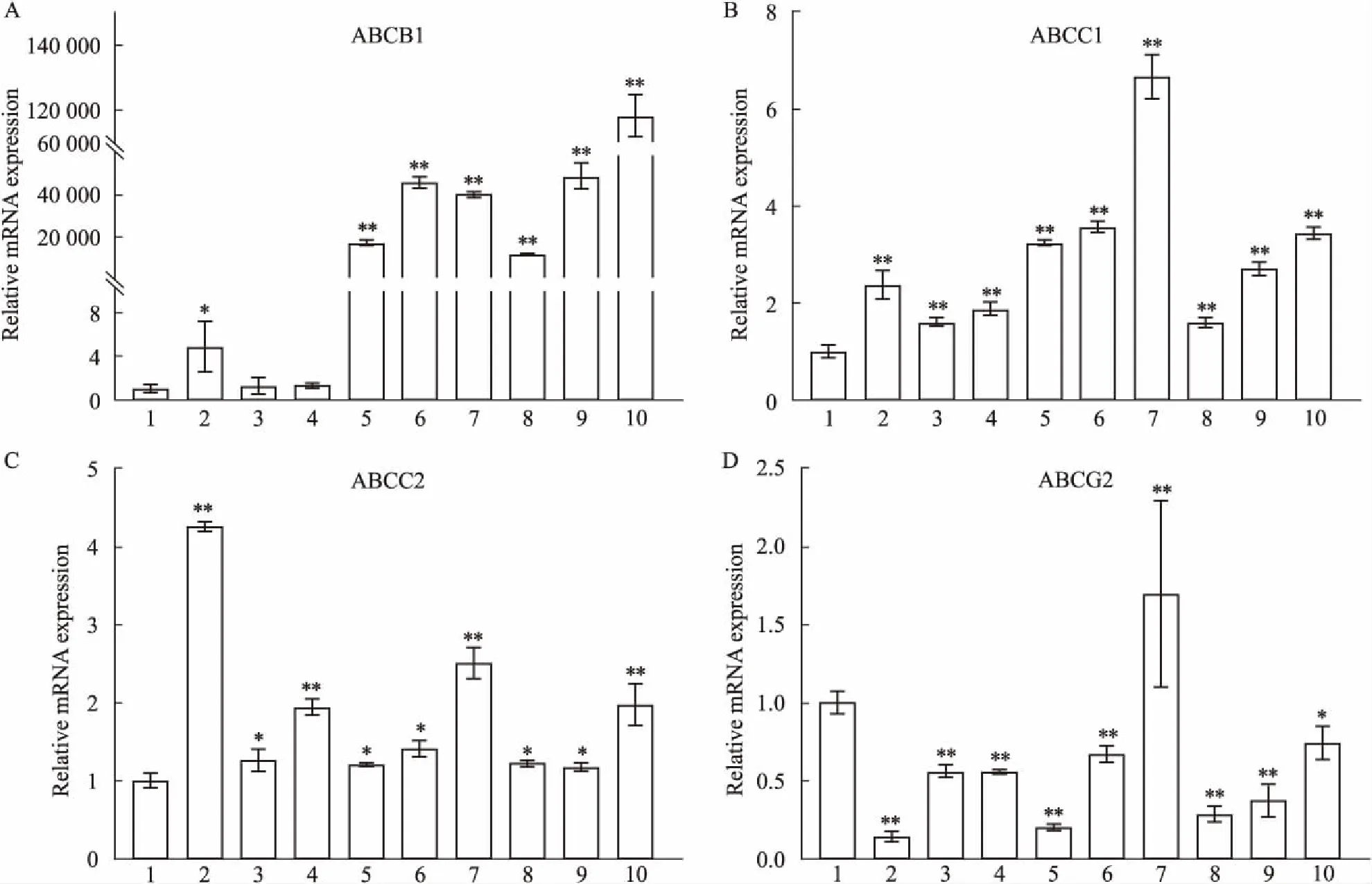
Fig 6 Q-PCR used to quantify mRNA expression levels of molecules for ABCB1 (A), ABCC1 (B), ABCC2 (C) and ABCG2 (D) in EC9706, EC9706/CDDP, EC9706/PTX and EC9706/PDFC, which were exposed to 3 mg·L-1 of CDDP, 10 mg·L-1 of PTX, and combination of CDDP and PTX, respectively.
然而,目前ESCC耐药细胞系多由单一化疗药物诱导而建立[8]。虽然这些耐药细胞系也具有部分MDR特征,但并不能完全模拟ESCC患者临床治疗过程中癌细胞耐药性的获得过程。本研究首先应用间歇性反复冲击法建立了对PTX耐药亚细胞株EC9706/PTX(RI=25.8),继而应用敏感化疗药物5-FU建立对PTX和5-FU耐药的亚细胞株EC9706/PTX/5-FU。采用同样的方法,建立了对CDDP耐药的EC9706/PTX/5-FU亚细胞系。尽管本研究仅应用了3种化疗药物反复作用于EC9706细胞,但由于交叉耐药性的存在,最终获得的EC9706/PDFC细胞对目前临床常用的5种化疗药物均产生了不同程度的抵抗能力。与亲本细胞EC9706相比,EC9706/PDFC表现了完全不同的生物学性状,如增殖减慢、细胞形态间质化、侵袭能力和干性成球能力增加。此外,EC9706/PDFC细胞的干细胞(OCT3/4、ALDH1A1、BM1和β-catenin)和EMT(N-cadherin、Fibronectin)标志物分子的表达明显上调,表明EC9706/PDFC细胞发生了干性富集和部分EMT转化。
肿瘤干细胞(cancer stem cells,CSCs)是一类具有自我更新、无限增殖和多向分化潜能的细胞亚群。目前各种治疗手段主要靶向快速增殖的癌细胞,而非CSCs,即使治疗能使肿瘤完全消退,残余的CSCs仍然能够导致肿瘤复发和转移,是肿瘤化疗失败的主要原因。靶向抑制CSCs特异性标志物分子,可逆转耐药表型。通过抑制IGF2介导的CD133分子表达,IGF2中和抗体能够增加ESCC来源的裸鼠皮下荷瘤对5-FU的敏感性[9]。塞来昔布通过靶向COX2而抑制食管癌细胞CSC标志物表达,导致癌细胞对5-FU重新致敏[10]。由此可见,本研究结果提示,OCT3/4、ALDH1A1、BM1和/或β-catenin等干性分子可能介导了EC9706/PDFC的MDR的产生,这些分子可能是逆转EC9706/PDFC多重耐药的重要靶点分子。
EMT是指上皮细胞在特定的生理或病理情况下向间质细胞转化的生物学过程。EMT的发生涉及多种细胞外基质、细胞因子和转录因子,是由多个信号通路参与调控的复杂、动态过程[11]。EMT不仅使表皮样的肿瘤细胞可以转化为间质样细胞以利于转移和侵袭,并且还能获得干细胞样的特性。正常乳腺上皮细胞通过EMT关键分子过表达可转化为干细胞;体外诱导乳腺上皮永生化细胞发生EMT后,这些上皮细胞呈现间质表型并获得了自我更新和肿瘤形成能力,并且表达乳腺癌干细胞分子标志CD44high/CD24low[12]。肿瘤细胞在获得MDR能力的过程中表现出EMT,并且诱导EMT发生能够增加肿瘤对放化疗的耐受能力;而本身具有间质分化状态的肿瘤细胞也常表现为原发性耐药的特点[13]。EMT转录因子Twist可结合于肿瘤抑制基因Par-4的启动子而使Par-4沉默,从而促进肿瘤的复发,产生化学耐药性[14]。此外,化疗后产生耐药性的乳腺癌细胞获得EMT特性,循环或分散的癌细胞中EMT标志物的表达与预后不良密切相关[15]。这些研究表明,EMT及干性可以导致MDR,因此,EMT相关的信号分子及通路是逆转MDR的潜在分子靶点。
ABC转运蛋白家族包括49个成员分子,位于胞膜,参与多种分子的跨膜运输,并与化疗药物胞外排出有关[16]。本实验通过分析与MDR表型密切相关的ABCB1(又称作多药耐药基因或P-糖蛋白)、ABCG2(乳腺耐药蛋白)、ABCC1、ABCC2等4个分子在EC9706/PDFC、EC9706/CDDP和EC9706/PTX中的表达[17],发现本实验建立的多药耐药EC9706/PDFC细胞,与由单药诱导耐药细胞(EC9706/CDDP、EC9706/PTX)相比,具有不完全相同的表达模式。3种不同耐药细胞中,ABCB1和ABCC1的表达模式类似,但ABCB1的表达增加程度显著高于ABCC1,尤其是EC9706/PDFC和EC9706/PTX细胞;EC9706/PDFC和EC9706/PTX细胞中ABCC2表达与EC9706中该分子表达差异不明显,而ABCG2在3种不同的耐药细胞中表达却降低。上述结果表明EC9706/PDFC耐药性的获得方式与耐药机制相关,需进一步研究阐明。
本研究建立的人ESCC多药耐药细胞EC9706/PDFC更接近ESCC患者的临床化疗过程,是深入研究ESCC耐药分子机制的理想细胞模型。EC9706/PDFC发生了EMT和CSC富集,进一步分析鉴定EMT和CSC关键分子,将为逆转ESCC化疗耐药提供重要的分子靶点。

