小麦粒形QTL定位及其与水分环境互作遗传分析
何 瑞,马靖福,刘 媛,张沛沛,栗孟飞, 王彩香,宿俊吉,程宏波,杨德龙
(1.甘肃省干旱生境作物学重点实验室,甘肃兰州 730070; 2.甘肃农业大学生命科学技术学院,甘肃兰州 730070)
小麦(Triticumaestivum)是世界上最重要的谷类作物之一,全球的年产量在7亿吨左右,占世界粮食生产总量的三分之一[1]。我国小麦主要种植在降雨量偏少的北方雨养农业区,该区域小麦生育期内经常遭受不同程度的干旱胁迫,严重限制小麦生长发育,最终导致产量下降[2-3]。因此,改善小麦自身的抗旱性与节水潜能,降低干旱对小麦产量的潜在影响,进而实现干旱地区小麦增产稳产是当今小麦研究的热点方向。
粒形是小麦品质评定的主要指标,籽粒的长、宽、厚和周长等与粒重具有高度的相关性,并对小麦产量具有潜在影响[4-8]。小麦的粒形是由多基因控制的数量性状,遗传模式复杂,容易受到环境因素的影响[9]。许多学者利用不同遗传背景的重组自交系群体(recombinant inbred lines,RIL)[10-14]和加倍单倍体群体(double haploid lines,DH)[15-17]在多种环境条件下对小麦的粒形进行QTL定位,发现控制粒形的QTL覆盖小麦的所有染色体,且在不同作图群体和环境中QTL的数目和表达特点各不相同,其表达模式复杂。Kumari等[12]以NW1014×HUW468为亲本构建的RIL群体进行QTL定位分析,发现控制粒长、粒宽、长宽比和周长的QTL分布在1A、2B、4A、5A、6A、7A和7D染色体上,单个QTL可解释7.98%~55.86%的表型变异。周小鸿等[13]以Q1038×ZM9023为亲本构建的RIL群体在三个不同的环境中检测到24个与粒长、粒宽、粒厚和长宽比有关的QTL和7个QTL富集区,单个QTL可解释5.37%~12.75%的表型变异。Chen等[16]以Hanxuan 10×Lumai 14为亲本构建的DH群体为研究材料,在六个不同的环境检测到28个与粒长、粒宽和长宽比相关的QTL,分别位于1B、2B、2D、4A、5A、5B、5D、6A、6B、7A和7B染色体上,单个QTL可解释6.57%~ 20.99%的表型变异。Williams等[17]在两个DH群体(W7984/Opata M85和Cayuge/Caledonia)中将36个与粒长、粒宽和粒厚有关的QTL定位在14条染色体上。然而,前人的研究主要集中在发掘控制小麦粒形QTL,及其加性效应分析方面,但对这些性状的上位性效应及QTL与环境互作的遗传剖析研究甚少,很难深入解析这些性状的遗传基础。本研究以抗旱性强的冬小麦品种陇鉴19和水地高产品种Q9086为亲本创建的RIL群体为供试材料,在两个水分环境条件下,对粒形相关性状进行QTL定位和遗传解析,以期为小麦粒形相关性状QTL的进一步精细定位和基因图位克隆提供参考。
1 材料与方法
1.1 试验材料
以抗旱性强的冬小麦品种陇鉴19和水地高产品种Q9086为亲本创建的RIL群体120个株系为供试材料,两亲本在抗旱性和产量等相关农艺性状上有显著差异[18]。
1.2 田间试验与性状测定
试验材料于2016年10月至2017年7月和2017年10月至2018年7月在甘肃省榆中县小麦试验点 (35°51'N,104°07'E)种植,两个年份环境依次记为E1和E2。该区域属于西北内陆典型干旱区,年降雨量在400 mm以下,年蒸发量为 1 500 mm。小麦播前施基肥(K2O 60 kg·hm-2,N 180 kg·hm-2,P2O5150 kg·hm-2),此后整个小麦生育期内均不再施肥。田间试验随机区组设计,每处理3次重复,均为稀条播,6行区,每行点播60粒,行长1.0 m,行距0.2 m。水分处理分为干旱胁迫(drought stress, DS)和正常灌溉(well-watered, WW)。播前统一灌水(900 m3·hm-2),灌溉处理在在小麦生长发育的拔节期、抽穗期和开花期分别补充灌1次,每次灌水量为750 m3·hm-2;干旱胁迫处理仅在拔节期灌水750 m3·hm-2,其后完全依靠自然降水,两个年份小麦生育期内降水量分别为142 mm和137 mm。
小麦成熟后,使用万深SC-G自动考种分析仪测定籽粒的长、宽、长宽比、周长及千粒重;使用数显游标卡尺(精度为0.02 mm)测定其粒厚。
1.3 数据统计与QTL定位分析
采用SPSS V19.0统计软件对粒形性状的表型进行描述分析、方差分析和相关分析。采用Toker[19]的方法计算广义遗传力。
利用前期构建的小麦RILs群体遗传连锁图谱进行粒形的QTL定位分析,该连锁图谱共定位了524个SSR标记,形成的21个连锁群组覆盖小麦的所有染色体,全长2 266.7 cM,两标记间的平均遗传距离为4.3 cM[20-21]。利用QTL IciMapping V4.0软件,采用复合区间作图法CIM(composite interval mapping)检测干旱胁迫和正常灌水条件下RIL群体粒形的加性QTL(A-QTL)和上位性QTL(AA-QTL)及其与环境的互作效应,扫描步长为2.0 cM。以LOD≥2.5为阈值判断QTL是否存在,利用各QTL的加性效应、上位性效应及其与环境的互作效应解析其对控制小麦粒形相关性状的遗传基础。
2 结果与分析
2.1 表型分析
在不同的水分环境中,RIL群体及其双亲的粒长、粒宽、粒厚、长宽比和周长表型差异显著(表1)。干旱胁迫条件下的各粒形性状表型值均显著低于灌溉处理,亲本Q9086的粒形性状表型值均显著高于陇鉴19,但RIL群体干旱胁迫条件下的变异系数高于灌溉处理,分别为3.71%~6.34%(DS)和2.88%~5.42%(WW),说明干旱胁迫处理导致粒形性状的表型变异增大。RIL群体粒形性状的表型均值介于两个亲本之间,且存在超亲分离现象,偏度和峰度普遍小于1,表现出典型的数量遗传特点。
2.2 粒形QTL加性效应及其与水分环境的互作
在不同水分环境条件下,共定位到26个控制粒形相关性状的A-QTL,主要分布在1B、1D、3B、4B、5A、5B、5D、6A和7B染色体上(表4,图1)。控制粒长和周长的A-QTL各有5个,控制粒宽和长宽比的A-QTL各有6个,控制粒厚的A-QTL有4个,单个A-QTL对表型变异的贡献率为3.60%~13.90%。其中Qkl.acs-1B.1、Qkw.acs-6A.1和Qkp.acs-1B.1对表型变异的贡献率较大,分别为13.90%、11.07%和13.38%。有12个A-QTL对表型变异有正向效应(0.02**~ 0.19**),其增效等位基因来自于亲本Q9086,其余14个A-QTL对表型变异有负向效应 (-0.13**~-0.02**),其增效等位基因来自于亲本陇鉴19。这表明控制粒形相关性状的增效等位基因在两个亲本之间均有分布。但控制粒长和周长的增效等位基因70%来自Q9086,控制粒厚和长宽比的增效等位基因80%来自陇鉴19,说明亲本Q9086在RIL群体中贡献了较多的调控粒长和周长的基因,而陇鉴19贡献了较多的调控粒厚和长宽比的基因。另外,检测到16个A-QTL与水分环境互作显著,但是并未发现能在不同水分环境条件下稳定表达的位点,其中有8个A-QTL与干旱环境的互作表现为正效应 (0.01**~0.05**),增加了粒形相关性状表型值,其余8个A-QTL与干旱胁迫环境的互作表现为负效应(-0.03**~ -0.01**),降低了粒形相关性状表型值,这些A-QTL与水分环境互作的贡献率均较低,为 0.11%~3.05%。
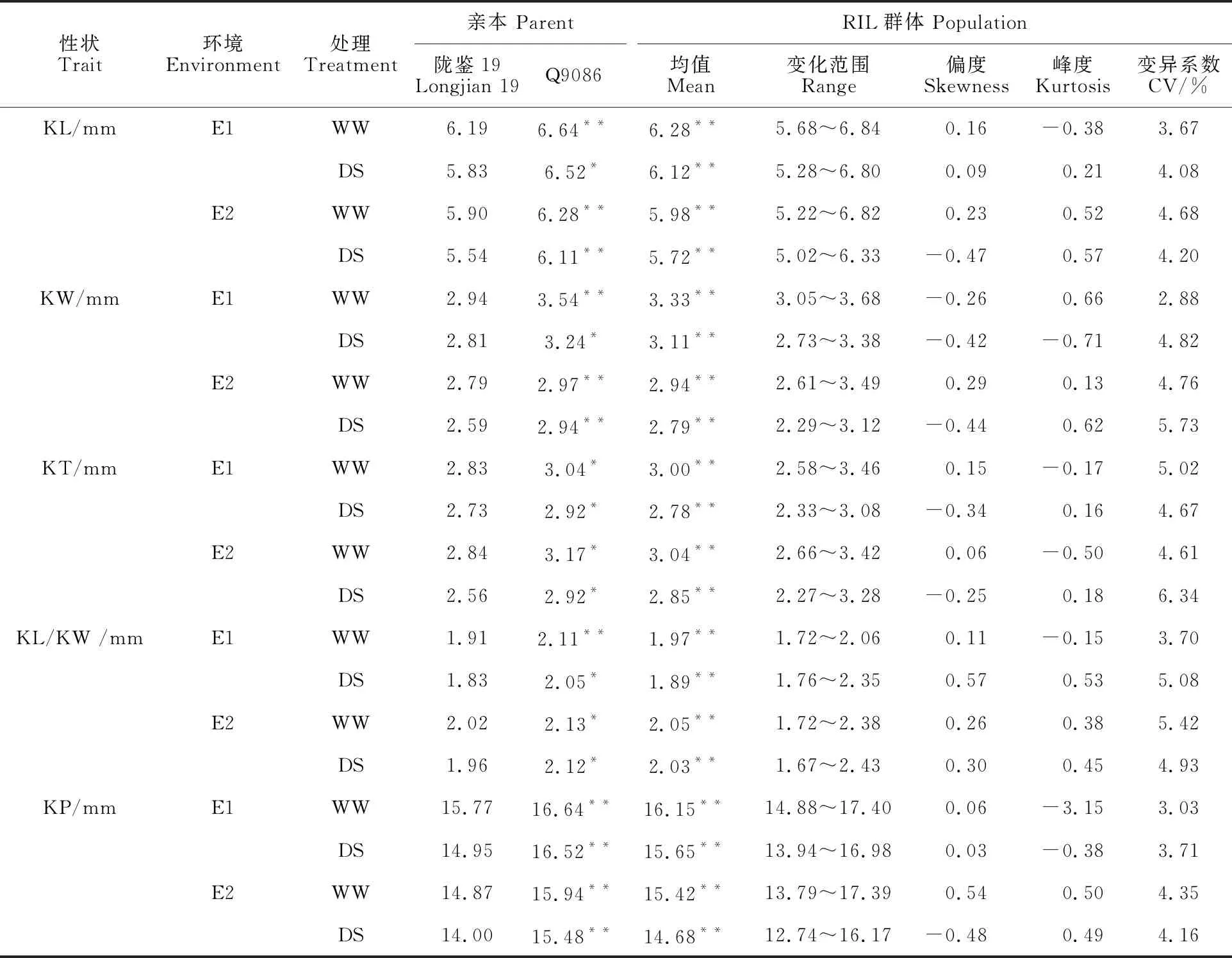
表1 不同水分环境中小麦RIL群体粒形性状的表型分布Table 1 Phenotypic values of kernel morphology in the wheat RILs population under different environments
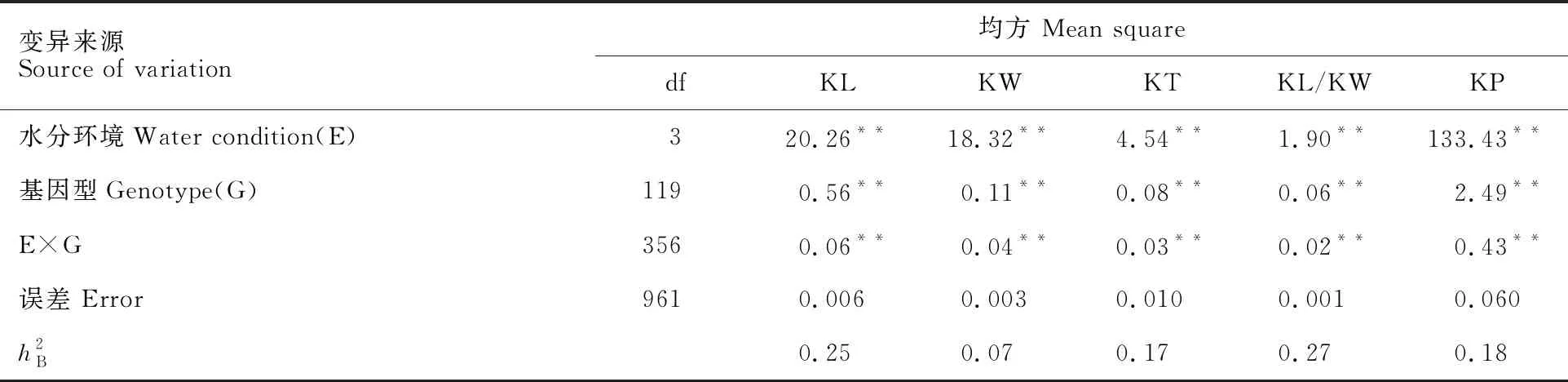
表2 小麦RIL群体粒形性状方差分析Table 2 Variance analysis of kernel morphology traits in the wheat RILs population
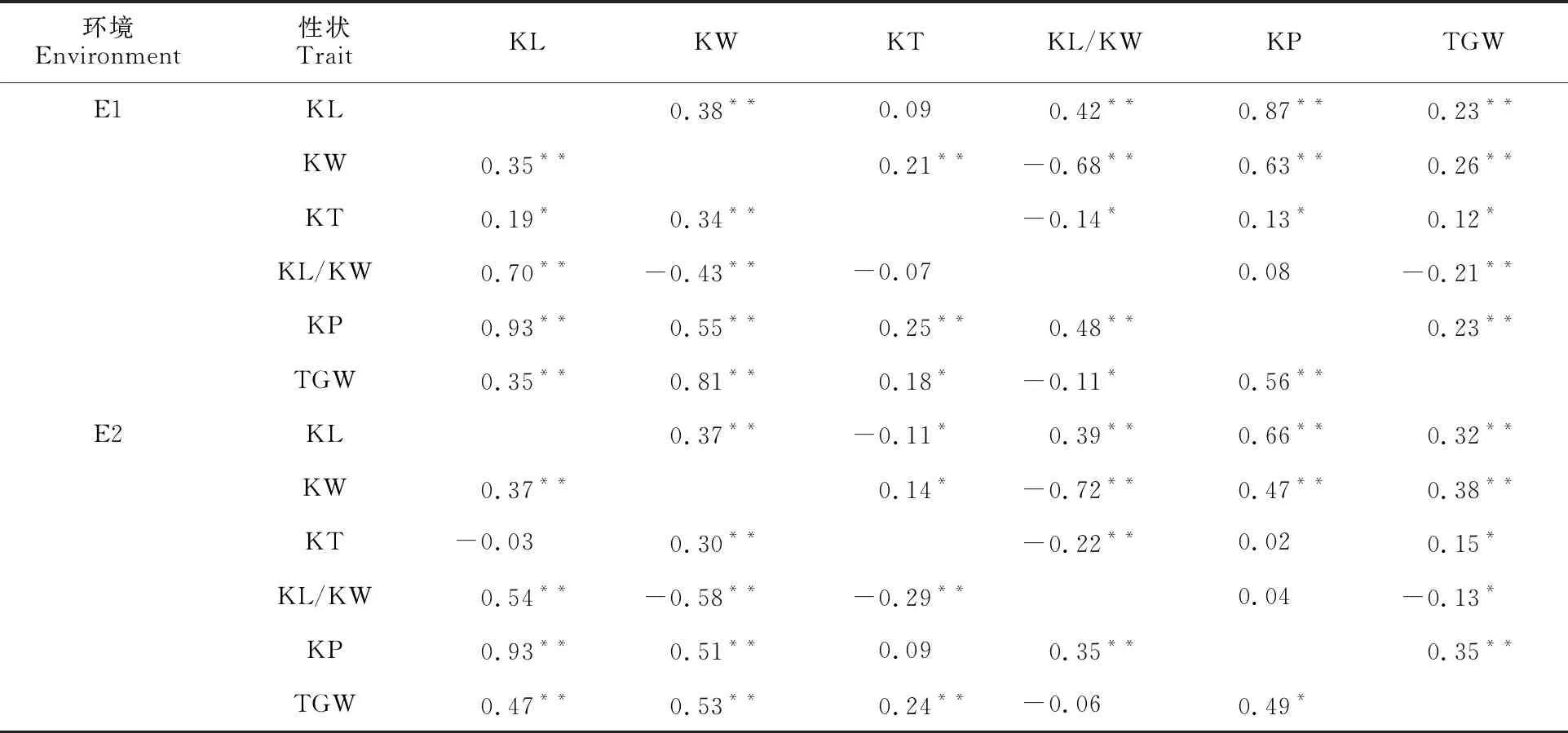
表3 不同处理下小麦RIL群体粒形性状的相关性Table 3 Correlation of kernel morphology traits in the wheat RILs population under different treatments
从图1可知,控制粒形的A-QTL不匀分布在不同染色体或同一染色体的不同区间,其位点数目为2~6个,形成了7个QTL热点区域,即Xgwm153~Xmag981(1B)区间检测到控制粒长和周长的A-QTL;Xwmc231~Xbarc173(3B)和Xbarc59~Xbarc232(5B)区间检测到控制长宽比和粒宽的A-QTL;Xgwm149~Xgwm495(4B)和Xgwm186~Xcfa2185(5A)区间检测到控制粒长和周长的A-QTL;Xgwm292~Xwmc161(5D)区间检测到控制粒厚和粒宽的A-QTL;Xksum255~Xbarc171(6A)区间检测到控制周长和粒宽的A-QTL。
2.3 粒形QTL上位性效应及其与水分环境的互作
在不同水分环境条件下,共定位到22对控制粒形相关性状的AA-QTL,主要分布在1A、1B、2A、2B、2D、3A、3B、3D、4A、4B、5B和6B染色体上(表5)。控制粒长和粒宽的AA-QTL各有4对,控制粒厚的AA-QTL有6对,控制长宽比的AA-QTL有3对,控制周长的AA-QTL有5对,对表型变异的贡献率为0.52%~2.76%,这些AA-QTL主要是通过微效A-QTL之间的互作形成。其中,8对AA-QTL的上位性效应表现为正效应(0.03**~0.20**),即亲本型上位性效应大于重组型上位性效应;其余14对AA-QTL的上位性效应表现为负效应(-0.25**~ -0.03**),即重组型上位性效应大于亲本型上位性效应。另外,检测到12对AA-QTL与水分环境发生显著的互作效应,其中6对AA-QTL与干旱胁迫环境的互作效应表现为正效应 (0.01**~0.06**),增加了粒形相关性状表型值,其余6对AA-QTL与干旱胁迫环境的互作效应表现为负效应(-0.05**~ -0.01**),降低了粒形相关性状表型值,但这些AA-QTL与水分环境互作的贡献率较低,为0.15%~0.82%。
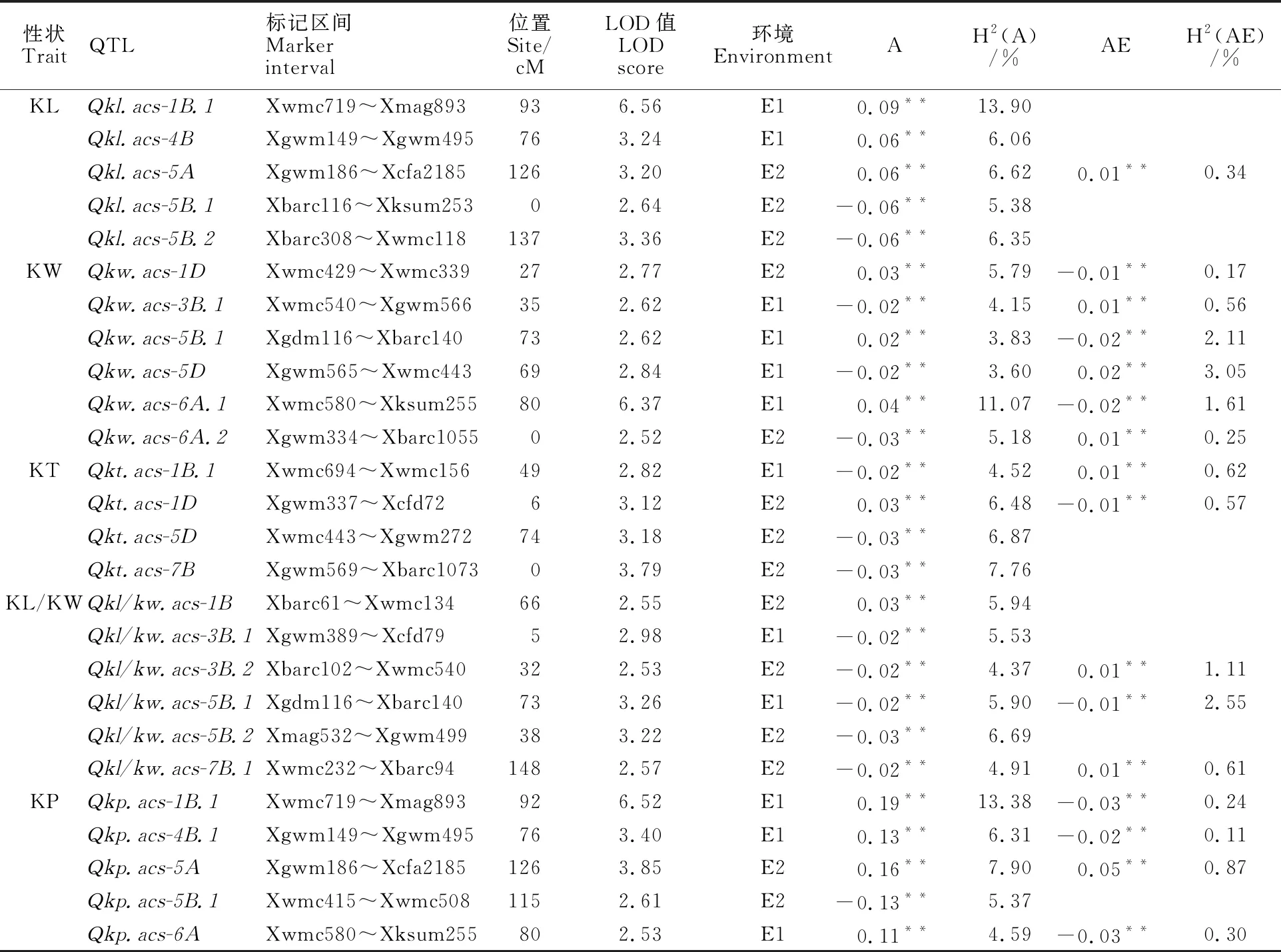
表4 不同环境条件下小麦RIL群体粒形性状QTL加性效应及其与水分环境互作Table 4 Addictive effects and interaction effects of QTL×water environment of the identified QTL on kernel morphology traits of the RILs population in wheat under different environments
3 讨 论
研究表明小麦粒形是由多基因控制的数量性状,遗传模式复杂[9,22-24]。在不同遗传背景的作图群体中检测到粒形QTL的数目和位置存在差异[10,14,16],在相同作图群体的不同环境中QTL的结果也会有所不同[10-16],说明粒形性状QTL的表达模式受环境和作图群体的影响。本研究利用抗旱性和粒形有显著差异的两个冬小麦品种陇鉴19和Q9086为亲本创建的RIL群体,在两个水分环境条件下对小麦粒形相关性状进行QTL定位,共检测到26个A-QTL,每个环境中A-QTL表达的数量和位置均不同,在两种环境中并未检测到稳定表达的A-QTL,这进一步说明了控制小麦粒形相关性状的A-QTL表达容易受到环境因素的影响。本研究在1B、1D、3B、4B、5A、5B、5D、6A和7B染色体上检测到了控制粒长、粒宽和粒厚的A-QTL,这与前人[11,14-15,17,22]的研究一致,说明上述染色体上可能存在调控籽粒生长发育的重要基因,这些稳定表达的A-QTL可用于进一步精细定位。此外,周小鸿等[13]和Li等[24]在1D、2D、3B和4B染色体上发现了控制长宽比的A-QTL,Kumari等[12]在5A、4A和7B染色体上发现了控制周长的A-QTL,这与本研究的结果不同,推测Qkl/kw.acs-1B、Qkl/kw.acs-3B.1、Qkl/kw.acs-3B.2、Qkl/kw.acs-5B.1、Qkl/kw.acs-5B.2、Qkl/kw.acs-7B.1、Qkp.acs-1B.1、Qkp.acs-4B.1、Qkp.acs-5A、Qkp.acs-5B.1和Qkp.acs-6A可能是本研究新发现的控制长宽比和周长QTL。本研究在1B染色体的Xgwm153~Xmag981区间内检测到了控制粒长和周长的A-QTL,前人在相近区间发现了控制粒长[11,24]的A-QTL,但并未检测到控制周长的A-QTL,推测可能是本研究发现的新位点。本研究在6A染色体的Xksum255~Xbarc171区间内发现了一个贡献率较大的位点Qkw.acs-6A.1,在与此相近的区间,Sun等[11]和Su等[25]也分别发现了控制粒宽和千粒重的A-QTL,因此,Qkw.acs-6A.1可能是分子标记辅助选择育种和产量相关性状改良的重要位点。前人研究表明,加性和上位性及其二者与环境的互作效应在数量性状的遗传中具有不可忽视的作用[26-30],在粒形性状遗传中A-QTL的作用并不是完全独立,还取决于它与其他位点或与环境因素的相互作用。本研究也证实了粒形性状的遗传模式受到加性和上位性及其二者与环境互作效应的影响。本研究共检测到22对控制粒形相关性状的AA-QTL,它们对表型变异的贡献率为0.52%~2.76%。参与上位性QTL的位点主要是微效QTL,与单个A-QTL的贡献率(3.60%~13.90%)相比,它们的贡献率较小,这与前人[26,29]研究结果一致,这说明粒形性状的遗传模式同时受到主效QTL的加性和微效QTL的上位性影响。本研究还发现各粒形性状的A-QTL和AA-QTL与环境存在互作效应,但它们与环境的互作效应对表型变异的贡献率较小,分别为0.11%~3.05%和0.15%~0.82%,这与前人[26,28]的研究结果相同,进一步说明在加性效应、上位性效应及其二者与环境互作效应中,加性和上位性效应在粒形性状的遗传中起主要作用,加性×环境互作及上位性×环境互作效应较小。

图1 小麦RIL群体籽粒性状QTL图谱Fig.1 QTL map of kernel traits of the RIL population in wheat

表5 不同环境条件下小麦RIL群体粒形性状QTL上位性效应及其与水分环境互作Table 5 Epistatic effects and interaction effects with QTL×water environment of the identified QTL on the kernel morphology traits of the RILs population in wheat under different environments
基因型×环境互作是决定基因型在不利环境中适应性的关键,导致的表型变异称为表型可塑性,数量性状的表型可塑性产生于QTL与环境之间的相互作用[20]。本研究发现,水分环境是影响小麦粒形表型变异的重要因素,A-QTL中粒宽受水分环境影响最大,长宽比、周长、粒厚和粒长次之;AA-QTL中粒厚受水分环境影响最大,周长、长宽比、粒宽和粒长次之,这与前人[28,30]的研究结果不同,说明粒形相关性状的QTL可以具有不同的表达模式,以响应不同的环境。Yang等[20]也认为这种现象可能是在不同环境中对QTL的检测不一致,或QTL的表达会因不同环境的影响发生变化,说明小麦粒形遗传模式复杂性。因此,只有利用不同的作图群体并在多种环境条件下对粒形的加性、上位性及其与环境的互作效应进行深入地探究,才能更好更有效地解析粒形的遗传机制。
粒形对小麦的产量具有潜在的影响。本研究发现,粒长、粒宽、粒厚和周长与粒重具有显著或极显著的正相关,其中粒宽与粒重的相关性最高,说明粒宽对提高粒重具有重要的作用。本研究中还发现了7个A-QTL热点区域(Xgwm153~Xmag981、Xwmc231~Xbarc173、Xgwm149~Xgwm495、Xgwm186~Xcfa2185、Xbarc59~Xbarc232、Xgwm292~Xwmc161、Xksum255~Xbarc171),在其分子标记区间内同时控制着两个粒形性状。这些连锁的分子标记可为小麦粒形相关性状QTL的进一步精细定位和基因图位克隆提供良好的理论基础。

