不同乙醇置换处理对小麦小孢子和花粉育性检测的影响
刘海英,甄俊琦,茹振钢,张亚娟,冯必得,景秀秀,王 莹
(1.河南师范大学生命科学学院,河南新乡 453007;2.河南科技学院小麦中心,河南新乡 453003)
小麦是中国重要的粮食作物之一,小麦生产对保障国家粮食安全具有重要意义[1]。杂种优势利用是提高小麦产量和品质的有效途径[2]。BS系列、CS系列、ES系列的育成,使我国在二系法杂交小麦研究和应用领域居于世界领先水平[3-6]。小麦温敏雄性不育系BNS366由河南科技学院育成,抽穗前日平均温度低于8.9 ℃时彻底不育[7],在小麦杂交制种中的应用逐渐扩大,以其近等基因系郑麦366为对照构建试验模型,揭示其花粉败育机理具有重要的理论意义。开展小孢子发育过程的细胞学观察和花粉育性检测,是进一步开展相关研究的基础。
前人对小麦小孢子发育和育性检测开展了广泛研究,常用I2-KI法观察小孢子内的淀粉积累情况[7-10],用DAPI染色法观察细胞核情况[10-12]。本课题组前期研究发现,FAA固定一段时间后,采用I2-KI法可以清晰显示小孢子内淀粉积累情况,采用DAPI法染色时小麦三核期小孢子细胞质呈白色浑浊状,细胞核模糊,且FAA对操作人员会造成化学烧伤,敏感人群易引起头面部皮肤过敏或溃烂等伤害,不利于大量开展细胞学研究(内部资料未发表)。已有研究发现,FAA固定液固定小麦穗24 h后,采用90%-80%-70%-70%梯度置换固定液(每次置换时间均为30 min),最后转入70%乙醇中保持备用,再经I2-KI法和DAPI法染色均可以取得良好的细胞学观察效果[13],但需要消耗大量乙醇,且操作时间长。前人有关小孢子细胞学观察的研究中,采用FAA固定后,进行乙醇置换的处理各有不同,其对细胞图像的清晰度影响是否存在差异尚未见报道。
为此,本试验以郑麦366和BNS366为试验材料,用 FAA固定液固定小麦穗后,进行3种乙醇置换处理,对比I2-KI法和DAPI法染色效果,并将其与花粉育性统计结果进行比较,以明确小麦小孢子发育细胞学观察和花粉育性检测的适宜乙醇置换处理。
1 材料与方法
1.1 试验地点
试验材料种植于河南师范大学小麦试验田,属黄淮麦区(东经113°54′,北纬35°19′,海拔 76.3 m),暖温带大陆性气候。
1.2 试验材料与设计
以温敏小麦雄性不育系BNS366及其近等基因系郑麦366为供试材料,均由河南科技学院小麦中心提供。所有材料于2018年10月10日正常秋播,按一般大田管理方式栽培,次年选代表型植株主茎穗进行研究。
试验以FAA(50%乙醇∶冰醋酸∶福尔马林= 18∶1∶1)为固定液。参照刘海英等[14]的农艺特征判断标准,配合醋酸洋红染色镜检结果,确定取样时期,于小孢子发育的单核期、二核期、三核期和开花期,上午9:00-10:00,各选取10穗代表型植株主茎穗,剪去顶部与基部各6个小穗,置于FAA固定液中,0.034×105Pa抽真空30 min后在4 ℃条件下固定24 h,然后采取不同乙醇置换处理进行后续处理,具体如下:
90%-80%-70%:移除FAA,按顺序经过90%和80%乙醇梯度置换各30 min,最后转入70%乙醇中,在4 ℃冰箱中保存备用;
70%-70%:移除FAA,用70%乙醇置换30 min后,转入70%乙醇中在4 ℃冰箱中保存备用;
不置换:继续保存于FAA固定液中,不进行乙醇置换。
1.3 细胞学观察
分别取经不同乙醇置换处理后的材料,按照刘海英等[13]的方法进行I2-KI法和DAPI法染色和制片,在Leica DMIL倒置荧光显微镜下(目镜10×,物镜20×)观察小孢子发育过程观察并统计花粉育性[13-14]。
1.4 自交结实率调查统计
于抽穗后开花前随机选取10个麦穗分别套袋,成熟期按国内法[8]调查和统计自交结实率。
1.5 数据分析
采用Excel 2016和SPSS 19.0进行数据统计、处理和分析。
2 结果与分析
2.1 不同乙醇置换处理对小麦小孢子发育进程中不同染色法染色效果的影响
2.1.1 对I2-KI法染色效果的影响
由图1可知,采用FAA固定后经90%-80%-70%处理,I2-KI法染色后,在单核期,郑麦366(图1A)和BNS366小孢子(图1E)均可以观察到一个被染至黑褐色的细胞核,与郑麦366相比,BNS366的细胞核辨识度相对较高。在二核期之后,绝大部分郑麦366小孢子形状规则,始终维持圆形,细胞内可见淀粉积累,并随着发育进程继续,积累量逐渐增加,至开花期充满整个细胞,其细胞核在二核期由于淀粉遮挡模糊难辨,至三核期之后被遮挡程度加重以致完全无法显示;BNS366的小孢子在二核期之后开始出现皱缩变形,仅有少数淀粉积累,大部分细胞难以正常进入二核期,细胞核逐渐减小甚至消失。由图2可知,与90%-80%-70%处理相比,采用70%-70%处理,I2-KI法染色后,在二核期,细胞核辨识度略有提高,但同样由于染色区域的遮挡难以满足细胞学观察的要求;二核期之后郑麦366淀粉积累区域显色略深,BNS366细胞质和细胞核区域仍呈I2-KI溶液本身的黄褐色,其颜色也略深,但均不影响开花期花粉育性的判断。由图3可知,与90%-80%-70%和70%-70%处理相比,不置换处理的细胞核辨识度和70%-70%较为接近,且二核期后郑麦366淀粉积累区域显色和BNS366细胞质和细胞核区域黄褐色均较深。
以上结果说明,从单核期向二核期转变的阶段为BNS366小孢子的败育时期。三种乙醇置换处理下,I2-KI法染色均可以清晰显示小孢子内淀粉积累情况,可辅助判断花粉育性,按小孢子内淀粉积累区域颜色由深到浅排序为:不置换>70%-70%>90%-80%-70%。但因染色区域存在淀粉遮挡,均无法观察小孢子二核期之后的细胞核发育情况。

A~D:郑麦366; E~F:BNS366; A、E:单核期; B、F:二核期; C、G:三核期; D、H:开花期. 下同。
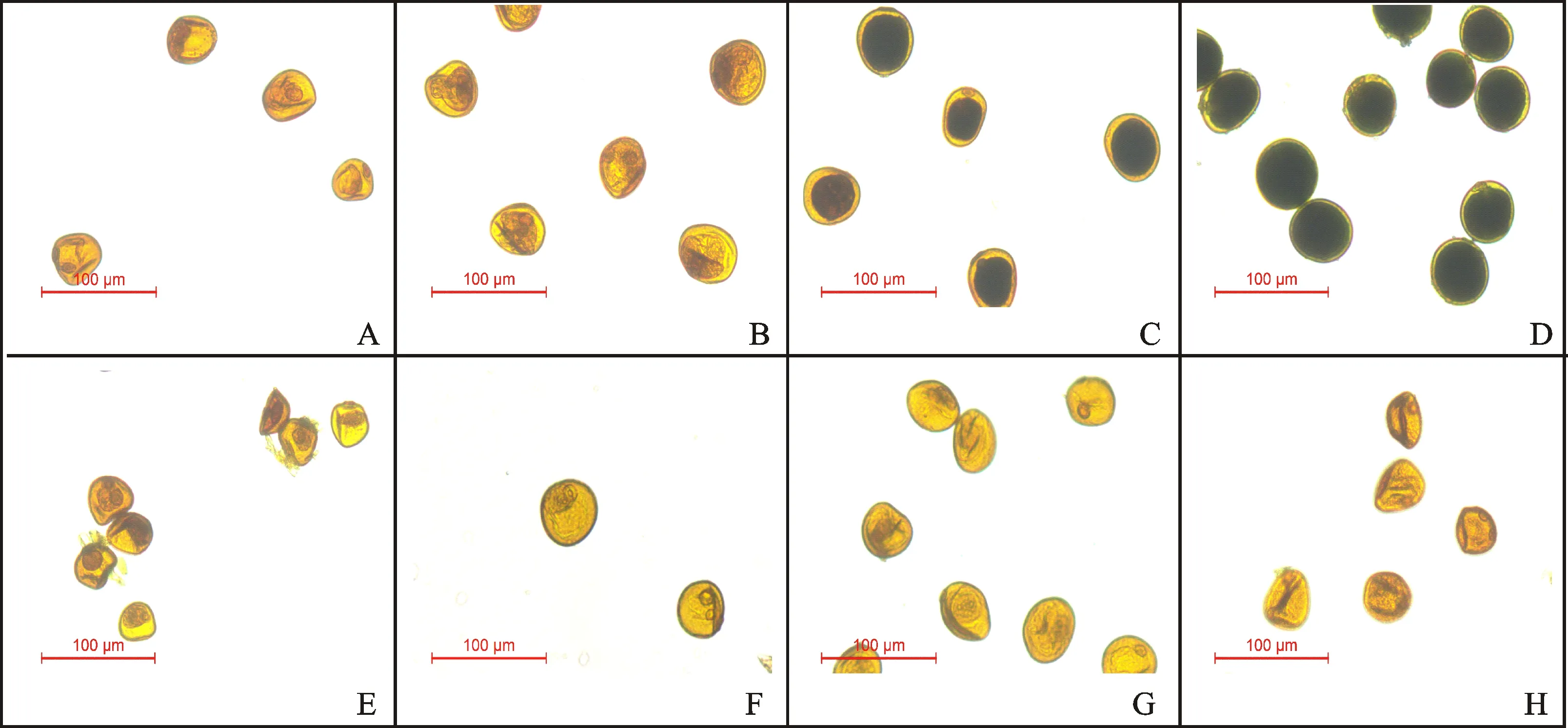
图2 70%-70%处理下郑麦366和BNS366花粉粒的I2-KI染色结果Fig.2 Pollens of Zhengmai 366 and BNS366 treated with 70%-70% ethanol replacement and stained with I2-KI
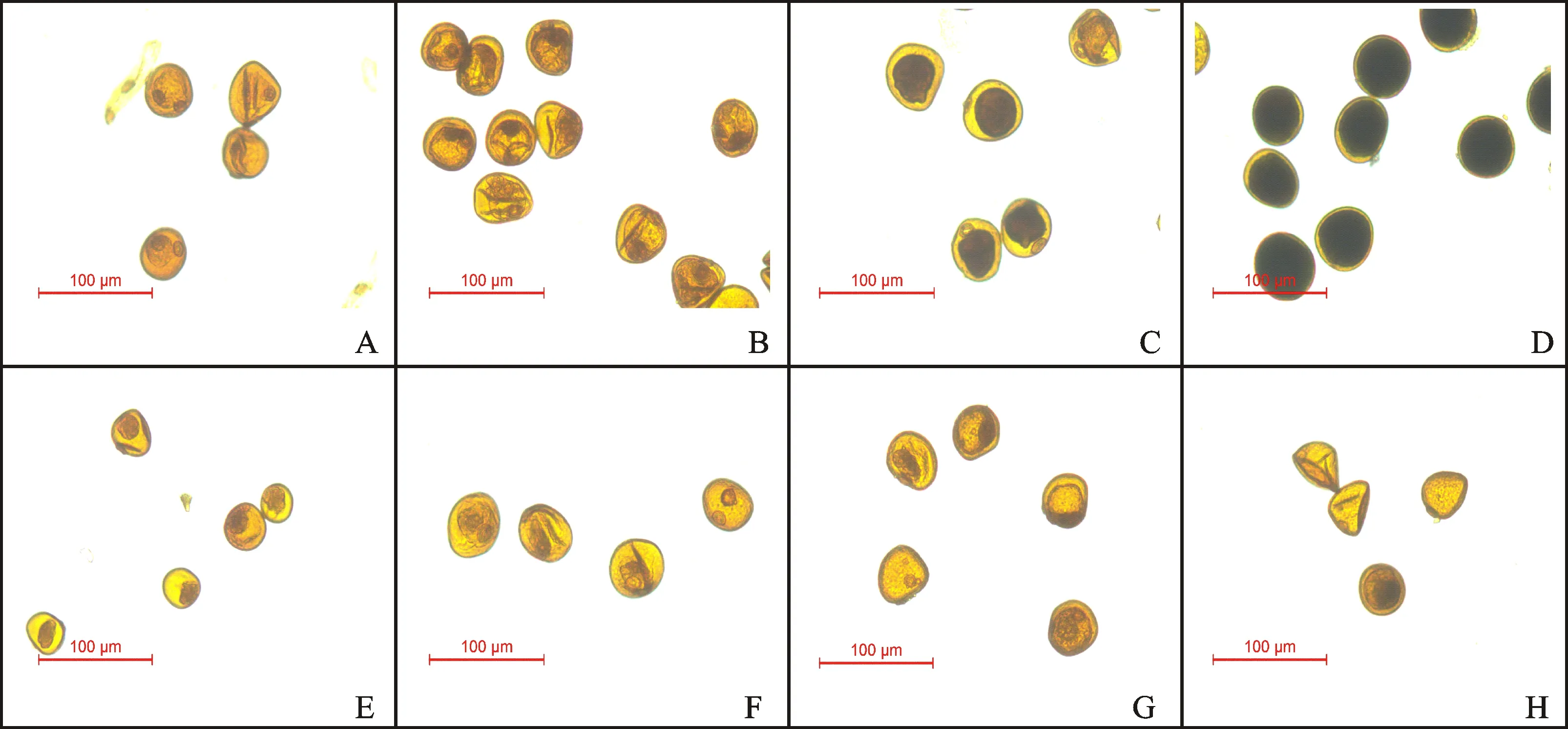
图3 不置换处理下郑麦366和BNS366花粉粒的I2-KI染色结果Fig.3 Pollens of Zhengmai 366 and BNS366 with non-replacement and stained with I2-KI
2.1.2 对DAPI法染色效果的影响
由图4、图5和图6可知,采用FAA固定后采用不同乙醇置换,DAPI法染色与I2-KI法染色观察到的郑麦366和BNS366小孢子发育过程中细胞外形的变化和内容物的积累情况相似,不同之处在于细胞内容物积累情况仅能通过略显白色区域判断。采用3种处理,在郑麦366小孢子发育的不同时期,均可见到发白发亮的细胞核,且随着发育进程的推进,细胞核的染色程度加重,与细胞质略显白色背景之间形成强烈反差,单核期能清晰观察到一个清晰的细胞核,二核期能清晰观察到两个清晰地细胞核,三核期能清晰观察到三个清晰的细胞核,开花期能够清晰看到一个圆形营养核和两个梭型精核,细胞核辨识度明显高于I2-KI法。BNS366小孢子细胞核染色程度比郑麦366浅,大部分小孢子内仅有一个细胞核,少数细胞可见两个细胞核,有的观察不到细胞核,至开花期细胞核消失不见,个别小孢子内可见一个皱缩变小的细胞核。
由图4可知,采用FAA固定后90%-80%-70%处理下,DAPI法染色后,在单核期,郑麦366(图4A)和BNS366小孢子(图4E)均能观察到一个发白发亮的细胞核,以郑麦366的细胞核清晰度相对较高且比较明亮,而BNS366细胞核则相对较暗。在二核期,郑麦366(图4B)细胞核明亮程度增加,能清晰地观察到两个发白发亮的细胞核,BNS366(图4F)小孢子的细胞质和细胞核区域较暗,细胞质微红,少数小孢子隐约可见一个细胞核。大部分细胞无法进入二核期,二核期细胞核出现逐渐变小的现象,至二核期之后消失。在三核期,郑麦366(图4C)可观察到三个发白发亮的细胞核,BNS366(图4G)仅有极个别小孢子可以看到亮度较弱的一个或两个细胞核,细胞质微红。至开花期,郑麦366(图4D)能够清晰看到一个圆形营养核和两个梭型精核,BNS366(图4H)则出现明显的皱缩变形,多数细胞看不见细胞核。由图5可知,与90%-80%-70%处理相比,70%-70%处理下小孢子细胞图像稍暗,能清晰观察到细胞核的形态特征,在郑麦366三核期和BNS366的二核期也存在细胞质微红现象,且程度略有加重。由图6可知,与90%-80%-70%和70%-70%处理相比,不置换处理的细胞图像清晰程度较差,郑麦366和BNS366单核期和开花期小孢子细胞图像清晰,郑麦366三核期小孢子细胞核暗淡不易观察,细胞质发白浑浊,或发红发亮,甚至部分细胞核被染成红色,细胞质和细胞核反差小,BNS366二核期和三核期小孢子细胞质着红色且比70%-70%处理下程度加剧。
以上结果说明,DAPI法染色可以清晰显示BNS366小孢子细胞核不能正常分裂进入二核期,核发育停滞甚至消失的典型细胞学变化,与I2-KI法染色结果中BNS366在单核期至二核期出现败育的现象相吻合。3种处理按细胞图像清晰度排序为:90%-80%-70%>70%-70%>不 置换。
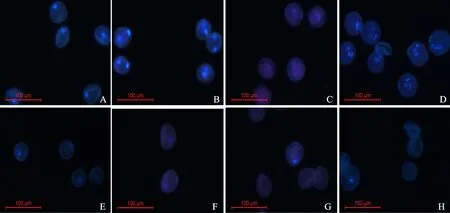
图4 90%-80%-70%处理下郑麦366和BNS366花粉粒的DAPI染色结果Fig.4 Pollens of Zhengmai 366 and BNS366 treated with 90%-80%-70% ethanol replacement and stained with DAPI
2.2 花粉育性与自交结实率比较
在郑麦366开花期取样,FAA固定后分别采用3种乙醇置换处理,2种染色方法对花粉染色后统计花粉育性,并与成熟期自交结实率进行比较。结果表明,三种处理下,I2-KI法和DAPI法的花粉可育率分别为77.91%和85.66%(90%-80%-70%)、87.38%和86.41%(70%-70%)、 87.19%和86.8%(不置换),均与调查的自交结实率(80.33%)一致。这表明FAA固定后三种处理对小麦花粉育性统计结果无实质性影响。

图5 FAA固定后70%-70%处理下郑麦366和BNS366花粉粒的DAPI染色结果Fig.5 Pollens of Zhengmai 366 and BNS366 treated with 70%-70% ethanol replacement and stained with DAPI
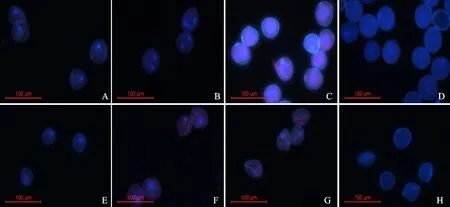
图6 不置换处理下郑麦366和BNS366花粉粒的DAPI染色结果Fig.6 Pollens of Zhengmai 366 and BNS366 with non-replacement stained with DAPI
3 讨 论
FAA固定后采用3种乙醇处理,经2种染色法对小麦小孢子染色,I2-KI法染色郑麦366开花期细胞核被淀粉遮盖出现黑褐色,DAPI染色下可以将郑麦366花粉粒细胞核染至发亮,而BNS366的花粉粒未能被染色,均可以观察到BNS366败育时期在单核期到二核期,与贺晓敏等[7]的研究结果相一致。郑麦366表现出正常可育小麦的小孢子发育细胞学特征。表明以此为试验模型来开展相关的细胞学观察准确可靠,可以进一步开展采用FAA固定液在三种不同置换条件下细胞学观察效果的比较研究。
FAA是一种快速、廉价的固定液,常用于小麦小孢子等植物材料的细胞学观察[15],刘海英等[13-14]研究表明,FAA适用于小麦小孢子I2-KI法和DAPI法染色后淀粉积累情况和细胞核发育状态的细胞学观察。小麦穗等植物样品在FAA固定24 h后,继续固定容易出现细胞硬化过度而导致细胞染色效果不佳的现象,常采用乙醇置换并最终保存在70%乙醇中。刘子涵等[16]试验中,采用FAA固定后,用70%乙醇漂洗3次后保存在70%乙醇中。在赵 卜等[10]的试验中,FAA固定24 h后抽真空经95%乙醇和80%乙醇冲洗,转入70%乙醇中保存。在张鹏飞等[17]和盛 英等[18]的试验中,用FAA固定后保存在70%乙醇中。刘海英等[13]在FAA固定郑麦366和BNS366小麦穗后,采取90%-80%-70%-70%乙醇置换各30 min,70%乙醇中保存的乙醇置换处理,经I2-KI法和DAPI法染色在小孢子淀粉积累和细胞核状况观察中均取得了良好的显示效果。本试验结果显示,样品采用FAA固定后经不同乙醇置换处理,I2-KI法染色后小麦小孢子细胞学观察效果出现规律性变化,90%-80%-70%处理下,其乙醇浓度呈梯度下降,置换次数为3次,在所有处理中次数最多,淀粉染色效果最浅;70%-70%处理下,乙醇浓度无梯度变化,置换次数为两次,淀粉染色效果比90%-80%-70%增强;不置换处理下,不涉及乙醇置换,淀粉染色程度最深,表明,随乙醇浓度梯度下降和置换次数增加,淀粉着色减弱,三种处理均不影响对小孢子细胞学特征和花粉育性的判断。样品采用FAA固定后经不同乙醇置换处理,DAPI法染色后小麦小孢子细胞学观察效果也出现规律性变化,90%-80%-70%处理下,紫外光下细胞核荧光较强,细胞质和细胞核区域亮度较高,细胞核辨识度高;70%-70%处理下,紫外光下小孢子细胞核荧光强度适中,在郑麦366三核期和BNS366的二核期也存在细胞质微红现象且程度略有加重,但不影响细胞学观察;不置换处理下,紫外光下细胞核荧光较弱,郑麦366三核期小孢子细胞核暗淡不易观察,细胞质发白浑浊,或发红发亮,甚至部分细胞核被染成红色,细胞质和细胞核反差小,BNS366二核期和三核期小孢子细胞质着红色且比70%-70%处理下程度加剧,细胞核辨识度低,无法满足细胞学观察的需要。这表明,随乙醇浓度梯度下降和置换次数增加,细胞核着色增加,细胞质着色程度减弱,细胞学观察效果逐渐改善。FAA固定后经3种乙醇置换处理,2种染色方法染色后,对花粉育性统计结果均无实质性影响。
综上所述,与90%-80%-70%相比,70%-70%处理下,I2-KI法和DAPI法染色后,细胞学观察效果略差,其淀粉积累情况、细胞核清晰程度、细胞质着色状况仍能满足细胞学观察的要求,但省试剂、省时间、省人力;与不置换相比,70%-70%处理细胞学观察效果较好,且操作人员制片时,仅接触到样品和保存液中的70%乙醇,与FAA固定液相比,过敏、刺激、化学性烫伤和中毒等风险均大大降低,对操作人员健康的保障效果更好。因此,在本试验条件下,70%-70%乙醇置换处理较为可取。

