抗条锈病普通小麦-滨麦6BS·6NsS附加易位系的分子细胞遗传学鉴定
杜少帅,林益达,于军伟,杜 欣, 杨晓莹,吉万全,王长有
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.农业部作物基因资源与种质创制陕西科学观测实验站,陕西杨凌 712100)
小麦条锈病是由小麦条锈菌(Pucciniastriiformisf.sp.tritici(Pst))引起的最具毁灭性的小麦真菌病害之一,可导致严重的经济损失。培育、种植抗条锈病品种是控制小麦条锈病最经济、有效的策略,然而,因为病原菌毒性小种的变异,大多数品种(基因)会很快或最终丧失条锈病抗性[1,2]。因此,迫切需要培育新的抗条锈病材料或品种。
滨麦(Leymusmollis(Trin.) Pilger,2n=4x=28,NsNsXmXm) 是禾本科(Poaceae)小麦族(Triticeae)的一个异源四倍体材料,农艺性状优良,且对小麦条锈病(stripe rust)、白粉病(powdery mildew)等多种真菌病害表现高抗或免疫,是改良普通小麦(TriticumaestivumL.)的重要种质资源。滨麦在小麦远缘杂交中有着广泛的应用,通过染色体工程产生了诸多类型的小麦-滨麦衍生材料(八倍体小滨麦[3]、部分双二倍体[3]、附加系[4-7]、代换系[8-10]、易位系[11-12]和渐渗系)。携带滨麦抗条锈基因的小麦-滨麦衍生材料是小麦抗性育种重要的桥梁材料,其中,易位材料携带较少的不利基因,有较大的育种价值,关于小麦-滨麦易位材料的报道较少。易位材料通常由附加系和代换系衍生而来[13]。人工诱导产生易位如杀配子染色体[11,14-16]诱发易位的频率较高,而染色体自发易位的频率较低,但也有一定几率发生[12,17]。
M13063A-1来自于小麦-滨麦二体异附加系M13063-3-3[18]经过2年严格自交的衍生后代。M13063-3-3是普通小麦7182和滨麦杂交后,用普通小麦山农20杂交一次,然后多年自交得到的小麦-滨麦衍生系,附加了一对滨麦第6部分同源群染色体,抗条锈菌生理小种条中31(CYR31)、条中32(CYR32)和条中33(CYR33)。本研究运用细胞学、原位杂交和分子标记等技术,结合形态学以及条锈病抗性调查,对自发易位系M13063A-1进行了鉴定,为该材料在小麦改良育种和抗病育种中的应用提供依据。
1 材料与方法
1.1 材 料
普通小麦7182、辉县红和小麦-滨麦衍生后代M13063A-1均于2018-2019年种植在西北农林科技大学试验田,滨麦种植于室内光照培养箱中,PCR引物、华山新麦草(Psathyrostachyshuashanica,2n=2x=14,NsNs)基因组DNA、乌拉尔图小麦(Triticumurartu,2n=2x=14,AA)基因组DNA、粗山羊草(Aegilopstauschii,2n=2x=14,DD)基因组DNA和以上所有材料都由西北农林科技大学农学院小麦远缘杂交与染色体工程实验室提供。条锈菌生理小种CYR31和CYR32,由西北农林科技大学植物保护学院 提供。
1.2 方法
1.2.1 细胞学鉴定
分别于3月下旬和4月中旬在田间取材料的根尖和幼穗。根尖、幼穗的固定和镜检按照Yang等[3]的方法进行。用Olympus BX-43 (Japan)显微镜观察并拍照。
1.2.2 原位杂交
种子在23 ℃萌发2~3 d,直至幼根长至2~3 cm,将根尖分生区切下,根尖的固定按照Zhang等[19]的方法进行。染色体制片采用滴片法[20]。基因组原位杂交(genomicinsituhybridization,GISH)按照Yang等[3]的方法进行。荧光原位杂交(fluorescenceinsituhybridization,FISH)按照Han等[21]的方法进行,结果参考Tang等[22]发表的普通小麦中国春和绵阳11的FISH核型。用Olympus BX53(Japan)荧光显微镜观察并拍摄图像,用Photoshop CC(Adobe,USA)分析并处理图像。
原位杂交探针:按照Yang等[4]的方法,用CTAB法提取幼嫩叶片的DNA。用滨麦基因组DNA探针(绿)进行减数分裂中期ⅠGISH;用寡核苷酸探针Oligo-pSc119.2(绿)、Oligo-pTa535(红)和滨麦基因组DNA探针(绿)进行连续的FISH和GISH(FISH-GISH);用华山新麦草基因组DNA探针(绿)进行GISH;用乌拉尔图小麦基因组DNA探针(绿),滨麦基因组DNA探针(绿)和粗山羊草基因组DNA探针(红)进行多色GISH(multi-color GISH,mc-GISH)。以滨麦基因组DNA探针(绿)、Oligo-pSc119.2(绿)分别和三种寡核苷酸探针Oligo-pTa71-2[22](红,着丝粒探针)、Oligo-119[23](红)、Oligo-60[23](红)结合进行GISH,来探究2B、6B和7B染色体的FISH信号模式以及易位染色体中小麦染色体片段的来源,试验结果分别参考Oligo-pTa71-2、Oligo-119、Oligo-60在B基因组染色体上产生的信号模式[22-23]进行分析。
1.2.3 分子标记分析
分布在小麦第6同源群染色体上的18个PLUG标记、176个EST标记和106个SSR标记被用来确定M13063A-1所携带的滨麦染色体片段的同源群归属。PCR和电泳分析按照Zhu等[24]的方法进行。
1.2.4 农艺性状和条锈病抗性鉴定
在2019年6月收获植株后,调查并记录M13063A-1和普通小麦7182的株高、分蘖、穗长、小穗数、小穗粒数。M13063A-1与普通小麦7182之间的差异显著性用T检验进行分析。
在试验植株成株期,于田间环境条件下接种条锈菌生理小种条中31和条中32的混合菌种进行M13063A-1的成株期条锈病抗性鉴定,以感病对照辉县红作诱发行,将孢子均匀地撒在喷湿的植株上进行人工诱发。当辉县红充分发病时,按照Bariana等[25]的“0~4”级分级标准对M13063A-1、7182和辉县红进行抗病等级鉴定。
2 结果与分析
2.1 细胞学鉴定结果
根尖分生区细胞染色体数目观察结果(图1a)显示,M13063A-1体细胞中含有44条染色体。花粉母细胞镜检结果(图1b)显示,其减数分裂中期Ⅰ染色体配对构型为2n=44=22Ⅱ,其中一对染色体提前分离;在减数分裂后期Ⅰ(图1 c)同源染色体可以均等分离。此外,在减数分裂中期Ⅰ细胞中没有观察到多价体形成。这些结果说明M13063A-1在细胞学上稳定遗传。

a:有丝分裂中期;b:减数分裂中期Ⅰ;c:减数分裂后期Ⅰ。箭头指示提前分离染色体。
2.2 原位杂交结果
用滨麦基因组DNA探针对M13063A-1根尖细胞染色体组进行GISH,结果(图2b)显示,M13063A-1含有两条易位染色体。用滨麦基因组DNA探针对M13063A-1幼穗细胞染色体组进行GISH,结果(图2a1~图2a4)显示,两条易位染色体在减数分裂中期Ⅰ配对成二价体(图2a1~图2a3),在减数分裂后期Ⅰ均等分离到细胞两极(图2a4),这表明M13063A-1可以稳定遗传。在减数分裂中期Ⅰ,有一对普通小麦染色体提前分离(图2a3),在实际观察中,也有一对易位染色体提前分离的情况出现(未提供照片)。在减数分裂中期Ⅰ细胞的GISH结果中,并未观察到多价体的形成。用华山新麦草基因组DNA探针对M13063A-1根尖细胞染色体组进行GISH(图2c),也观察到两条易位染色体,这表明M13063A-1携带的滨麦染色体片段来自Ns基因组染色体。
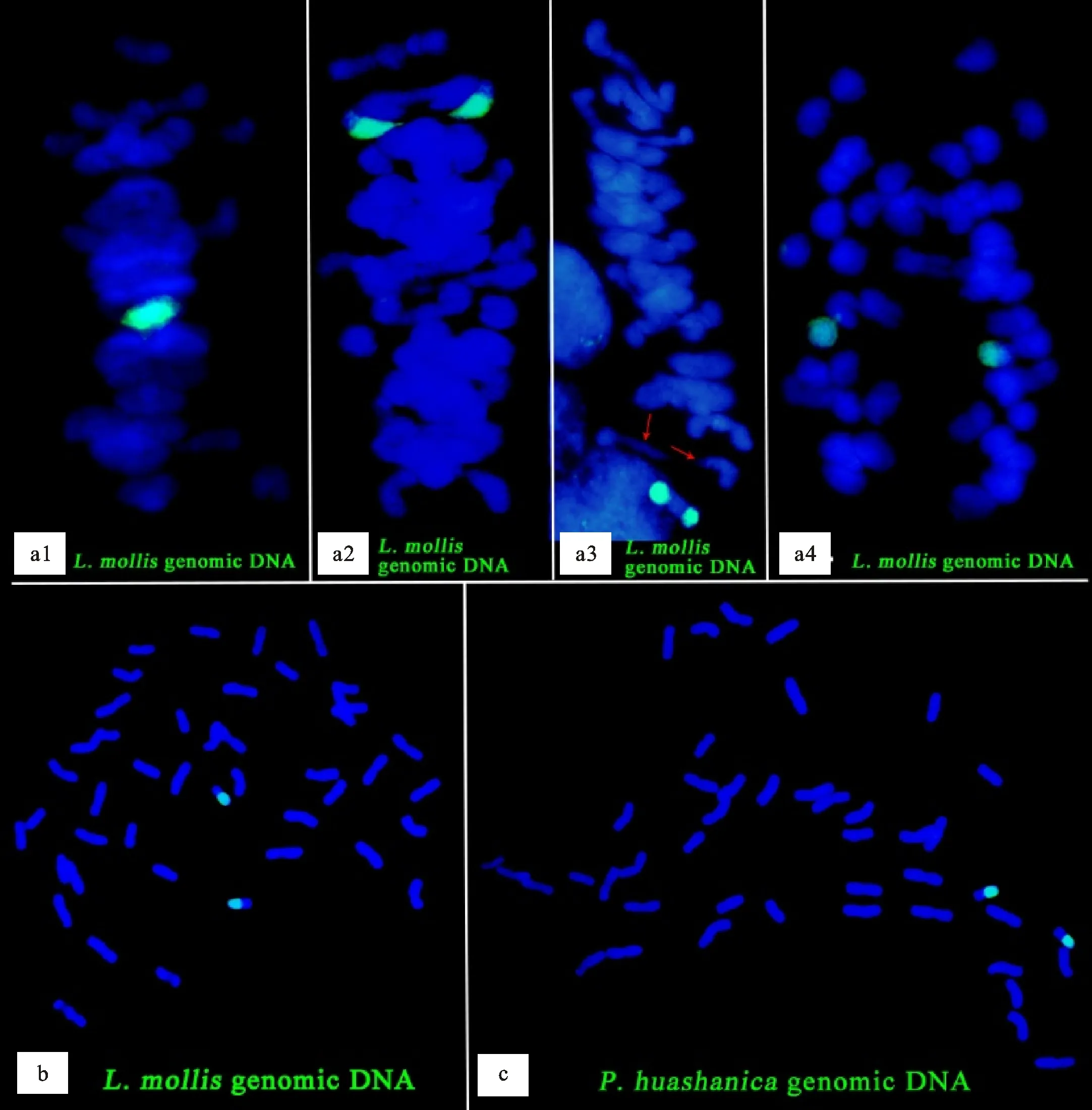
a1、a2、a3:用滨麦基因组DNA探针进行减数分裂中期Ⅰ原位杂交;a4:用滨麦基因组DNA探针进行减数分裂后期Ⅰ原位杂交;b:用滨麦基因组DNA探针进行有丝分裂中期原位杂交;c:用华山新麦草基因组DNA探针进行有丝分裂中期原位杂交。红色箭头指示提前分离的一对普通小麦染色体。
FISH-GISH结果(图3a、图3b)显示,M13063A-1含有42条普通小麦染色体和一对易位染色体。易位染色体长臂是滨麦染色体片段,短臂是普通小麦染色体片段。寡核苷酸探针Oligo-pTa535在易位染色体长臂末端即滨麦染色体端部产生了微弱的红色信号。42条普通小麦染色体中,2B、6B、7B染色体暂时不能分辨清楚(如图3a中白色六角星所示)。图3c是根据图3a和图3b整理的M13063A-1的核型,寡核苷酸探针Oligo-pSc119.2(绿)和Oligo-pTa535(红)可以区分M13063A-1中的42条普通小麦染色体,并且B基因组染色体上的绿色信号各不相同,这说明只用Oligo-pSc119.2就可以区分B基因组染色体。
用乌拉尔图小麦基因组DNA探针(绿)、滨麦基因组DNA探针(绿)和粗山羊草基因组DNA探针(红)进行mc-GISH,结果(图4a)显示,A基因组染色体(显示白色)、B基因组染色体(显示蓝色,即无信号)和D基因组染色体(显示红色)分别有14条,且滨麦基因组DNA探针(绿)在易位染色体长臂上产生了明亮的绿色信号,在短臂上无信号(显蓝色),说明易位染色体的短臂可能来源于B基因组染色体。因为只用寡核苷酸探针Oligo-pSc119.2就可以区分B基因组染色体,所以用滨麦基因组DNA探针(绿)、Oligo-pSc119.2(绿)分别和三种在B基因组染色体上产生特异信号的寡核苷酸探针Oligo-pTa71-2(红)、Oligo-119(红)、Oligo-60(红)结合进行GISH,确定了M13063A-1中2B、6B和7B染色体的FISH信号模式(图4b1~图4b3、图4c)。如图4b1和图4c所示,随体探针Oligo-pTa71-2在1BS、6BS和易位染色体短臂上都产生了明显的红色信号,但1BS上的红色信号明显比6BS和易位染色体强烈,说明易位染色体的短臂是6BS,而且红色信号产生在易位染色体短臂的末端,说明易位染色体不含有6B的随体。

a:FISH;b:GISH;c:核型。白色箭头指示易位染色体,白色六角星指示暂时不能分辨的3对普通小麦染色体。T表示易位染色体。
2.3 分子标记分析结果
在定位于第六同源群的PLUG、EST和SSR标记中,最终筛选出1个PLUG特异标记(TNAC1677)、3个EST特异标记(BQ159615、CD454198、CD454353)和2个SSR特异标记(Xwmc672、Xcwm532)(表1),以上6个标记均在滨麦和M13063A-1中扩增出了明显的特异性条带(图5)。TNAC1677、BQ159615、CD454198和CD454353位于小麦第六同源群染色体短臂,结合以华山新麦草基因组DNA为探针的GISH结果(图2c),说明M13063A-1携带的滨麦染色体片段为6NsS。
2.4 农艺性状和条锈病抗性
农艺性状鉴定结果(表2和图6a、图6b、图6c)表明,M13063A-1的株高极显著低于亲本7182,穗长极显著小于亲本7182。在成株期,M13063A-1、7182和辉县红的条锈病抗性等级分别为1级、3级和4级(图6d),这表明M13063A-1在成株期抗条锈菌生理小种条中31和条中32。
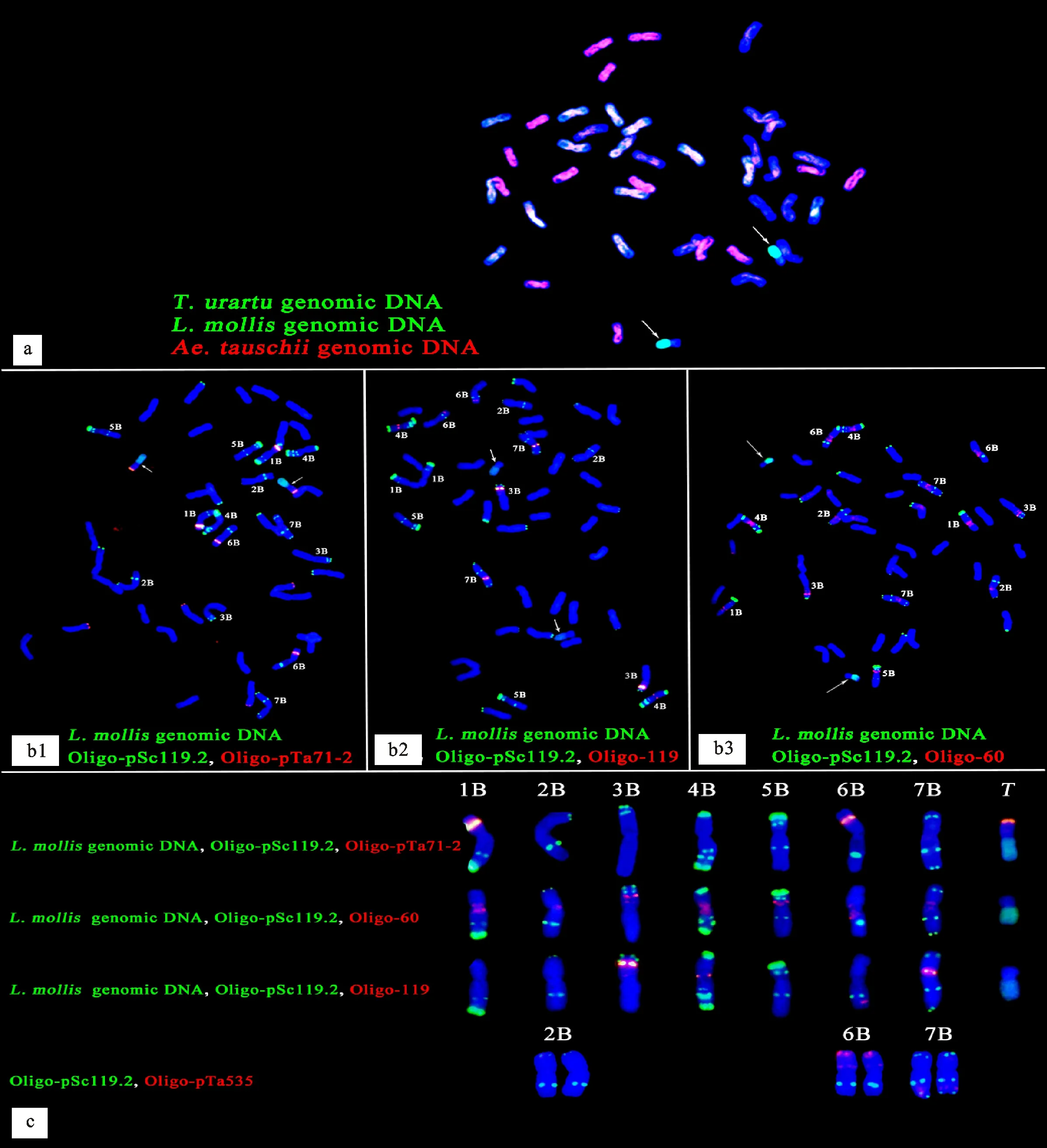
a:以乌拉尔图小麦基因组DNA(绿)、滨麦基因组DNA(绿)和粗山羊草基因组DNA(红)为探针的多色GISH;b:分别以Oligo-pTa71-2(红)、Oligo-119(红)、Oligo-60(红)和滨麦基因组DNA(绿)、Oligo-pSc119.2(绿)为探针的GISH(b1:Oligo-pTa71-2;b2:Oligo-119;b3:Oligo-60);c:根据图4 b1、b2、b3整理的B亚基因组染色体和易位染色体信号模式。白色箭头指示易位染色体。T表示易位染色体。

表1 M13063A-1携带的滨麦6NsS连锁的PLUG、EST和SSR标记Table 1 PLUG,EST and SSR polymorphic markers mapped on Lm#6NsS in M13063A-1

M:D2000;1:7182;2:山农20;3:L.mollis;4:M13063A-1;a1:TNAC1677-HaeⅢ;a2:TNAC1677-TaqⅠ;b1:BQ159615;b2:CD454198;b3:CD454353;b4:Xwmc672;b5:Xcwm532。箭头指示特异条带。

表2 M13063A-1及其亲本7182的主要农艺性状比较Table 2 Agronomic traits of M13063A-1 and its parent 7182

a:植株;b:穗;c:小穗和籽粒;d:条锈病抗性;1:7182;2:滨麦;3:M13063A-1;4:辉县红。
3 讨 论
3.1 附加易位系M13063A-1形成的原因
在二体异附加系M13063-3-3进行减数分裂时,6B染色体和6Ns外源染色体发生同源重组是形成6BS·6NsS易位染色体的前提。由于部分同源性,一条6B染色体与一条6Ns外源染色体配对且发生易位,形成6BS·6NsS易位染色体和6BL·6NsL易位染色体,而另一条6B染色体和6Ns染色体不配对或者进行配对但是不发生易位。在形成配子时,产生含有21条普通小麦染色体和一条6BS·6NsS易位染色体的雄配子和雌配子,雄配子和雌配子结合,形成含有42条普通小麦染色体和一对6BS·6NsS易位染色体的合子,进而形成了附加易位系M13063A-1。
3.2 M13063A-1中的染色体结构变异
Han等[13]在小麦-中间偃麦草衍生系Z4、Z5和Z6中发现复杂的易位和重组,这些结构变异都是自发产生的,其中,Z5体细胞染色体数目为44条,在普通小麦基因组上附加了一对易位染色体,该易位包含A组、D组和中间偃麦草的染色体片段。M13063A-1和Z5的不同是其易位只涉及小麦B基因组染色体。这种附加易位系出现的原因尚不确定,有待进一步探究。
在M13063A-1减数分裂中期Ⅰ细胞的GISH结果中,并未观察到6BS·6NsS易位染色体和6B染色体形成的多价体,这与预期结果不符。(GAA)10[26](图片未提供)和寡核苷酸探针Oligo-pTa535、Oligo-119、Oligo-60都未在易位染色体片段上产生信号,结合原位杂交结果,推测易位染色体片段是6BS上包含次缢痕的一小段片段,易位染色体不含有6B染色体的随体和着丝粒,其着丝粒是滨麦6Ns着丝粒。端粒花束的形成和着丝粒配对在同源染色体的配对过程中起着至关重要的作用[27],但是随体是否在1B和6B染色体的同源配对过程中起作用尚不清楚。易位染色体不含有6B的着丝粒和随体,这可能是M13063A-1在减数分裂中期Ⅰ没有多价体形成的原因。
3.3 M13063A-1抗条锈病基因的来源
携带外源染色体的衍生材料是利用外源优异基因的重要种质资源。Bao等[1]和Li等[2]都曾在小麦-滨麦衍生系中定位到了来自滨麦的条锈病抗性基因。在本研究中,虽然M13063A-1抗条锈病,且其亲本之一7182不抗病,但因缺少另一亲本山农20的条锈病抗性表现,所以无法确定M13063A-1的抗条锈病基因来源。因此,M13063A-1的条锈病抗性是否来源于滨麦有待进一步鉴定。

