肺超声评分预测重症呼吸支持患者撤机成功的临床价值
潘晓洁 杜桂彬 许新新 袁 静 李冰冰
机械通气是治疗重症呼吸支持患者最有效的支持手段之一[1]。原发疾病改善或控制后,应及早脱离机械通气,但过早或不恰当撤机拔管易导致患者呼吸肌无力,导致肺通气面积下降及肺换气功能障碍,再次诱发呼吸衰竭[2],撤机失败可使重症呼吸支持患者的死亡风险增至40%~50%[3]。因此规范化撤机计划至关重要。目前临床脱机流程是通过自主呼吸试验(spontaneous breathing trial,SBT)后拔管,但即使 SBT成功,仍有8.0%~26.0%患者再次插管[4]。因此需采用客观工具及确切数据,以指导临床选择合适撤机时机。肺超声可无创、无辐射、动态、实时判断肺炎、呼吸窘迫综合征及肺容积变化等肺部情况,本研究尝试探讨肺超声评分预测重症呼吸支持患者撤机成功的价值。
资料与方法
一、研究对象
选取2017年2月至2019年10月我院收治的重症呼吸支持患者86例,男55例,女31例,年龄49~75岁,平均(60.14±5.18)岁;体质量指数17.3~27.5 kg/m2,平均(22.79±1.85)kg/m2;根据撤机结局分为撤机成功组64例和撤机失败组22例。纳入标准:①机械通气时间>72h;②多巴胺或多巴酚丁胺剂量<5~10 μg·kg-1·min-1;③临床资料完整。排除标准:①既往有胸壁畸形、肺切除或肺部肿瘤所致呼吸力学异常者;②合并室性心动过速、心房颤动、频发室性早搏等严重心律失常者;③近48 h内有肌松剂使用史者;④合并纵隔气肿、气胸或大量胸腔积液者;⑤左室射血分数<50%者;⑥合并弥漫性或节段性室壁运动障碍者;⑦肝、肾等重要脏器器质性病变者。本研究经我院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.肺超声检查:使用Philips CX 50彩色多普勒超声诊断仪,线阵探头,频率9~13 MHz。患者取仰卧位,采用12肺区分区法检查两侧前胸壁、侧胸壁及后胸壁,以腋前线、腋后线为界,将每侧肺分成前、侧、后三个区,每区再分为上下两部分,并在双侧肋缘下对肺底进行扫查。每例患者均进行2次肺超声检查,相隔1 d。肺超声评分标准[5]:肺滑动征伴A线,或<2个单独B线为正常通气区(N),计0分;多发、典型B线为中度肺通气减少区(B1线),计1分;多发融合B线为重度肺通气减少区(B2线),计2分;组织影像伴典型支气管充气征为肺实变区(C),计3分。肺超声评分为12个肺区得分总和,总分36分。比较两组撤机前肺超声评分。
2.动脉血气分析指标检测:空腹抽取动脉血3 ml,使用ISTAT自动血气分析仪检测氧分压(PaO2)、氧合指数(PaO2/FiO2)、二氧化碳分压(PaCO2)及动脉血酸碱度(pH)值,严格参照美国雅培公司提供的试剂盒说明书操作。
3.撤机结局判定标准[5]:采用T-管法SBT行撤机筛查试验。SBT试验成功标准:①PaO2/FiO2150 mm Hg(1 mm Hg=0.133 kPa)、pH 7.25、PaO260 mm Hg,并伴有自主咳嗽能力;②体温<38℃;③血压稳定。SBT成功后,断开呼吸机连接T管。撤机48 h内能耐受自主呼吸,无需再次实施机械通气辅助呼吸为撤机成功;48 h内难以维持自主呼吸,需重新恢复机械通气或撤机后48 h内死亡为撤机失败。
三、统计学处理
应用SPSS 22.0统计软件,计量资料以x±s表示,行t检验;计数资料以例或率表示,行χ2检验。多因素Logistic回归分析撤机结局的影响因素。肺超声评分与动脉血气指标的相关性采用Pearson相关分析法。绘制受试者工作特征(ROC)曲线分析肺超声评分预测成功撤机的价值。P<0.05为差异有统计学意义。
结 果
一、两组一般资料
两组性别、年龄、体质量指数、呼吸机使用时间、急性生理学及慢性健康状况(APACHEⅡ评分)、原发疾病等方面比较,差异均无统计学意义;撤机成功组撤机前液体负平衡、膈肌移动度均高于撤机失败组,心率低于撤机失败组,差异均有统计学意义(均P<0.05)。见表1。
二、两组撤机前肺超声评分和动脉血气指标比较
两组撤机前pH值比较差异无统计学意义;撤机成功组撤机前PaO2、PaO2/FiO2均高于撤机失败组,肺超声评分、PaCO2均低于撤机失败组,差异均有统计学意义(均P<0.05)。见表2和图1,2。APACHEⅡ:急性生理学及慢性健康状况

表1 两组一般资料比较
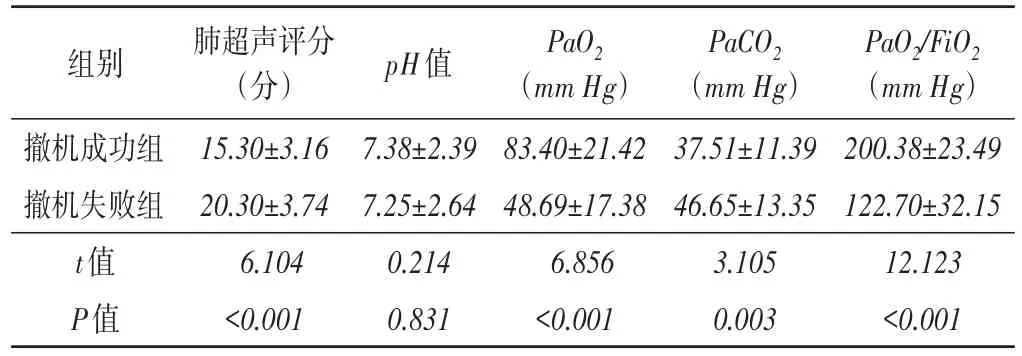
表2 两组撤机前肺超声评分和动脉血气指标比较(x±s)
三、撤机结局的影响因素分析
以撤机结局为因变量(撤机成功赋值为0,撤机失败赋值为1),将撤机前液体负平衡、膈肌移动度、心率、肺超声评分、PaO2、PaO2/FiO2、PaCO2为自变量,纳入多因素Logistic回归分析模型,结果显示,撤机前液体负平衡、HR、肺超声评分、PaO2、PaO2/FiO2、PaCO2均与撤机结局相关(均P<0.05),其中以肺超声评分的影响最大。见表3。

图1 撤机成功组同一患者撤机前后肺超声图像

图2 撤机失败组同一患者撤机前后肺超声图像
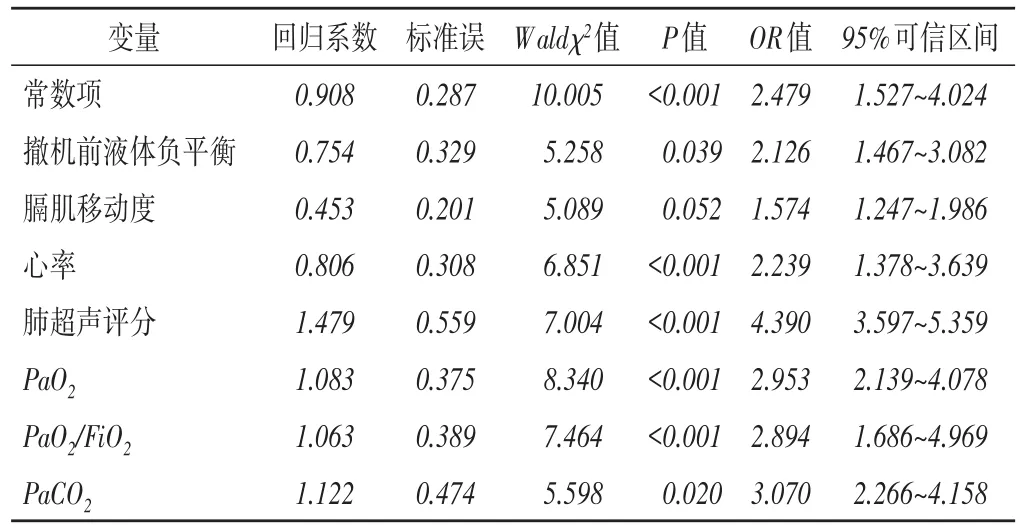
表3 撤机结局影响因素的多因素Logistic回归分析
四、相关性分析
Pearson相关性分析结果显示,肺超声评分与PaCO2呈正相关(r=0.677,P<0.05),与PaO2、PaO2/FiO2均呈负相关(r=-0.850、-0.634,均P<0.05)。见图3~5。
五、ROC曲线分析
ROC曲线分析显示,当肺超声评分>19.47分时,预测重症呼吸支持患者成功撤机的敏感性为54.55%,特异性为95.31%,曲线下面积为0.784(95%可信区间:0.682~0.866,P<0.001)。见图6。

图3 肺超声评分与PaCO2的相关性分析散点图
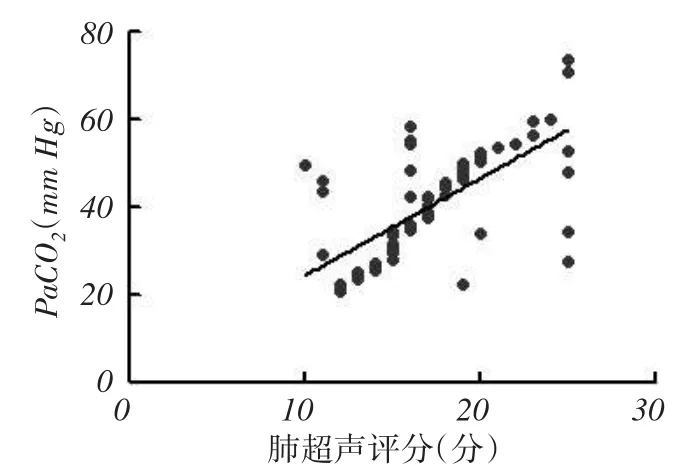
图4 肺超声评分与PaO2的相关性分析散点图

图5 肺超声评分与PaO2/FiO2的相关性分析散点图

图6 肺超声评分预测重症呼吸支持患者成功撤机的ROC曲线图
讨 论
研究[6-7]表明,由于气管插管管径过小、气管软化、气道狭窄、胸腔积液等,导致重症呼吸支持患者气道阻力增高、呼吸系统顺应性降低、气体交换受损,从而引起撤机失败。另有学者[8]认为,SBT试验过程中,患者肺通气不足也与撤机失败存在一定相关性。因此,及早评估呼吸道及肺功能障碍,予以有效干预是提高撤机成功率的关键。胸部CT是评估肺部形态与肺部通气治疗效果的金标准,但存在辐射暴露风险,临床应用受限[9]。床旁肺部超声可从不同切面多角度扫查肺脏不同部位,检出潜在性局灶性病灶,反映肺间质水肿情况,通过A线、B线超声影像实施肺超声评分,可在不同通气状态下量化评估肺通气改变,准确了解不同肺部病变程度[10-11]。李莲花等[11]研究显示,肺超声评分可评估急性呼吸窘迫综合征患者肺部通气面积变化,进而评估病情严重程度,有效预测患者预后及病死率。本研究结果显示,撤机成功患者撤机前肺超声评分低于撤机失败患者(P<0.05),与杨婷等[12]研究结论一致,说明SBT试验后,床旁超声实时监测肺超声评分的改变有助于判断撤机时机,指导临床评估撤机结局。
国外研究[13]发现,受心脏相关因素影响,SBT试验失败患者撤机失败率高达42%。郑清江等[14]也发现,撤机前液体负平衡与重症呼吸支持患者撤机结局具有一定关联性,本研究经Logistic多因素回归分析,撤机前液体负平衡降低是重症呼吸支持患者撤机失败的重要影响因素,与上述文献结果一致,这可能是由于撤机前液体负平衡加大,能降低主动脉跨壁压,缓解撤机对心脏前负荷的影响,预防撤机失败发生。同时,PaCO2、PaO2、PaO2/FiO2是评估机体是否存在酸碱平衡失调、判断缺氧与缺氧程度的可靠指标,也是判断撤机条件的重要生理学指标[15]。本研究结果也表明,PaCO2、PaO2、PaO2/FiO2均与重症呼吸支持患者撤机结局相关(均P<0.05)。由此可见,早期监测重症呼吸支持患者动脉血气分析,可为撤机成功奠定良好基础。本研究结果还发现,心率是影响重症呼吸支持患者撤机结局的重要影响因素,故临床实施肺超声评分评估的同时监测心率变化,有助于早期识别撤机失败高风险,进一步减少撤机失败发生。
此外,本研究Pearson相关分析显示,肺超声评分与PaCO2呈正相关(r=0.677,P<0.05),与PaO2、PaO2/FiO2均呈负相关(r=-0.850、-0.634,均P<0.05),证实肺超声评分有助于临床尽早识别撤机失败高风险因素,予以合理有效干预。在上述研究基础上,本研究通过绘制ROC曲线进一步证实,肺超声评分预测重症呼吸支持患者撤机成功的曲线下面积为0.784,当肺超声评分>19.47时,特异性高达95.31%,提示肺超声评分具有成为预测重症呼吸支持患者撤机成功的特异性指标的潜力,可为临床预防拔管失败及再插管提供量化评估。
综上所述,肺超声评分与动脉血气分析存在一定相关性,可作为判断重症呼吸支持患者撤机成功的特异性预测因子,有助于指导临床早期识别撤机失败高风险因素,预防撤机失败发生。

