实时三维超声联合斑点追踪技术评价终末期慢性肾脏病患者右室收缩功能
杜 锐 唐晓艳 钱胜利 杨 莉 马 洲 乔 伟 黄 炜
目前对终末期慢性肾脏病(end stage renal disease,ESRD)的心脏研究[1-3]主要集中在左室功能的评价,对右室研究较少。近期研究[4]表明,ESRD患者即使左室射血分数(LVEF)保留仍可出现不同程度的右室功能障碍。右室收缩功能障碍和肺动脉高压与全因死亡率呈独立相关,特别是对于LVEF保留的患者具有更高的死亡风险[5]。传统二维超声难以早期准确评价右室收缩功能障碍,待诊断出右室功能障碍时患者大多已进入终末期心力衰竭,无论是对于治疗原发肾脏疾病还是改善心功能,均在一定程度上贻误了早期诊断及最佳治疗时机。因此,准确评估血液透析患者右室容量及收缩功能,对临床医师判断患者心脏功能,指导透析策略及容量管理,减少心血管事件的发生有着重要意义。实时三维超声不依赖于心脏的几何构型假设,可定量分析右室的容积及功能;三维斑点追踪(3D-STI)技术可以定量检测心肌功能,对心肌运动功能更为敏感。本研究旨在应用实时三维超声联合3D-STI技术定量评估LVEF保留的ESRD患者右室构型及收缩功能。
资料与方法
一、研究对象
选取2018年1月至2019年12月在我院血液净化中心进行规律透析患者43例,根据中国肺高血压诊断和治疗指南2018版[6]判断是否合并肺动脉高压分为单纯ESRD患者23例(ESRD组)和ESRD合并肺动脉高压者20例(ESRD合并肺动脉高压组),其中ESRD 组,男 13例,女 10例,年龄 30~67岁,平均(52.43±11.44)岁;ESRD合并肺动脉高压组,男12例,女8例,年龄39~70岁,平均(55.35±10.75)岁。纳入标准:估测肾小球滤过率(eGFR)<15 ml/(min·1.73 m2)[7];透析病程均>6个月,均以桡动脉-头静脉内瘘为通路;LVEF>50%。排除标准:①<18岁者;②合并其他导致右室功能改变的心脏疾病,如先天性心脏病、心肌病、心肌梗死、中等量心包积液等;③合并其他导致肺动脉压力改变的疾病,如慢性阻塞性肺疾病、间质性肺纤维化等;④合并其他引起右室功能改变的慢性疾病或恶性肿瘤者;⑤孕妇或哺乳期妇女;⑥图像显示不清者。
另选健康志愿者25例(对照组),男14例,女11例,年龄42~72岁,平均(56.12±7.11)岁;经病史、实验室检查、超声心动图及胸片检查均未发现任何肾脏疾病及心肺系统疾病。本研究经我院医学伦理委员会批准,所有研究对象均签署知情同意书。
二、仪器与方法
1.超声检查:使用GE Vivid E 9彩色多普勒超声诊断仪,M5S及 4V 探头,频率 1.7~3.3 MHz;配备EchoPAC脱机工作站。为避免容量负荷的影响,透析患者超声检查均于透析结束后2 h内完成。受试者取左侧卧位,连接同步心电图后采用M5S探头行常规超声检查,获取右房横径(RAD)、右室基底部横径(RVD1)、右室中部横径(RVD2)、右室长径(RVD3)、主肺动脉内径(PAD);根据简化Bernoulli公式计算肺动脉收缩压(PASP);采用M型超声测得LVEF、左室舒张末期内径(LVID)及室间隔厚度(IVS);组织多普勒检测右室心肌做功指数(RIMP)。所有数值均测量3次取平均值。
2.图像分析:采用4V探头采集以右室为主的心尖四腔心切面动态图像并储存,将留存图像资料拷贝至EchoPAC工作站,选取预留的三维容积图像,运用4DRV Volume软件分析,手动调节各切面心内膜轨迹,系统自动追踪获得右室心内膜表面模型及相关参数:右室舒张末容积(EDV)、收缩末容积(ESV)、每搏输出量(SV)、右室射血分数(3DRVEF)、三尖瓣环收缩期位移(TAPSE)、右室面积变化分数(FAC),计算右室每分输出量(RVCO);于4DRV Volume软件的3D-STI子菜单中获取右室游离壁整体纵向应变(3DGLS)。所有参数均测量3次取平均值;为排除体表面积(BSA)的影响,心腔容积测值均以BSA矫正。所有图像采集均由同一高年资超声医师完成。
3.临床资料:收集受试者的年龄、性别、身高、体质量、心率、血压等资料(透析患者血压及体质量均在行超声心动图检查前测量,血压测量3次取平均值);收集行超声检查前3天内肌酐、血红蛋白及电解质等实验室检查结果。
三、统计学处理
应用SPSS 25.0统计软件,计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较行t检验。相关性分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
结 果
一、各组临床资料比较
各组间性别、年龄、BSA、透析时长及血钙浓度比较差异均无统计学意义。与对照组比较,两病例组收缩压、舒张压、心率、血肌酐、尿素氮及血磷浓度均升高,血红蛋白均降低,差异均有统计学意义(均P<0.05);与ESRD组比较,ESRD合并肺动脉高压组肺动脉压、血磷浓度均升高,血红蛋白降低,差异均有统计学意义(均P<0.05)。见表1。
二、各组常规超声参数比较
1.左室参数比较:与对照组比较,两病例组LVID、IVS均增大,LVEF减低,差异均有统计学意义(均P<0.05)。两病例组LVID、IVS、LVEF比较差异均无统计学意义。见表2。
2.右心参数比较:与对照组比较,ESRD组RIMP显著增大(P<0.01),RAD、RVD1、RVD2、PAD比较差异均无统计学意义;ESRD合并肺动脉高压组RAD、RVD1、RVD2、PAD、RIMP均显著增大,差异均有统计学意义(均P<0.01)。ESRD合并肺动脉高压组RAD、RVD1、RVD2均较ESRD组增大,差异均有统计学意义(均P<0.05)。各组间RVD3比较差异无统计学意义。见表2。
三、各组实时三维超声参数比较
EDV、ESV、RVCO在对照组、ESRD组、ESRD合并肺动脉高压组中依次增大,3DRVEF、TAPSE、FAC在各组间依次减低,差异均有统计学意义(均P<0.05)。与对照组比较,ESRD合并肺动脉高压组SV增大,差异有统计学意义(P<0.05)。3DGLS绝对值在各组间依次显著减低,差异有统计学意义(P<0.01)。见表3和图1。
表1 各组临床资料比较()

表1 各组临床资料比较()
与对照组比较,*P<0.05,**P<0.01;与ESRD组比较, P<0.05, P<0.01。BSA:体表面积。1 mm Hg=0.133 kPa
实验室检查组别对照组ESRD组ESRD合并肺动脉高压组F值P值磷(mmol/L)0.97±0.14 1.24±0.28*1.65±0.92**4.803 0.006男/女(例)14/11 13/10 12/8 0.054 0.817年龄(岁)56.12±7.11 52.43±11.44 55.35±10.75 0.913 0.406身高(cm)169.28±6.82 167.39±7.25 166.45±6.38 1.015 0.368体质量(kg)65.90±6.39 68.59±7.07 68.13±6.59 1.112 0.335 BSA(m )1.72±0.09 1.75±0.12 1.74±0.11 0.271 0.763收缩压(mm Hg)119.80±10.34 143.78±21.02**140.75±22.91**11.905<0.001舒张压(mm Hg)78.48±8.02 92.13±15.63**93.15±17.22**8.194 0.001心率(次/min)67.80±8.00 76.13±8.70**78.20±7.45**10.781<0.001透析时长(个月)-41.72±31.88 37.16±27.64 1.134 0.325肺动脉压(mm Hg)21.87±6.91 23.38±7.34 46.33±8.71 17.231<0.001血肌酐(mmol/L)69.54±12.84 604.83±241.41**672.30±237.63**40.099<0.001尿素氮(mmol/L)4.91±1.56 13.55±3.52**14.89±2.68**52.367<0.001血红蛋白(g/L)137.69±11.26 101.42±15.86**91.10±7.19**38.112<0.001钙(mmol/L)2.21±0.13 2.14±0.23 2.29±0.21 1.494 0.230
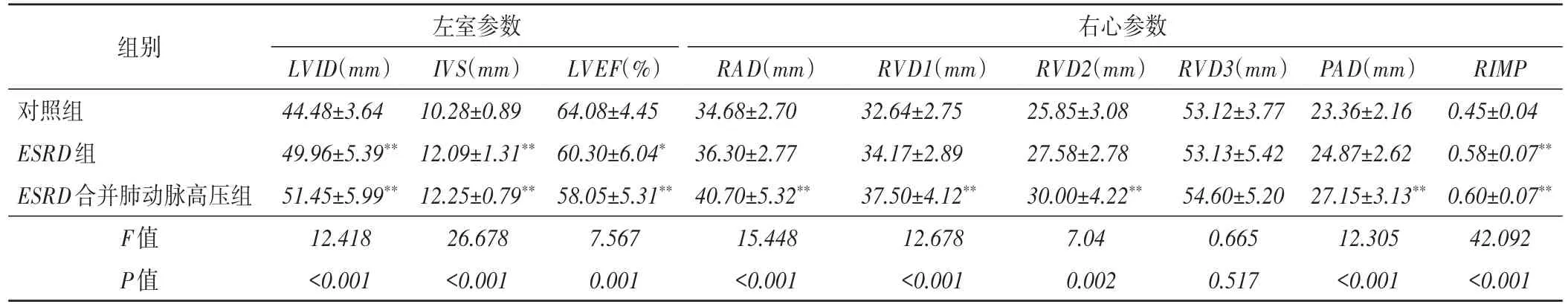
表2 各组常规超声参数比较(x±s)
四、相关性分析
所有受检者3DGLS绝对值与3DRVEF、TAPSE、FAC均呈正相关(r=0.77、0.62、0.59,均P<0.01);与RIMP呈负相关性(r=-0.55,P<0.01)。见图2。
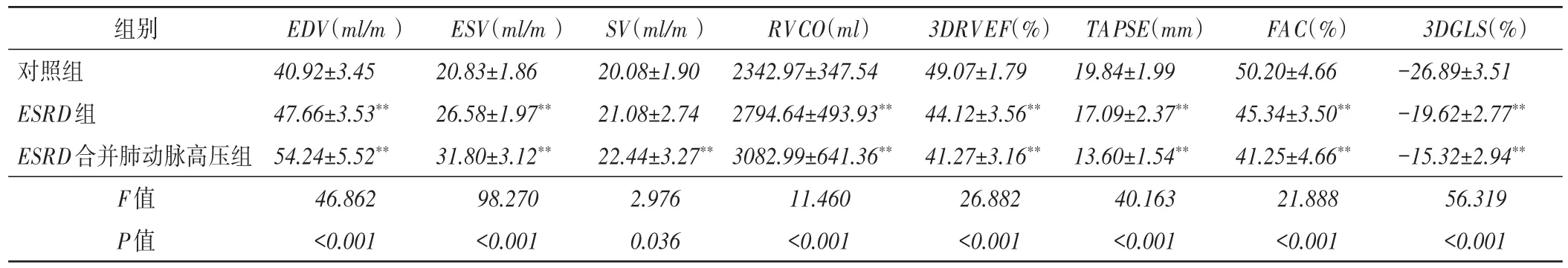
表3 各组右室三维参数及应变参数比较(x±s)

图1 各组右室三维超声成像图
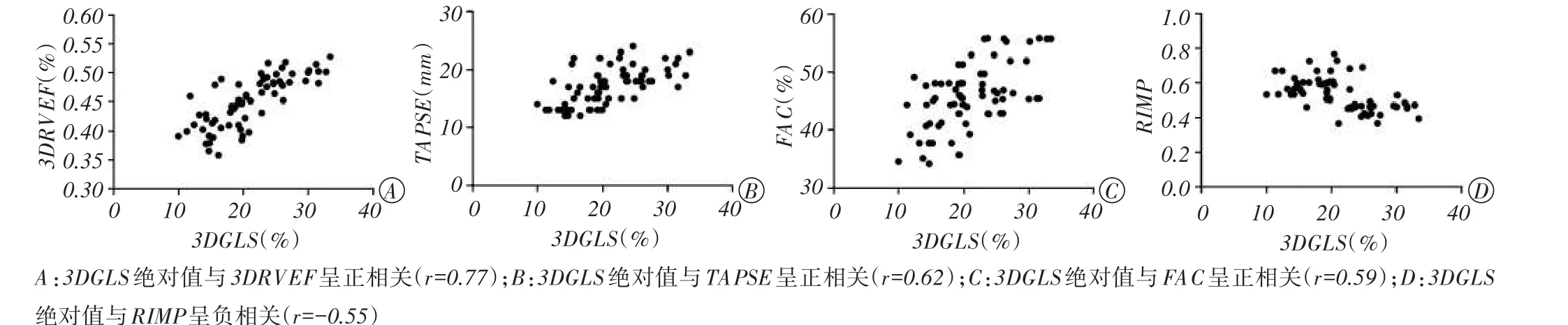
图2 所有受检者3DGLS绝对值与右室收缩功能参数相关性散点图
讨 论
ESRD是各类慢性肾脏病发展的终末阶段,全球患者估计在490万~708万[8],心脏结构和功能异常是ESRD患者常见的并发症和主要死亡原因[9]。研究[10]发现,与正常成人比较,LVEF正常及LVEF减低的尿毒症患者EDV显著增大,提示ESRD患者右心功能受损。国外学者[11]证实对于透析的ESRD患者,RVEF是预测死亡率的独立因素。因此,准确评估血液透析患者右室容量及收缩功能,对临床医师判断患者心脏功能、指导透析策略和容量管理,以及减少心血管事件的发生有着重要意义。本研究ESRD组中3DRVEF范围为38.89%~51.67%,其中有4例<45%,右室收缩功能不全的发生率约为17.39%。ESRD合并肺动脉高压组3DRVEF范围为35.82%~48.89%,其中11例患者<45%,收缩功能不全发生率约55.00%,显著高于ESRD组,表现为更明显的右室重构与功能损伤[12-13]。因此早期准确评估ESRD患者右室收缩功能,对于准确评估病情、制定合适的早期治疗方案和透析容量管理,以及预测患者预后意义重大。
实时三维超声可以获得心脏的真实形态,较为客观准确地描绘心腔的形状和体积,可以从三维空间上定量获得心脏结构和功能参数,较常规超声更敏感。本研究中,EDV、ESV、RVCO在对照组、ESRD组、ESRD合并肺动脉高压组中依次增大(均P<0.05),提示LVEF正常的ESRD患者即使不合并肺动脉高压,其右室已经出现不同程度的扩张,当合并肺动脉高压时扩张程度更为显著。而常规超声参数测得的右室大小(RVD1、RVD2)在ESRD患者中并无显著变化,仅当合并肺动脉高压时明显增大。虽然常规超声参数RIMP在ESRD组显著增高,可提示右心功能减低,但由于引起RIMP改变的原因众多,包括右室收缩功能下降、舒张功能异常等,因此RIMP改变在诊断右室收缩功能方面缺乏特异性[14]。
3D-STI通过实时地对心肌斑点追踪,计算出应变参数从而对心肌力学特征进行定性及定量评估,与MRI有较好的一致性[15]。本研究中3DGLS的绝对值随着ESRD的进展而逐渐减低,提示3DGLS与右室心肌收缩力呈良好的相关性。既往研究[10]认为,TAPSE和FAC是评价右室收缩功能的重要参数,本研究中ESRD组TAPSE、FAC较对照组明显减低,且合并肺动脉高压时减低更加显著(均P<0.01),与既往研究[16]结果一致,并且与应变参数3DGLS有较好的一致性,因此在评估ESRD患者的右室收缩功能时,TAPSE和FAC的敏感性和特异性均较高。本研究应用实时三维超声联合3D-STI技术评价LVEF保留的ESRD患者的右室收缩功能,因两种方法各参数间具有较强的相关性,故认为可应用多参数更全面定量评估右室容积及收缩功能的变化。
综上所述,ESRD患者即使LVEF保留时已出现右室功能障碍,且肺动脉高压时,其发生率显著增加;实时三维超声联合3D-STI技术可早期定量评估LVEF保留的ESRD患者右室容积及收缩功能的变化。但本研究样本量少,且未对病例组进行细分,后续将进行相应研究。

