黄芪多糖对庆大霉素致肾损伤豚鼠维生素D及p38MAPK、ERK1/2信号通路的影响
吴雍真,李 倩,管连城,李 文,高 洁,陈云志,朱 星,柴艺汇*
1.贵州中医药大学(贵州 贵阳 550025) 2.贵州中医药大学第二附属医院(贵州 贵阳 550002)
急性肾损伤(Acute Kidney Injury,AKI)是指由于各种因素导致肾功能短期内急剧下降致使机体内代谢产物潴留,水、电解质、酸碱平衡紊乱的临床综合征[1]。近年来,AKI的发病率呈逐年上升趋势。据调查显示[2],重症监护室中成年AKI发病率在16%~67%之间,并且AKI一旦发生,其病死率高达50%以上。目前,随着医药产品的迅猛发展,临床上不断出现新药,药物诱导AKI已呈上升趋势,在重症AKI患者中,超过20%是药物性损害[3]。药物因素已成为AKI发病的重要病因,其中联合使用或大剂量使用抗生素所致AKI问题最为突出,以庆大霉素为代表的氨基糖苷类抗生素是所有抗生素中最易导致肾损伤的一类药物,其肾毒性的发生率高达11%~26%[4]。因此,缓解药源性AKI是目前亟待解决的问题。
研究表明[5],丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)家族成员细胞外信号调节激酶(ERK1/2)、p38MAPK与肾脏疾病关系密切,并且p38MAPK可能参与庆大霉素损伤肾脏的过程。众多研究均发现抑制ERK1/2、p38MAPK激活可缓解药物导致的肾损伤。而作为类固醇激素的维生素D(Vitamin D,VD)则具有保护肾脏的作用。研究发现[6],VD可通过作用于肾小管上皮细胞、抑制炎症细胞因子如巨噬细胞趋化蛋白-1(MCP-1)等起肾脏保护作用,其也可调节ERK1/2、p38MAPK发挥抑制肿瘤生长和抗炎活性的作用[7]。黄芪多糖(APS)为中药黄芪的主要活性成分。临床研究发现,APS可改善肾脏病变患者肾功能,有效保护糖尿病肾病及肾间质纤维化大鼠的肾脏[8]。目前APS治疗肾脏病变相关疾病临床有效但具体机制尚不明确。本研究拟采用腹腔注射庆大霉素建立AKI豚鼠模型,观察APS对ERK1/2、p38MAPK及VD的影响,探讨APS改善庆大霉素诱导AKI的作用机制,为临床寻找有效防治药物提供理论和实验基础。
1 材料与方法
1.1动物成年健康豚鼠32只,雌雄各半,体质量(275±25)g,购自长沙市天勤生物技术有限公司,许可证号:SCXK (湘) 2014-0010。
1.2药品与试剂庆大霉素(开封制药集团有限公司,批号18012201);APS(合肥中龙神力动物药业有限公司,批号20170916);骨化三醇(青岛正大海尔制药有限公司,批号1709251);25(OH)D3ELISA试剂盒(批号201901)购自上海泛柯实业有限公司;肌酐(Cr)ELISA试剂盒(批号20190108)、尿素氮(BUN)ELISA试剂盒(批号20190107)、iNOS ELISA试剂盒(批号20181228)、MCP-1 ELISA试剂盒(批号20190710)均购自南京建成有限公司;Trizol总RNA提取试剂(Aidlab公司,Lot252250AX);HiScript Reverse Transcriptase(VAZYME公司,批号R101-01/02);Ribonuclease Inhibitor(TRANS公司,LotJ11202);兔多抗GAPDH(杭州贤至生物有限公司,批号AB-P-R 001);兔多抗VDR(Abcam公司,批号Ab3508);兔单抗CYP27B1(Abcam公司,批号Ab206655);山羊多抗CYP24A1(NovUS公司,批号NBP1-52111);兔单抗p-p38MAPK(Cell Signaling Technology公司,批号4511);兔单抗P-ERK(Cell Signaling Technology公司,批号4370);HRP标记羊抗兔二抗(批号BA1054)、HRP标记兔抗羊二抗(批号BA1060)、HRP标记羊抗小鼠二抗(批号BA1051),武汉博士德生物工程有限公司。BX53型生物显微镜(奥林巴斯公司)、RM2016 轮转式切片机(德国 Leica)、MK-3酶标仪 (Thermo公司);QuantStudio 6实时荧光定量PCR仪 (ABI公司);Nano-100微量分光光度计(杭州奥盛仪器有限公司);蛋白印迹电泳系统(北京六一仪器厂)。
1.3方法
1.3.1 动物分组与实验方案 豚鼠32只,适应性饲养1周后,随机分为4组,每组8只,分为正常对照组、模型组、APS组、VD组。正常对照组每天给予腹腔注射生理盐水100 mL/d;模型组,给予腹腔注射硫酸庆大霉素注射液,80 mg/(kg·d-1),连续21 d;APS组灌胃APS 200 mg/kg,1次/d,1 h后腹腔注射庆大霉素,剂量同模型组,连续使用21 d;VD组灌胃骨化三醇30 ng/kg,1次/d,1 h后腹腔注射庆大霉素,剂量同模型组,连续使用21 d;每天对实验动物进行称重,以调整药物用量。
1.3.2 样本采集 最后一次给药后,禁食禁水24 h,麻醉豚鼠,右心室取血,离心收集血清后置-80℃冰箱冻存。摘取肾脏,部分-80℃保存,部分4%多聚甲醛固定常温保存。
1.3.3 HE染色观察肾脏组织病理结构变化 取肾组织4%多聚甲醛固定、乙醇梯度脱水、石蜡包埋、切片及苏木素-伊红染色,在光学显微镜下观察正常对照组、模型组及给药组之间肾脏病理学变化。
1.4 ELISA检测豚鼠血清25(OH)D3、Cr、BUN、iNOS、MCP-1水平根据试剂盒说明书操作,在酶标仪450nm处读取吸光值并计算标准曲线回归方程式,求得样品浓度。
1.5 RT-PCR法检测肾脏VDR、24-羟化酶(CYP24A1)mRNA、1α-羟化酶(CYP27B1)的表达
使用TRizol试剂提取肾脏总RNA,并进行逆转录反应。扩增引物由武汉擎科生物科技有限公司合成,引物序列见表1。实时荧光定量PCR扩增条件为:50 ℃预反应2 min,95 ℃ 10 min,95℃ 30 s ,60 ℃ 30 s,40次循环。每个样品设置3个复孔,绘制溶解曲线,以2-△△Ct进行分析样本的相对定量值。

表1 引物序列表
1.6 Westernblot检测肾脏CYP27B1、CYP24A1、p-p38MAPK、p-ERK1/2、VDR蛋白表达提取肾脏组织总蛋白,-20 ℃分装保存。根据标准蛋白浓度和相应的OD值计算直线回归方程,求出样品蛋白浓度。制胶、电泳、转膜,用含5% 脱脂奶粉的TBST室温摇床封闭2 h,加入一抗,4 ℃孵育过夜,清洗后加入二抗,37 ℃摇床孵育2 h,清洗多余二抗,ECL显色,用BandScan分析胶片灰度值。
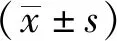
2 结果
2.1 APS对AKI豚鼠肾脏病理学改变的影响如图1所示,正常对照组肾小管清晰可见上皮细胞刷状内缘,上皮细胞排列整齐,肾小球血管网结构清晰。模型组肾小管上皮细胞刷状内缘全部消失,上皮细胞肿胀坏死,空泡变性,近曲小管管腔扩张,不成形,肾小球血管网结构不清晰。APS组、VD组肾脏组织形态较模型组均有一定改善。

注:A:正常组;B:模型组;C:APS组;D:VD组图1 APS对庆大霉素致AKI豚鼠肾脏病理变化的影响(×200)
2.2 APS对AKI豚鼠血清25(OH)D3、Cr、BUN、iNOS、MCP-1水平的影响与正常组比较,模型组豚鼠血清Cr、BUN、MCP-1、iNOS含量显著升高(P<0.01),血清25(OH)D3含量显著下降(P<0.01);与模型组比较,APS组及VD组均可显著提高豚鼠血清25(OH)D3含量(P<0.01),同时二者均可不同程度降低豚鼠血清Cr、BUN、MCP-1、iNOS含量(P<0.05),见图2。

表2 APS对庆大霉素致AKI豚鼠血清25(OH)D3,Cr,BUN,MCP-1和iNOS的影响
2.3 APS对AKI豚鼠肾脏VDR、CYP27B1、CYP24A1mRNA表达的影响与正常组比较,模型组豚鼠肾脏VDR、CYP27B1 mRNA表达量显著下降(P<0.01),CYP24A1表达量显著升高(P<0.01);与模型组比较,APS组及VD组均可显著提高豚鼠肾脏VDR mRNA表达量(P<0.01)、降低CYP24A1 mRNA表达量(P<0.01);同时二者均可不同程度提高豚鼠肾脏CYP27B1 mRNA表达量,以APS组较为显著(P<0.05)。见表3。

表3 APS对庆大霉素致AKI豚鼠肾脏VDR、CYP27B1、CYP24A1 mRNA表达的影响
2.4 APS对AKI豚鼠肾脏VDR、CYP27B1、CYP24A1、p38MAPK、p-p38MAPK、ERK1/2、p-ERK1/2蛋白表达的影响与正常组比较,模型组豚鼠肾脏VDR、CYP27B1 蛋白表达量显著下降(P<0.01),CYP24A1、p-P38MAPK、p-ERK1/2蛋白表达量显著升高(P<0.01);与模型组比较,APS组及VD组均可显著提高豚鼠肾脏VDR 、CYP27B1蛋白表达量(P<0.01),同时二者均可不同程度降低CYP24A1、p-P38MAPK、p-ERK1/2蛋白表达量(P<0.05),APS组对CYP24A1、p-P38MAPK蛋白作用更为显著(P<0.01),VD组对p-ERK1/2蛋白作用更为显著(P<0.01)。见表4,图2。

图2 各组豚鼠VDR、CYP27B1、CYP24A1、p-p38MAPK和p-ERK1/2蛋白表达情况

表4 APS对庆大霉素致AKI豚鼠肾脏VDR、CYP27B1、CYP24A1、p-p38MAPK和p-ERK1/2蛋白表达的影响
3 讨论
庆大霉素为抗菌谱广、疗效可靠、价格低廉且临床应用广泛的抗生素,但因具有肾脏毒性,严重限制其使用范围。虽庆大霉素引起肾毒性早已明确,但其具体的产生机制还有待进一步阐明。庆大霉素对肾脏的毒性作用主要表现为近端肾小管损害,继而导致肾小球滤过功能失常、肾小管上皮细胞坏死等[9]。研究发现[10]炎症反应可能是庆大霉素致AKI的重要因素,庆大霉素可增加炎症因子的分泌,促使白细胞浸润和影响MCP-1的表达,引起功能和结构损伤。此外,iNOS为体内重要的促炎性酶,被激活可产生大量的NO破坏肾脏细胞。本实验结果表明,APS与VD均具有降低AKI豚鼠血清Cr、BUN、MCP-1、iNOS水平并减轻肾脏结构损伤的作用,说明APS与VD能够通过减轻炎症、抑制大量NO的生成,对肾脏细胞的破坏保护庆大霉素诱导的AKI。
MAPK是一组细胞内广泛分布的丝氨酸/苏氨酸蛋白激酶。研究显示[9],MAPK 信号途径参与多种细胞生理过程,如:增殖、分化、凋亡及炎症反应等,与众多疾病的发生发展密切相关。p38MAPK是介导炎症反应的重要细胞内信号传导途径,可被细胞因子与氧化应激激活,使致炎性细胞因子基因的表达上调。研究也发现,p38MAPK与庆大霉素、顺铂等具有肾脏毒性药物引起的AKI关系密切。实验证实,在庆大霉素致AKI的过程中p-p38MAPK的表达水平上升,且使用药物通过抑制p38MAPK与核转录因子kappaB的表达可改善庆大霉素引起的肾损伤[11]。ERK1/2信号通路在细胞增殖、分化、凋亡等过程中起重要作用,ERK的磷酸化级联过程调节多种炎症蛋白基因的表达。通过抑制ERK1/2信号通路可保护H2O2与顺铂导致的肾小管上皮细胞凋亡,并且p-ERK1/2表达水平在缺血再灌注与脂多糖致急性肾损伤后出现迅速升高[12]。本研究显示,APS组与VD组均可下调庆大霉素致AKI豚鼠p-p38MAPK、p-ERK1/2的表达水平,提示APS与VD对庆大霉素诱导豚鼠肾损伤的保护作用与调节p38MAPK、ERK1/2信号通路有关。
研究表明VD为脂溶性物质,是存在于人体的一种类固醇类激素,VD前体在肝脏经27-羟化酶羟基化后转化为25(OH)D3,再经肾脏CYP27B1作用转化为1,25(OH)2D3并与VDR结合发挥其生物学效应,CYP24A1为VD限速酶,可使循环中各种形式的VD灭活[13]。虽然VD的活性成分是1,25(OH)2D3,但目前研究认为25(OH)D3更能准确反应体内VD水平,是评价机体VD的可靠指标。近年来,诸多研究发现VD在各类肾脏疾病发生发展过程中起重要作用,可通过抗炎性反应、抑制肾素-血管紧张素系统、改善肾小管与肾小球间质纤维化等途径达到对肾脏的保护作用[14]。离体实验发现,1,25(OH)2D3可下调肾小管上皮细胞MCP-1的转录。在体实验也显示,利用VD类似物帕立骨化醇干预链脲霉素诱导的糖尿病模型小鼠后可抑制MCP-1的表达、降低MCP-1活性,从而改善肾小球硬化程度[15]。并且在AKI实验模型中,选择性VDR激动剂已被证实对肾损伤具有保护作用[16]。此外,一项针对不同肾损害患者的研究显示,患者尿MCP-1浓度和巨噬细胞浸润程度与1,25(OH)2D3成负相关,临床观察也发现AKI患者体内VD水平较正常人明显降低[17]。本研究结果显示,模型组血清25(OH)D3显著降低,VDR、CYP27B1 mRNA与蛋白表达量显著下降,CYP24A1 mRNA与蛋白表达量显著升高,提示VD水平的降低与庆大霉素致AKI具有一定关系。
现代药理学研究显示,APS具有免疫调节、保护肝肾、抗氧化、抗衰老、抗病毒、抗肿瘤等作用[18]。此外,APS不仅可通过调控p38MAPK信号通路,减轻缺氧复氧肾小管上皮细胞炎症反应,还可通过调节Toll受体4/核转录因子kappaB信号通路,保护缺血再灌注导致的AKI[19]。前期研究也证实APS还可调节小鼠MC-3T3-E1成骨细胞VDR、CYP27B1、CYP24A1 mRNA及蛋白的表达[20]。
综上所述, APS可调节庆大霉素诱导AKI豚鼠模型血清25(OH)D3、肾脏VDR、CYP27B1、CYP24A1 mRNA及蛋白的表达水平。因此推测,APS可能是通过调节VD的表达而影响p38MAPK与ERK1/2信号通路以实现对庆大霉素诱导AKI的保护作用,但其具体分子作用机制需后续进一步研究。

