基于网络药理学探讨山药治疗胃溃疡的作用机制
苗得庆,袁小洁,杨家旺,于晓刚
贵州食品工程职业学院(贵州 清镇 551400)
胃溃疡(Gastric Ulcer,GU)是一种常见的消化性溃疡,主要是指幽门螺杆菌(Helicobacter pylori,Hp)感染和长期服用非甾体消炎药(Nonsteroidal Antiinflammatory Drugs,NSAIDs)后引起消化液损伤胃黏膜的病变[1]。患者临床症状主要表现为胃部疼痛、食欲不振、胃胀、饱腹感或体质量减轻,严重者可导致胃出血和胃穿孔等并发症[2]。流行病学调查显示,GU的发病率为10%左右,癌变率约1%~3%,临床常采用抑酸、抗Hp、保护胃黏膜的方法给予治疗,但存在高复发的风险,严重降低患者的生活质量[3]。值得注意的是,中医药在治疗GU方面疗效显著,可显著降低患者复发的风险和并发症的发生率[4]。
中医学认为GU属于“胃脘痛”“呕吐”“痞满”等范畴。《黄帝内经》首次提及“胃脘痛”病名,认为其病机为胃阴受损,胃失濡养或脾阳不足,胃失温养[5]。山药(Chinese Yam)首载于《神农本草经》,为薯蓣块茎属药食同源的中药,性温,味甘,药效平和,无毒,具有补脾养胃、生津益肺、补肾涩精等功效,可用于治疗胃痛、腹痛、反酸、泄泻等脾胃病。现代药理学研究发现[6],山药及其提取物具有保护胃黏膜、抗氧化、调节免疫反应、调控肠道菌群的作用。山药提取物可通过降低GU小鼠血清中丙二醛(Malondialdehyde,MDA)、一氧化氮(Nitric Oxide,NO)含量,升高超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)的水平,从而发挥保护胃黏膜的功能[7-8]。
网络药理学是集系统生物学和药理学为一体的综合学科,主要通过构建化学成分-靶点、化学成分-疾病-靶点等网络,寻找发挥关键作用的化学成分和靶点[9]。分子对接是一种模拟小分子与生物大分子结合强度的计算方法,将助力于预测化学成分与靶点之间的相互作用关系[10]。因此,本研究基于网络药理学和分子对接探讨山药治疗GU的关键化学成分、靶点和信号通路,以期为阐明山药治疗GU的作用机制提供理论依据。
1 材料与方法
1.1数据库及软件本研究使用数据库包括TCMSP数据(http://tcmspw.com/tcmsp.php)、Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov)、Swiss Target Prediction 数据库(http://www.Swisstarget prediction.ch)、Uniprot数据库(https://www.uniprot.org/)、DisGeNET数据库(https://www.disgenet.org/)、OMIM数据库(https://omim.org/)、Malacard数据库(https://www.malacards.org/)、String数据库(https://string-db.org/)及DAVID 数据库(https://david.ncifcrf.gov/home.jsp),软件主要涉及Cytoscape V3.7.2软件、R软件、perl软件。
1.2山药化学成分筛选及靶点收集在中药系统药理学数据库和分析平台(TCMSP)以口服生物利用度(OB)≥30%和类药性(DL)≥0.18筛选山药的化学成分及靶点。借助Pubchem数据库和Swiss Target Prediction数据库补充预测靶点,在Pubchem数据库获取化合成分的Canonical SMILES序列[11],将其导入Swiss Target Prediction数据库寻找靶点,保留排名前15位的作用靶点[12]。采用Uniprot数据库对筛选后的靶点进行名称标准化[13]。
1.3山药化学成分治疗GU的靶点网络构建通过DisGeNET数据库、OMIM数据库和Malacard数据库以“Gastric ulcer”为关键词,检索GU的作用靶点[14]。使用R语言VennDiagram包绘制山药治疗GU的靶点Venn图,并通过Cytoscape V3.7.2软件构建化学成分-GU-靶点网络。
1.4蛋白互作网络(PPI)构建在String数据库中选定“Homo sapiens”及“medium confidence=0.15”进行构建山药治疗GU的PPI[15]。通过Cytoscape V3.7.2软件中“Network Analysis”功能模块获取网络拓扑参数,以度值(degree)筛选关键节点。
1.5生物学功能和通路分析利用DAVID数据库对山药治疗GU的靶点进行基因本体(GO)功能和基因组百科全书(KEGG)通路分析,并设定物种为“Homo sapiens”[16]。借助R语言gplot2包对GO功能和KEGG通路结果可视化。
2 结果
2.1山药化学成分筛选及靶点收集结果在TCMSP数据库中获得16个山药化学成分。经PubChem数据库和Swiss Target Prediction数据库补充后发现Methylcimicifugoside_qt无预测靶点,故将其删除。综合以上数据库发现剩余15个化学成分和118个靶点,并利用Cytoscape V3.7.2软件绘制山药化学成分-靶点网络图,如图1所示。图中包括237条边和133个节点,其中133个节点由15个化学成分(绿色圆形)和118个靶点(橙红色六边形)组成。
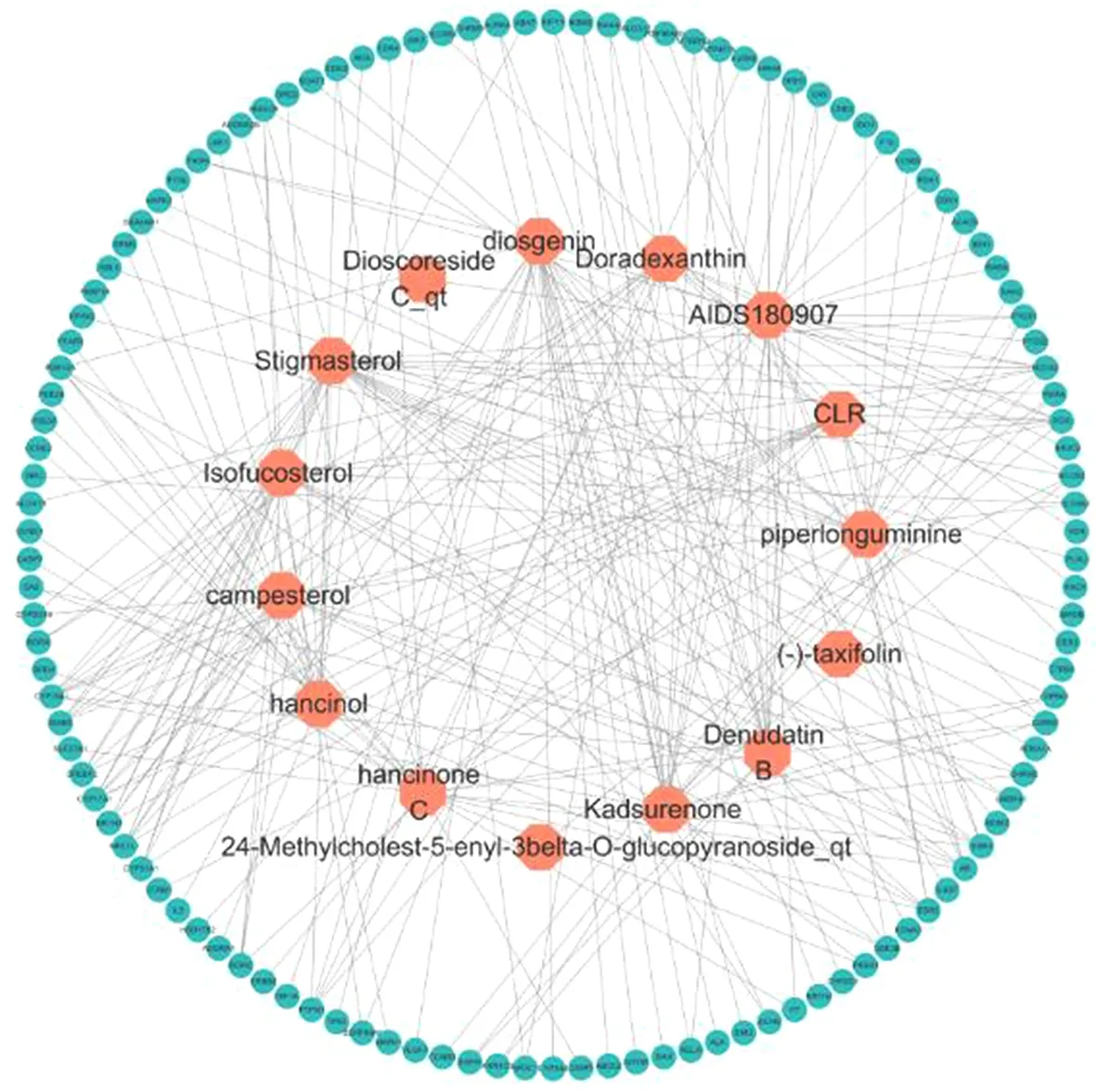
图1 山药化学成分-靶点网络图
2.2山药化学成分治疗GU的靶点网络通过TDisGeNET、OMIM、Malacard数据库共获取213个GU相关靶点。利用R语言VennDiagram包得到13个山药化学成分治疗GU的相关靶点,如图2所示。

图2 山药化学成分治疗GU的相关靶点韦恩图
使用Cytoscape V3.7.2 软件进一步构建山药化学成分-GU-靶点网络图,如图3所示。图中,涉及24个节点和31条边,24个节点由10个化学成分(绿色三角形)、13个靶点(紫色圆形)、1个疾病组成(粉色六边形)。通过Network Analysis功能模块对网络图进行分析,关键化学成分节点的拓扑参数,见表1。

图3 山药化学成分-GU-靶点网络图
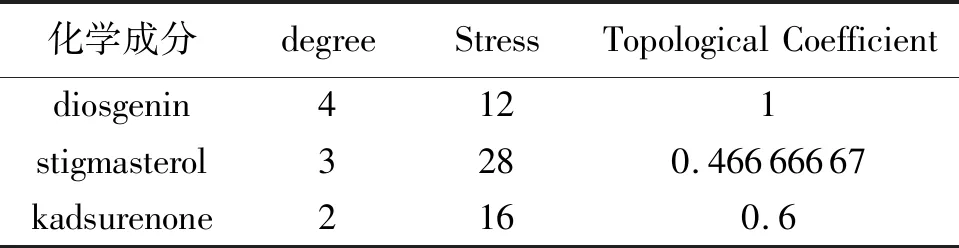
表1 山药化学成分-GU-靶点中degree值较高的关键化学成分
2.3蛋白互作网络(PPI)构建结果在String数据库中获得山药治疗GU的PPI网络,并利用Cytoscape V3.7.2 软件进一步可视化,如图4所示。PPI网络图包含13个靶点和60条边,靶点越大和颜色越蓝表示相应靶点的degree值越高。PPI网络的拓扑参数,见表2。

图4 山药治疗GU靶点的PPI 网络
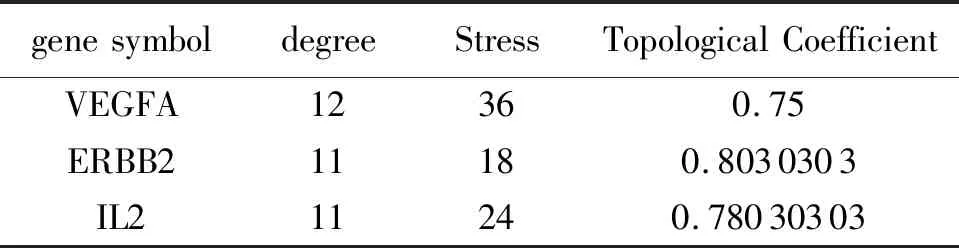
表2 PPI关键靶点及拓扑参数
2.4生物学功能和通路分析结果通过DAVID数据库对山药治疗GU的相关靶点进行GO功能和KEGG分析。GO功能分析结果发现13个靶点涉及483个富集结果(P<0.05),主要涉及不饱和脂肪酸代谢、细胞增殖调节、免疫系统发育、MAP激酶活性等。KEGG分析结果发现13个靶点参与39条信号通路过程(P<0.05),主要涉及HIF-1、VEGF 信号通路、TNF 信号通路等。本研究按照P值大小筛选排名前20位的GO功能柱状图和KEGG信号通路图展示,如图5、图6所示。

图5 山药治疗GU的GO功能柱状图
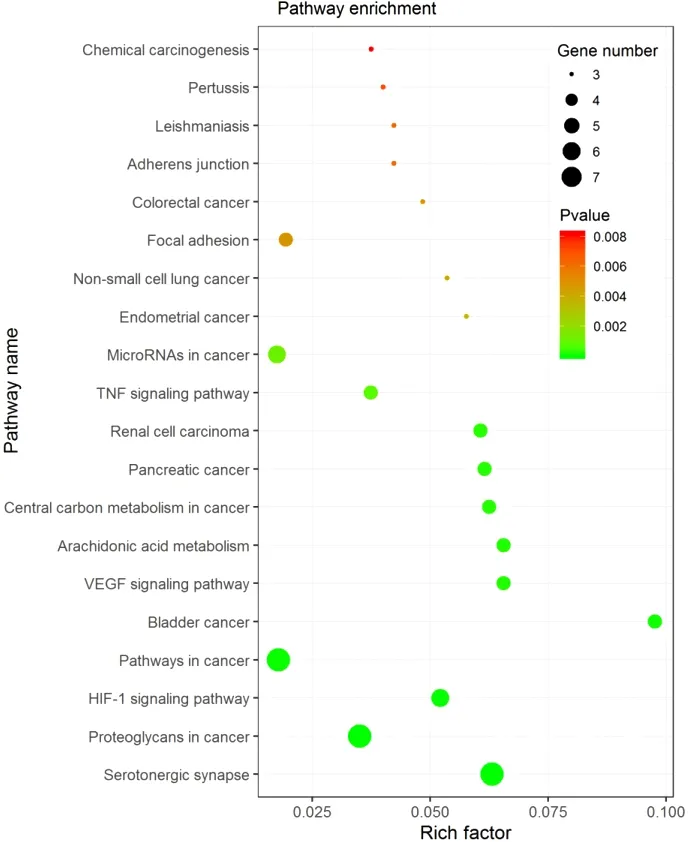
图6 山药治疗GU的KEGG通路气泡图
3 讨论
从山药化学成分-GU-靶点网络中发现degree值较高的化学成分为薯蓣皂苷元(diosgenin)、豆甾醇(stigmasterol)、海风藤酮(kadsurenone)等。薯蓣皂苷元是一种天然甾体皂苷,具有抗炎、抗氧化和抗肿瘤的作用,能够诱导胃癌细胞凋亡、周期停滞和DNA损伤[17]。豆甾醇属植物甾醇,富含于大量蔬菜和水果中,可激活膜结合酶的活性和细胞膜的流动性,进而发挥保护胃黏膜的作用[18]。海风藤酮是天然药物化学成分,对胰腺炎、GU等消化系统疾病有一定的调节作用,其不仅能够有效抑制钙离子内流,还可清除氧自由基,降低血清SOD含量,升高血清MDA水平,进而改变胰腺炎模型大鼠的病理损伤情况[19]。
PPI网络分析提示,山药治疗GU与VEGFA、ERBB2、IL2等基因关系最为密切。研究发现血管生成是GU愈合的重要因素,血管内皮生长因子(VEGF)作为一种重要的血管生成因子,可从血小板中释放到溃疡基底部进而加速溃疡的愈合[20]。GU患者治疗不及时会诱发癌变的风险,人类表皮生长因子2(ERBB2)能够编码酪氨酸激酶活性的跨膜蛋白,加速促进癌细胞生长和分化,对胃癌患者的诊断和预后具有一定临床意义[21]。胃黏膜感染幽门螺杆菌能够促进炎细胞因子IL-2的释放,IL-2与其受体结合可激活丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3激酶(PI3K)信号传导,进而诱导胃部炎症反应的发生,加重胃黏膜的损伤程度[22]。
GO功能和KEGG通路富集分析表明,不饱和脂肪酸代谢、细胞增殖调节、免疫系统发育、MAP激酶活性等生物学过程和HIF-1、VEGF、TNF等信号通路在山药治疗GU过程中发挥重要作用。富含不饱和脂肪酸的食物对GU模型小鼠体内氧化应激和免疫反应起一定调控作用,能够升高机体内过氧化氢酶(CAT)、GSH-Px等氧化应激指标的含量,降低小鼠血清IL-6、IL-12、TNF-α、IFN-γ 等炎症因子的水平,还可通过增加VEGF水平缩小溃疡面积[23]。MAP激酶在调节细胞增殖,分化和凋亡的蛋白激酶级联反应中被激活,活性MAP激酶可促进胃黏膜上皮细胞生长,使GU逐渐愈合[24]。胃癌患者血清中的缺氧诱导因子1α(HIF-1α)多呈现出高表达状态,可通过调节PI3K / AKT信号通路和VEGF信号通路达到抑制胃癌细胞的增殖、迁移和侵袭的目的[25]。TNF-α与GU的面积存在高度关联性,其可通过参与全身炎症反应和细胞凋亡等过程,加重胃黏膜损伤程度。
综上所述,本研究利用网络药理学初步研究了山药治疗GU的药理分子作用机制,推测其活性成分与不饱和脂肪酸代谢、细胞增殖调节、免疫系统发育、MAP激酶活性等生物学过程及HIF-1、VEGF、TNF等信号通路密切相关,为后续研究提供了新的思路。然而,现阶段网络药理学研究存在中药化学数据库、疾病靶点数据库更新延迟的现象,且对于非关键化学成分和靶点的药理作用容易被遗漏。因此,山药能否通过以上化学成分和生物学过程发挥治疗GU的作用,还需大量的临床和动物试验来进一步验证。

