体外膜肺氧合患者真菌感染诊断和治疗的研究进展
王玉敏,柳亚敏,邵华
(1. 东南大学 医学院,江苏 南京 210009; 2. 东南大学附属中大医院 药学部, 江苏 南京 210009)
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是具有部分心肺替代功能的体外循环技术,用于传统治疗失败的严重呼吸衰竭、心脏衰竭或心脏移植患者的辅助治疗[1]。世界卫生组织临时指南建议,为符合条件的与2019年新型冠状病毒(COVID-19)相关的急性呼吸窘迫综合征(ARDS)患者提供ECMO治疗[2]。ECMO患者常常使用广谱抗生素,加之自身重大疾病和侵入性导管的使用,其免疫系统易受到损害,增加了真菌感染和定植的风险[3]。有关报道称,高达15%的血流感染是真菌来源[4],其中念珠菌和曲霉菌是最常见的分离真菌。本文作者通过调研近年来国内外有关文献报道,从ECMO对抗真菌药物药代动力学(PK)的影响以及ECMO患者真菌感染的诊断和治疗等方面进行综述,为ECMO患者的抗真菌感染治疗提供参考。
1 ECMO对抗真菌药物PK的影响
ECMO影响抗真菌药物PK的主要机制为ECMO环路对药物的吸附作用、增加药物表观分布容积以及减少药物消除等[5]。亲脂性药物和高蛋白结合率的药物(伏立康唑、芬太尼)在环路中吸附作用显著,亲水性药物(β-内酰胺抗生素、糖肽)则主要受到ECMO期间发生的血液稀释和其他病理生理学改变的影响。治疗过程中ECMO患者的抗真菌药物治疗剂量需要基于标准给药剂量和个体化PK数据[6- 11]进行调整(表1)。
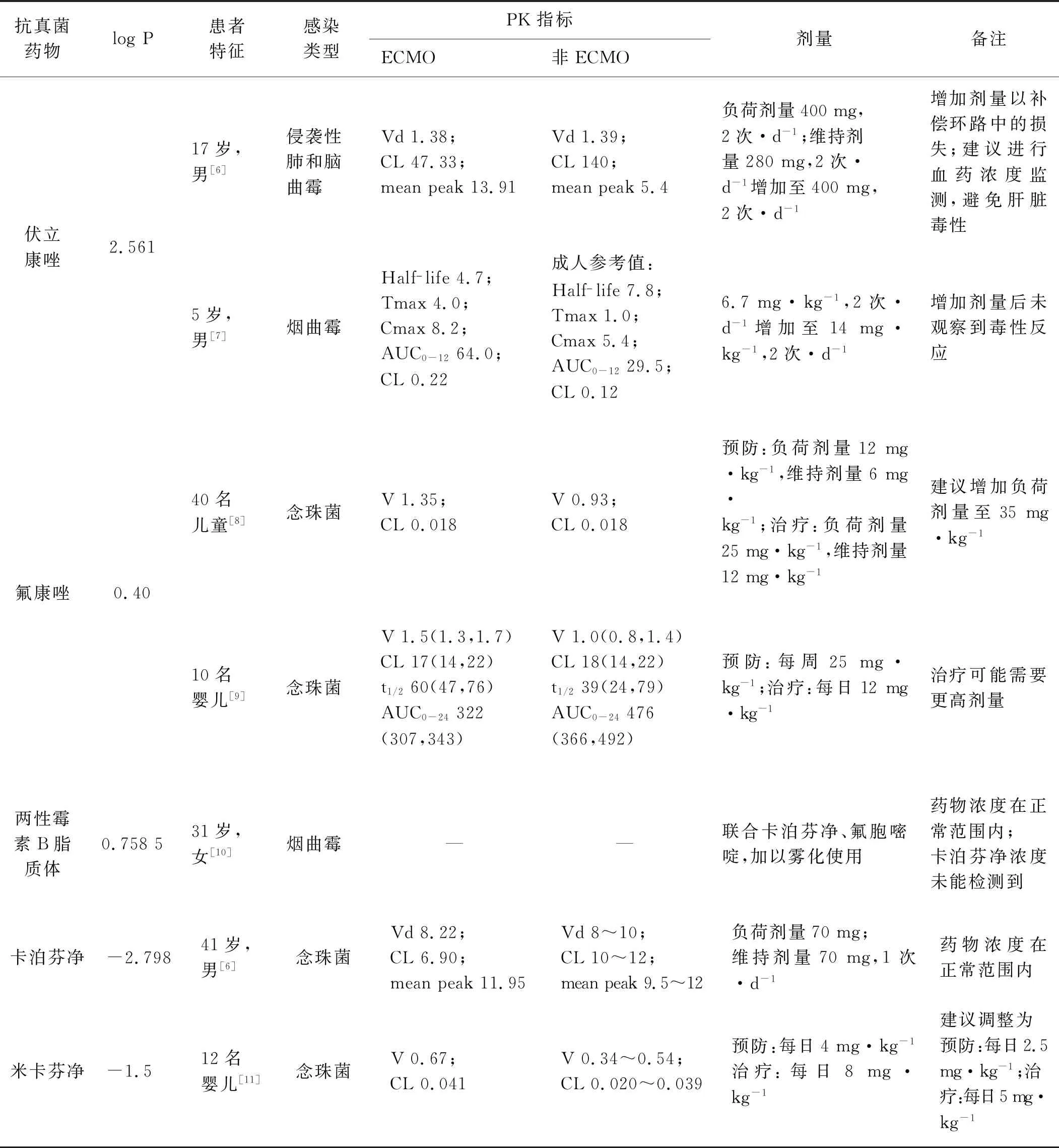
表1 ECMO对抗真菌药物PK的影响及药物剂量调整
药物的理化性质、环路装置以及重大疾病等均会改变ECMO患者使用药物的PK,但其改变程度难以量化。随着全球对于ECMO资源需求的增加[12],需要更多的体外环路模型、ECMO动物模型和临床群体PK等系统性研究来优化药物治疗[13]。以后的研究重点应关注抗真菌药物的选择,制定最合适的给药方案,以及开发对PK影响最小的ECMO环路等方面。
2 ECMO患者抗真菌感染的困难及争议
2.1 真菌感染的“诊断难”
特异性临床体征和实验室检测方法的缺乏,均使得对真菌感染的诊断十分困难。真菌感染常常表现为典型的临床感染体征,如发热或白细胞计数升高等,均是非特异性的,其诊断仍然依赖于培养技术[14],且获得阳性结果往往需要耗费很长时间。欧洲癌症研究与治疗组织和肿瘤学研究组(EORTC/MSG)提出适用于危重患者的修订标准,Aubron 等[15]使用此标准回顾性诊断曲霉菌感染或定植,强调了在接受ECMO的危重患者中确诊曲霉病的困难。此外,难以获取和保存活体组织标本也是真菌感染诊断困难的另一重要原因。有研究报道1例心脏移植继发真菌感染的ECMO患者[16],其计算机断层扫描的结果显示播散性曲霉病伴有肺部和脑部病变。但由于该患者全身抗凝的情况所限,当时并未能对病变的活体组织进一步检查鉴定。
然而,ECMO患者感染的早期诊断与改善治疗结果密切相关,准确快速的早期诊断具有重要意义[17]。因此亟待开发快速、有效的微生物检测方法,以期尽早对致病微生物的类型及其药物敏感性作出正确的判断。
2.2 真菌感染的“治疗难”
相较于常见的念珠菌和曲霉菌感染,其他的真菌感染(如接合菌、丝孢菌属感染)在ECMO患者中虽然少见,但是常因耐药等原因造成治疗困难,甚至危及患者生命,这对抗真菌感染治疗和新药物的研发提出了很大的挑战。
Sander 等[18]报道了1例ARDS的ECMO成人患者,两性霉素B和氟胞嘧啶抗真菌治疗无效,患者死于败血症和多器官衰竭。尸检发现患者的肝脏含有真菌,腹水培养有尖孢镰刀菌。
丝孢菌属对大多数抗真菌药物高度耐药,其感染常发生于免疫功能低下的患者。然而,Al-jehani等[19]报道了1例免疫功能正常的患者,ECMO支持治疗后继发脑脓肿。使用卡泊芬净进行经验性治疗,随后因诊断为丝孢菌属感染改用伏立康唑。尽管行减压颅骨切除术以缓解患者颅内压,并且抗真菌治疗及时,但在这种侵袭性感染中患者依旧无法存活。
侵袭性曲霉病(IA)是实体器官移植后期的严重并发症之一,据Eschertzhuber等[20]报道,1例心脏移植的女性患者使用ECMO和右心室辅助装置(RVAD)后感染曲霉菌,卡泊芬净抗真菌治疗无效(分离的曲霉菌株表现出对卡泊芬净的体外抗性),患者情况恶化,改用伏立康唑并加用两性霉素B脂质体,但最终患者因严重感染性休克和多器官功能衰竭死亡。
2.3 抗真菌药物预防性用药的争议
Kao等[21]研究抗菌药物预防和感染监测,根据其调查的多机构数据显示,大部分的体外生命支持组织(ELSO)(74%,97/132)使用抗生素预防感染,只有少数中心(2%,2/132)系统地使用抗真菌药物预防感染,且通常仅针对有真菌感染经典危险因素的ECMO人群。相关文献报道,ECMO过程中的感染会增加死亡率,预防性抗真菌药物对患者来说可能是有益的[22]。但是目前ELSO并不推荐抗真菌药物预防性治疗的做法,也尚未在ECMO患者中专门提出其他预防措施[23],是否应该使用以及如何使用预防性抗真菌药物有待进一步研究。
2.3.1 氟康唑 Gardner等[22]将接受氟康唑预防定义为“没有确定预先存在的真菌感染并且在ECMO支持的前24 h内开始静脉氟康唑治疗”,筛选了261例ECMO支持的儿科心脏病患者作为研究对象。该研究表明,真菌感染可能增加需要ECMO支持的心脏病患者的住院死亡率,常规氟康唑预防与患者的真菌感染率较低相关。在ECMO患者侵袭性念珠菌病的相关研究中,根据成人暴露剂量,建议ECMO儿童[8]氟康唑的预防剂量为:负荷剂量12 mg·kg-1,维持剂量6 mg·kg-1。ECMO婴儿[9]与非ECMO婴儿相比具有更高的分布容积和相似的清除率,建议25 mg·kg-1的氟康唑剂量用以预防念珠菌感染。
2.3.2 卡泊芬净 Tissot 等[24]对侵袭性真菌感染(IFI)高危人群进行卡泊芬净预防性治疗,并对与IFI相关的危险因素进行回归分析。研究发现,抗真菌药物预防性治疗与90 d IFI发生率和30 d死亡率的降低相关,加之对于心脏移植患者而言,ECMO是IFI的重要危险因素之一,因此认为可能需要在移植患者使用ECMO后立即进行抗真菌药物预防性治疗。
2.3.3 米卡芬净 米卡芬净分布容积较大,Autmizguine 等[11]为表征米卡芬净PK和ECMO婴儿的安全性,将治疗目标定义为“Ⅲ期临床试验中与有效性相关的成人暴露”,并将预防目标定义为治疗目标的一半,建议分别给予5和2.5 mg·kg-1·d-1米卡芬净用于侵袭性念珠菌病的治疗和预防。
3 展 望
3.1 生物标志物在真菌感染辅助诊断中的应用
降钙素原(PCT)浓度反映感染的严重程度,可用于指导在抗感染治疗时抗生素的种类选择和持续治疗时间等[25]。Pieri等[26]用PCT和传统生物标志物C-反应蛋白(CRP)联合检测微生物,检测灵敏度为87.2%,特异度为25.9%,有助于辅助诊断V-A ECMO患者的感染。研究发现,可溶性髓样细胞触发受体1(sTREM-1)、可溶性单核巨噬细胞血红蛋白清道夫受体(sCD163)等几种生物标志物的表达对兔白色念珠菌肺炎[27]的早期诊断和预后评估有一定价值。半乳甘露聚糖作为临床标志物可以辅助诊断曲霉病[28]。此外,1,3-β-D-葡聚糖作为特异性生物标志物也在IFI的诊断中发挥作用[29]。
3.2 新型微生物鉴定方法
Perez 等[30]将电离质谱法检测与抗菌药物管理相整合,改善了常规实验室检测方法的可选性,并使患者住院时间缩短,住院费用降低。Kuehn 等[31]用聚合酶链式反应(PCR)检测20例ECMO患者的氧合器(MOs)的潜在微生物定植,MOs的检测结果为革兰阳性菌、革兰阴性菌和真菌分别占71%、22%和7%,初步验证PCR是检测MOs微生物定植的有效方法。Laffler 等[32]通过PCR扩增结合电喷雾电离质谱(PCR-ESI-MS)直接分析血液样本,可快速检测细菌和酵母菌等,并且与血培养的检测结果有78.6%的一致性。当与血培养结合使用时,PCR-ESI-MS通过缩短测试周转时间和提高检测产量,从而更好地用于对败血症的诊断。
3.3 三唑类新型抗真菌药
3.3.1 泊沙康唑 泊沙康唑[33]具有抗念珠菌属、曲霉属、新型隐球菌、接合菌和其他真菌病原体的广谱活性,常用于侵袭性曲霉病的二线治疗。多项研究表明,与氟康唑等其他抗真菌药物相比,泊沙康唑可以显著降低IFI(尤其是侵袭性曲霉病)的发生率[34]。Pate等[35]报道了1例肝移植术后的男性ECMO患者,根据成像及支气管镜灌洗结果诊断为布朗氏帚霉菌感染,使用泊沙康唑和特比萘芬抗真菌治疗后康复,证明了其根除感染的有效作用。接合菌侵袭血管,易在腔内形成血栓并引起局部组织坏死。Charles 等[36]报道了1例因结核性压塞引流导致心肌衰竭而接受V-A ECMO的女性患者,联合两性霉素B脂质体和泊沙康唑进行抗真菌治疗,密切监测药物浓度,在长达15个月的治疗后取得了较好疗效。
3.3.2 艾沙康唑 艾沙康唑的抗真菌谱包括假丝酵母属、非白色念珠菌、曲霉菌属和毛霉属。有关的群体PK研究[37- 38]表明,轻、中和重度肾损害不影响艾沙康唑的PK,而轻度和中度肝功能损害患者的药物谷浓度显著增加。尚未查阅到ECMO对艾沙康唑PK影响的相关文献报道。
3.3.3 拉夫康唑 拉夫康唑也是三唑类的新型抗真菌药物,通常认为是杀真菌剂,结构上更类似于氟康唑和伏立康唑,目前尚未被FDA批准使用[39]。
4 小 结
真菌感染是危重患者ECMO治疗期间的并发症之一,但是关于ECMO期间抗真菌药物PK、预防及治疗的研究很少,且通常是个案报道,无法为该患者群提供可靠的给药方案依据,整体呈现“诊断难、治疗难”的特点。
近年来,生物标志物的应用和临床实验室检测技术的不断发展,为真菌感染的诊断提供了有效辅助手段,但仍需开发更为快速有效的方法,以期在早期诊断中发挥重要作用。此外,为缓解真菌耐药性的压力,抗真菌药物也在加速研发,药物种类和安全性的增加扩大了临床抗真菌感染治疗的选择范围,但是由于ECMO对药物PK的改变难以量化、预防及治疗的实践经验不够充分等现状,ECMO抗真菌感染的进一步研究任重而道远。只有不断研究探索,制定和优化抗真菌药物给药方案,才能使更多ECMO患者受益。

