南京地区无偿献血人群HTLV感染状况分析
蔡丽娜,陈慧,朱绍汶,周静宇,陈新,李世林,陈宝安
(1.江苏省血液中心 献血服务科,江苏 南京 210042;2.江苏省血液中心 检验科,江苏 南京 210042;3.江苏省血液中心 质量管理科, 江苏 南京 210042;4. 中国医学科学院输血研究所,四川 成都 610052;5.东南大学附属中大医院 血液科,江苏 南京 210009)
人类嗜T淋巴细胞病毒(human T-cell lymphotropic virus,HTLV)是致瘤性RNA病毒,属慢病毒亚科,可分为HTLV-Ⅰ和HTLV-Ⅱ两型。我国 HTLV-Ⅰ流行主要集中在福建、广东、浙江等东南沿海地区。近年来 HTLV 感染率调查表明,广东、福建等东南沿海地区存在小范围流行[1],厦门是 HTLV 的流行区[2],河南、湖北等也有相关案例报道[3],HTLV 有向非流行区蔓延的趋势[4]。2003年南京地区无偿献血抽样中有5例感染案例[5],但无相关确认感染报道[6]。由于南京地区人口流动性较大,目前仍没有把HTLV筛查作为常规筛查项目,对南京地区无偿献血人群进行HTLV筛查有助于了解当地的病毒感染流行情况,为血液安全提供数据支持。
1 资料与方法
1.1 一般资料
随机选取2016—2019年江苏省血液中心无偿献血者血液样本100 172例,献血者年龄18~55岁;所有无偿献血者均符合我国GB18467-2011《献血者健康检查要求》的规定,主要在街头(固定/流动)献血车/屋、团体献血和站内献血。按照《血站技术操作规程(2015版)》的要求留取标本,采用5 ml EDTA-K2真空管采集血样,标本采集后置于2~8 ℃冰箱储存。
1.2 主要试剂
HTLV-Ⅰ/Ⅱ抗体检测试剂盒(北京万泰公司,批号T20160101、T20170401、T20180302B、T20190503B),美国MP HTLV Blot 2.4 蛋白印迹检测试剂盒,HTLV核酸检测试剂为卫生部临检中心自建试剂。以上试剂均在有效期内使用。
1.3 仪器
MICROLAS STAR 8CH全自动加样仪(瑞士Hamilton公司);FAME24/30全自动酶免仪(瑞士Hamilton公司)。
1.4 检测方法
1.4.1 HTLV-Ⅰ/Ⅱ抗体ELISA法初筛 随机选取当天的献血者标本,用ELISA法进行HTLV-Ⅰ/Ⅱ抗体筛查。根据说明书要求,标本OD值≥诊断界值者为HTLV抗体阳性,标本OD值<诊断界值者为HTLV抗体阴性。初筛呈反应性标本须进行双孔复试,复试至少1孔为阳性则判断为HTLV抗体检测阳性。
1.4.2 蛋白免疫印迹(WB)/核酸检测实验(NAT)确证 留取抗-HTLV初筛阳性标本血浆和白膜层。将已经进行ELISA法检测的血浆标本再次离心(3 000 r·min-1,10 min),吸取血浆至螺口冻存管中,放入-20 ℃以下冰箱保存;吸取白膜层至离心管中,放入-20 ℃以下冰箱保存。将上述血浆与白膜层标本在2~10 ℃条件下运送至国家卫健委临检中心确证实验室,WB实验和NAT两种方法同时进行确证。WB实验用血浆检测HTLV-Ⅰ/Ⅱ;NAT用白膜层提取基因组DNA,采用实时荧光PCR方法检测HTLV-Ⅰ/Ⅱ基因。任一方法结果为阳性即判为HTLV-Ⅰ/Ⅱ阳性,该献血者为确证感染者;如两种方法均为阴性,则结果判为HTLV-Ⅰ/Ⅱ阴性。
1.5 统计学处理
使用SPSS 20.0统计软件对结果进行统计分析,采用χ2检验对2016—2019年4个年度的HTLV-Ⅰ/Ⅱ初筛阳性率进行比较,P<0.05为差异有统计学意义。
2 结 果
2.1 ELISA初筛结果
100 172例献血者样本中12例ELISA抗-HTLV呈反应性,初筛阳性率为0.012%。 2016—2019年4个年度HTLV-Ⅰ/Ⅱ初筛阳性率的差异无统计学意义(χ2=3.199,P>0.05)。见表1。

表1 2016—2019年HTLV- Ⅰ/Ⅱ 初筛结果
2.2 WB/NAT确证结果
2016、2017、2019年初筛呈反应性献血者标本WB/NAT确认结果均为阴性,确证感染率为0(表2);其中2017年有1例初筛呈反应性献血者标本合并乙肝表面抗原ELISA双边阳性,系统已锁定该献血者为终身屏蔽献血状态。2018年有1例标本WB确证结果呈不确定,且合并梅毒螺旋体抗体ELISA双边阳性,该献血者当时献血年龄为23岁,考虑可能为性传播,遗憾的是后来多次随访失败,献血者拒绝提供医院的化验报告,也拒绝采样,后续试验无法跟进,系统已锁定该献血者为终身屏蔽献血状态。
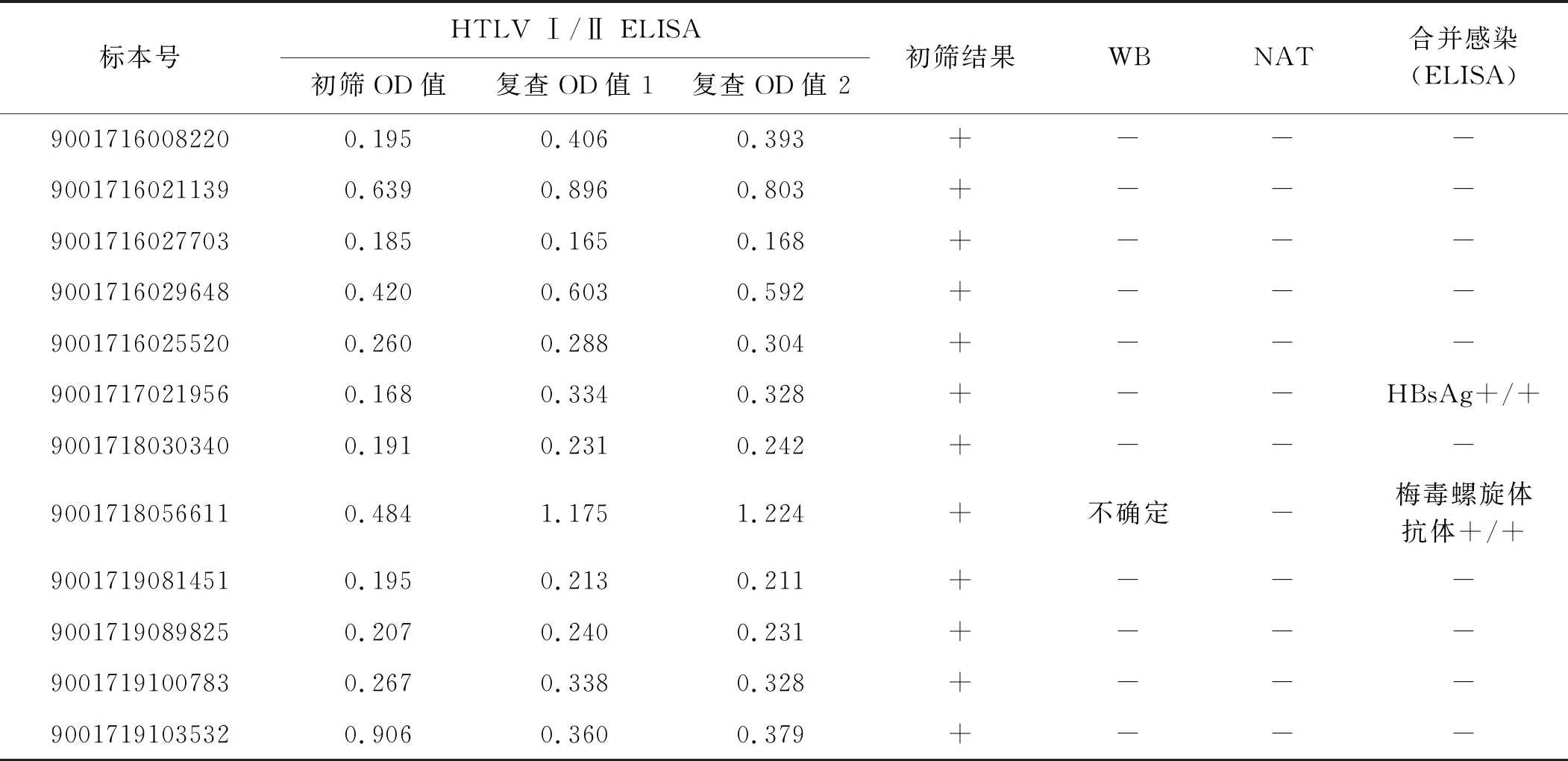
表2 HTLV Ⅰ/Ⅱ初筛阳性标本确证结果
3 讨 论
HTLV-Ⅰ是以严格的细胞-细胞形式进行传播的,游离的病毒颗粒几乎不能感染细胞,HTLV-Ⅰ在体内主要感染CD4+T细胞。HTLV-Ⅱ的传播途径主要是性传播、母婴传播、输血及静脉注射共用针头等。输血是HTLV-Ⅰ/Ⅱ的重要传播途径。如血液成分储存时间超过10 d将大大降低HTLV-Ⅰ/Ⅱ的感染几率。研究表明,成人T淋巴细胞白血病(ATL)是一种与HTLV-Ⅰ感染直接相关的疾病[7- 8]。
HTLV高流行区主要分布在日本西南部、非洲、加勒比地区、南美等地,日本、美国、加拿大、巴西和一些欧洲国家早就开始对献血者进行HTLV-Ⅰ/Ⅱ抗体筛查[9],有效降低了HTLV经输血传播的风险。美国1988年将HTLV-Ⅰ列入献血者常规筛查项目, HTLV输血传播的风险性在实施筛查前为0.025%,在实施筛查后降为0.001 6%[10]。法国和荷兰分别在1991年和1993年相继对所有的献血者实施HTLV筛查[11- 12]。
大量的流行病学调查发现,我国局部地区存在HTLV感染,尤其是福建东南沿海地区,宁德献血者的HTLV确认阳性率为0.34%[13],莆田献血者的HTLV确认阳性率为0.101%[14]。2016年有报道,福建、广州、浙江、北京、山东、吉林、湖南、广西、江苏等地区均有检测出抗-HTLV确证阳性的献血者[15]。2018年珠三角地区献血者中总HTLV感染率为0.001 2%[16]。目前,我国福建地区已经对献血者进行HTLV常规筛查。近些年来,通过对我国部分HTLV确证阳性的血液进行核苷酸序列测定和系统进化树分析,积累了一些分子生物学资料,证实了中国内陆地区HTLV-Ⅰ C亚型的存在。我们对南京地区2016—2019年4个年度无偿献血者随机抽样筛查,只发现1例确证试验结果为不确定的标本,但并不能说明南京地区就不存在HTLV的感染者,只能说明南京地区目前属于HTLV非流行区或低流行区[6]。鉴于南京地区经济发达、人群密集、流动人口多,后续有必要继续对献血者进行HTLV筛查,扩大筛查范围和筛查力度,确保临床用血安全。目前,南京地区临床用血已全部采用滤白血液制剂,同时还对血浆进行病毒灭活,最大程度降低了输血传播病毒的风险。另外,还要加强对市民的HTLV知识科普,加强献血者献血前的征询工作,可以更有效地降低输血传播HTLV的风险。

