基于气相-离子迁移谱对竹燕窝菌汤风味成分的分析
杨 芳,杨 莉,张振宇,肖 岚,秦 涛,贾洪锋,*
(1.四川旅游学院食品学院,四川成都 610100;2.四川旅游学院烹饪学院,四川成都 610100)
竹燕窝(Bamboo bird’s nest)是一种非常珍稀的非繁殖性原生食用真菌,又名竹菌、竹菇、竹蓐[1],是在气候适宜、水分充足、无污染的条件下生长的纯天然真菌,且仅在仲秋季节生长在有虫寄生的竹枝或土壤上。竹燕窝的主要化学成分为蛋白质、脂肪和人体必需的六种氨基酸。竹燕窝的形与味均如燕窝,口感润滑、清香,集鲜、嫩、脆、爽于一身,营养价值甚高,因此被誉为“植物燕窝”。竹燕窝的生长对生态环境的要求极高,产量非常有限,摘采复杂,生长周期短暂,并且不能进行人工培育。目前,已有研究表明:竹燕窝或其提取物具有抗菌消炎[2]、抗癌[3]等作用,具有极高的药用价值。国内对竹燕窝的研究主要集中在生长规律观察[4]、显微结构和金属成分分析[5]及调味品方面[6];而国外尚无报道。
食品中挥发性风味成分主要包括:醇类、酯类、醛类、酮类、杂环类等物质[7],通过鼻腔上部的嗅觉上皮细胞感知,挥发性风味是刺激鼻腔内的嗅觉神经细胞而在中枢引起的一种感觉[8],是食品香气(Aroma)的来源[9]。气相-离子迁移谱(Gas Chromatograph-Ion Mobility Spectrometer,GC-IMS)是近年来出现的一种新型气相分离和检测技术[10],该项技术整合了GC-IMS在分离和检测方面的优势,形成具有样品制备简单、灵敏度高、高分辨率、操作简便、分析高效等特点,特别适合于一些挥发性有机化合物(VOCs)的痕量检测。GC-IMS的应用近年来发展迅速[11]。如:菌类风味检测[12-13];通过检测分析植物油VOCs的变化,进行植物油掺假[14]等研究;酒类VOCs的差别进行酒类产地识别[15]、酒类发酵行为[16]及发酵过程中风味变化[17]等研究;肉蛋制品新鲜度[18]等研究;调味品风味检测分析[19];果蔬及果蔬制品在储藏等过程中的风味检测分析[20],等。
目前,尚无竹燕窝菌汤风味成分的研究报道,本研究可弥补这一空白。本研究在前期对微波、电压力锅、电磁炉3种熬制工艺优化的基础上,分别以3种熬制的最佳工艺熬制的竹燕窝菌汤为试验对象,采用氨基酸自动分析仪和气相色谱-离子迁移谱(GC-IMS)联用仪,根据相对气味活度值(ROAV)和主成分分析法(PCA)对竹燕窝菌汤的风味进行分析,探究不同熬制方式对风味成分变化的影响规律,以期为竹燕窝资源的进一步开发利用提供参考依据。
1 材料与方法
1.1 材料与仪器
冰鲜竹燕窝 采购于四川宜宾;蒸馏水 自制。
日立L-8800型全自动氨基酸分析仪 日本日立公司;FlavourSpec®食品风味分析仪 (含CTC自动顶空进样器、Laboratory Analytical Viewer(LAV)分析软件、GC×IMS Library Search 软件及软件内置的NIST数据库和IMS数据库对物质进行定性分析),德国G.A.S公司;WYA阿贝折光仪 上海光学仪器厂有限公司。
1.2 实验方法
1.2.1 冰鲜竹燕窝的预处理 将冰鲜竹燕窝置于冷藏室中解冻后,挑选,清洗,沥干,粉碎(小于0.2 cm×0.2 cm),备用。
1.2.2 竹燕窝菌汤的制备
1.2.2.1 微波熬制 料液比1∶30 g/mL,熬制时间15 min,熬制火力700 W,所得的菌汤冷却后过滤,定容至250 mL,密封,编号为WB,待测。
1.2.2.2 电压力锅熬制 料液比1∶30 g/mL,熬制时间25 min,所得菌汤冷却后过滤,定容至250 mL,密封,编号为DYL,待测。
1.2.2.3 电磁炉熬制 料液比1∶30 g/mL,熬制时间70 min,熬制火力300 W,所得菌汤冷却后,过滤,定容至250 mL,密封,编号为DCL,待测。
1.2.3 三种熬制工艺对竹燕窝菌汤品质的影响
1.2.3.1 水分含量的测定 参照GB 5009.3-2016《食品中水分的测定》直接干燥法测定。
1.2.3.2 固形物溶出率的测定 参照GB/T 12143-2008《饮料通用分析方法》在20 ℃时利用阿贝折光仪测定,计算公式如下:
固形物溶出率(%)=[菌汤中可溶性固形物含量(g/mL)×250(mL)]/[新鲜竹燕窝质量(g)×(1-94.9%)]×100
式中:94.9%为冰鲜竹燕窝的水分含量。
1.2.3.3 游离氨基酸含量的测定 参照国标GB/T 5009.124-2016《食品中氨基酸的测定》进行测定。
1.2.4 气相-离子迁移谱(GC-IMS)分析方法
1.2.4.1 自动进样器条件 孵化温度:60 ℃;孵化时间:30 min;进样方式:顶空进样;进样体积:200 μL;进样针温度:65 ℃;加热方式:振荡加热;振荡速度:500 r/min;不分流;清洗时间:5 min。
1.2.4.2 气相色谱(GC)条件 色谱柱:FS-SE-54-CB-1;石英毛细管柱(15 m×0.53 mm,0.5 μm);色谱柱温度:50 ℃;载气:N2(纯度≥99.999%);载气流速:初始流速0~2、2、2~10、2~20、10~20、20~100、20~30 min、100~150 mL/min;分析时间:30 min。
1.2.4.3 离子迁移谱(IMS)检测条件 漂移管长度:98 mm;管内线性电压:500 V/cm;漂移管温度:45 ℃;漂移气:N2(纯度≥99.999%);漂移气流量:150 mL/min;放射源:β射线(氚,3H);离子化模式:正离子。平行测定3次。

表1 三种竹燕窝菌汤的游离氨基酸含量
1.2.5 定性定量分析
1.2.5.1 化合物RI值计算方法 通过测试已知保留指数标品(2-丁酮、2-戊酮、2-己酮、2-庚酮、2-辛酮、2-壬酮)的保留时间,经FlavourSpec®自带的GC×IMS Library Search软件拟合出保留时间与保留指数RI的关系,再将GC-IMS捕捉到样品的VOCs的保留时间转化为保留指数RI。
1.2.5.2 相对气味活度值(ROAV)的计算 采用相对气味活度值(ROAV)评价各挥发性风味化合物对样品总体风味的贡献,ROAV计算公式如下:
其中:Ci、Ti分别为各挥发性风味化合物的相对百分含量和香气阈值;Cmax、Tmax分别为样品中气味活度值最高成分的百分含量和香气阈值。
1.2.6 主成分分析(PCA分析) 利用FlavourSpec®自带的Laboratory Analytical Viewer(LAV)分析软件中的PCA插件读取各个VOCs的峰强度值,自动计算得到。
1.3 数据统计
用Excel和Origin软件对数据进行统计和绘图,SPSS 22.0对数据显著性差异进行分析。
2 结果与分析
2.1 三种竹燕窝菌汤固形物溶出率
固形物溶出率对菌汤中营养物质含量的多少有决定作用。由图1可知,三种熬制工艺的料液比均为1∶30 g/mL,所得竹燕窝菌汤中固形物溶出率最高的为电压力锅熬制,为47.6%,且三种熬制工艺竹燕窝菌汤的固形物溶出率有显著性差异(P<0.05)。原因可能是电压力锅熬制相比于微波和电磁炉熬制,在熬制过程中,压力增大,温度较高,细胞膜外可溶性固形物浓度比细胞内低,从而促进了细胞膜内的可溶性固形物向膜外扩散,从而提高了竹燕窝中可溶性固形物从细胞内往菌汤中的扩散程度,而使得固形物溶出率增加。

图1 三种竹燕窝菌汤中固形物的溶出率
2.2 游离氨基酸含量测定
食用菌的滋味是由各种不同呈味的游离氨基酸的平衡及相互影响共同决定的,对其风味具有重要作用。由表1可知,三种熬制工艺均得到16种游离氨基酸,包含7种人体必需氨基酸。游离氨基酸总量、必需氨基酸总量最高的样品的熬制方式均为电压力锅熬制,含量分别为3.87×10-2、1.21×10-2g/kg。原因可能是电压力锅熬制的竹燕窝菌汤的固形物溶出率比较高,同时,电压力锅熬制时压力增大,也促进了游离氨基酸往细胞膜外扩散的程度,而使得DYL中游离氨基酸含量升高的缘故。鲜味氨基酸谷氨酸为游离氨基酸中含量最高的氨基酸,说明竹燕窝菌汤鲜味明显。同时,相对于其他食用菌汤,如羊肚菌汤[21]而言,竹燕窝菌汤的游离氨基酸含量偏低,原因可能是原料冰鲜竹燕窝含水量高达94.9%所致。
2.3 气相-离子迁移谱(GC-IMS)对竹燕窝菌汤的挥发性风味成分分析
在进行气相-离子迁移谱(GC-IMS)分析前,将样品冷至室温、密封、编号、冷藏。分析时,采用顶空进样,最大程度地保留竹燕窝菌汤样品所产生的挥发性有机化合物(VOCs)特征组分,避免由于外界条件如温度等的波动导致样品中易挥发物质的损失,以确保分析结果的稳定性和准确性。
2.3.1 竹燕窝菌汤VOCs的GC-IMS二维谱图 图2为竹燕窝菌汤样品的GC-IMS二维谱图,整个图背景为蓝色,横坐标1.0处红色竖线为RIP峰(反应离子峰),纵坐标为GC分离时VOCs 的保留时间(s),横坐标为IMS分离时VOCs相对于反应离子峰的迁移时间。反应离子峰右侧的每一个点代表一种VOCs,蓝色为背景,颜色代表物质的浓度,白色表示浓度较低,红色表示浓度较高,颜色越深表示浓度越大。从图2中可以看出,不同熬制工艺的竹燕窝菌汤样品内VOCs可通过GC-IMS很好地分离,且可直观得出VOCs的差异。从WB到DYL到DCL,有的挥发性风味化合物浓度在增大,有的消失,有的减弱。其中:橙框区域,在微波熬制中浓度较大,电压力锅熬制和电磁炉熬制所含挥发性风味化合物的种类相似,但浓度上有差异;白圈区域,仅存在微波熬制的样品中;红框区域的化合物在电压力锅熬制样品中种类最多、浓度最高。此外,根据VOCs气相色谱保留时间和离子迁移时间对VOCs进行二维定性分析。在竹燕窝菌汤样品中共鉴定出22种VOCs(29个峰22种化合物见表2;另外,未定性的还有30个峰尚需进一步研究)。为了更为直观对比样品间VOCs的差异,利用LAV软件的Gallery Plot插件,自动生成VOCs指纹图谱(见图3)。

图2 竹燕窝菌汤的GC-IMS二维谱图

图3 竹燕窝菌汤的GC-IMS指纹谱图
2.3.2 竹燕窝菌汤VOCs的鉴定 从GC×IMS数据库中共鉴定出22种VOCs,共29个信号峰。同一种化合物在漂移时间内有多于一个的信号产生(例如:单体、二聚体,甚至聚合物),这些信号或斑点归因于VOCs通过漂移区时被分析的离子和中性分子之间形成加合物。表2列出了样品中已定性的VOCs,序号与指纹图谱一致,包括化合物名称、CAS编号、分子式、保留指数(RI)、保留时间、迁移时间。由表2可知,竹燕窝菌汤中已定性的22种VOCs分别为醇类8种、醛类9种(二聚体5个)、酮类1种、酸类1种(二聚体1个)、酯类1种(二聚体1个)、杂环类2种。
2.3.3 竹燕窝菌汤VOCs的GC-IMS指纹图谱 从图3中可以看出每种样品的完整VOCs信息以及样品之间VOCs的差异。每一行代表一个样品,每个样品平行测定3次,由该样品的全部挥发性有机物信号峰组成,每一列为同一保留时间及漂移时间下的有机物(不同样品中相同的物质)的信号峰。从图3中VOCs 的离子峰排列可明显看出,平行测定样品含有共有VOCs,仅区别于浓度大小,样品组内具有明显的相似性,而样品组间则呈现出明显的差异。不同熬制工艺下的竹燕窝菌汤的特征风味化合物的差异,可能是由于微波、电压力锅、电磁炉3种熬制工艺的热传导方式不同,导致竹燕窝菌汤在熬制的过程中,分子碰撞的频率和概率的不同,从而挥发性风味成分也出现了差异。
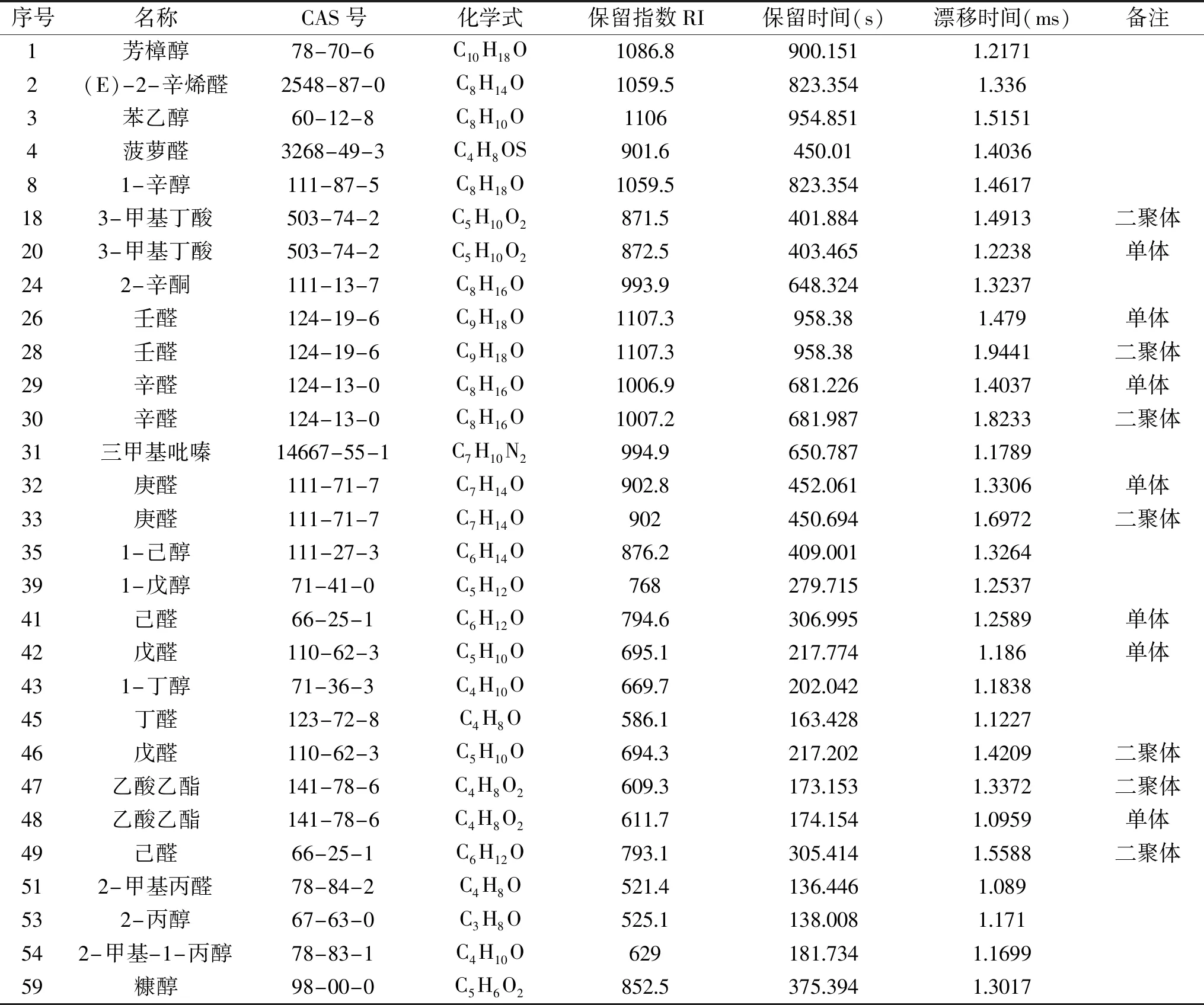
表2 竹燕窝菌汤样品VOCs物质列表
由图3可知,A框(1~7号化合物)和C框(19~23号化合物)区域内的VOCs在三种菌汤中均存在,浓度上有差异,包括:芳樟醇、(E)-2-辛烯醛、苯乙醇、菠萝醛、3-甲基丁酸单体;其中苯乙醛、菠萝醛的含量方面,WB与其余两种样品有显著性差异(P<0.05);B框(8~18号化合物)主要存在于WB中,主要包括:1-辛醇、3-甲基丁酸二聚体;D框(24~34号化合物)主要存在于DCL中,主要包括:2-辛酮、壬醛、辛醛、三甲基吡嗪、庚醛;E框(35~49号化合物)主要存在于DYL和DCL中,主要包括:1-己醇、1-戊醇、己醛、戊醛、1-丁醇、丁醛、乙酸乙酯;在1-己醇、1-戊醇、戊醛单体、1-丁醇、丁醛的含量方面,WB与其余两种样品间存在显著性差异(P<0.05);在己醛、戊醛二聚体、乙酸乙酯的含量方面,三种样品间均存在显著性差异(P<0.05);F框(50~58号化合物)主要存在于DYL中,主要包括:2-甲基丙醛、2-丙醇、2-甲基-1-丙醇,其中在2-甲基丙醛、2-丙醇的含量方面,DYL与其余两种样品间存在显著性差异(P<0.05);在2-甲基-1-丙醇的含量方面,三种样品间均存在显著性差异(P<0.05);框外的59号化合物糠醇主要存在于WB和DYL中。由此可知,熬制工艺不同,样品的VOCs亦有明显差异。
2.3.4 已定性VOCs的含量和种类统计 结合表2和图4可知,在已定性的VOCs中,醛类化合物含量最高,主要包含:己醛、壬醛、(E)-2-辛烯醛等;其次是醇类化合物,主要有:苯乙醇、1-辛醇等;WB的醛类和醇类化合物在含量上与其余两种样品均存在显著性差异(P<0.05);然后是酯类、酸类和杂环类,酮类含量最低。
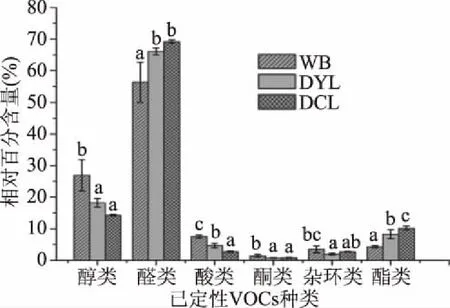
图4 三种样品中已定性VOCs的对比分析
2.3.5 竹燕窝菌汤样品关键风味化合物分析 由表3可知,当ROAV≥1时,说明该风味化合物为所分析样品的关键风味化合物,且ROAV值越大对样品总体风味的贡献也就越大[24]。由表3可知,三种样品的关键风味化合物按贡献度由大到小依次为,WB:菠萝醛、壬醛、苯乙醇、2-甲基丙醛、己醛、庚醛、(E)-2-辛烯醛、辛醛、糠醇、乙酸乙酯、戊醛、三甲基吡嗪;DYL:2-甲基丙醛、菠萝醛、壬醛、己醛、苯乙醇、乙酸乙酯、庚醛、(E)-2-辛烯醛、辛醛、戊醛、糠醇;DCL:壬醛、菠萝醛、苯乙醇、己醛、2-甲基丙醛、乙酸乙酯、庚醛、辛醛、(E)-2-辛烯醛、戊醛、糠醇、三甲基吡嗪。由此可知,已定性的三种样品的关键风味化合物种类相似,但贡献度差异较大。所以,三种样品风味差异明显。该结果与二维图谱、指纹图谱分析结果一致。
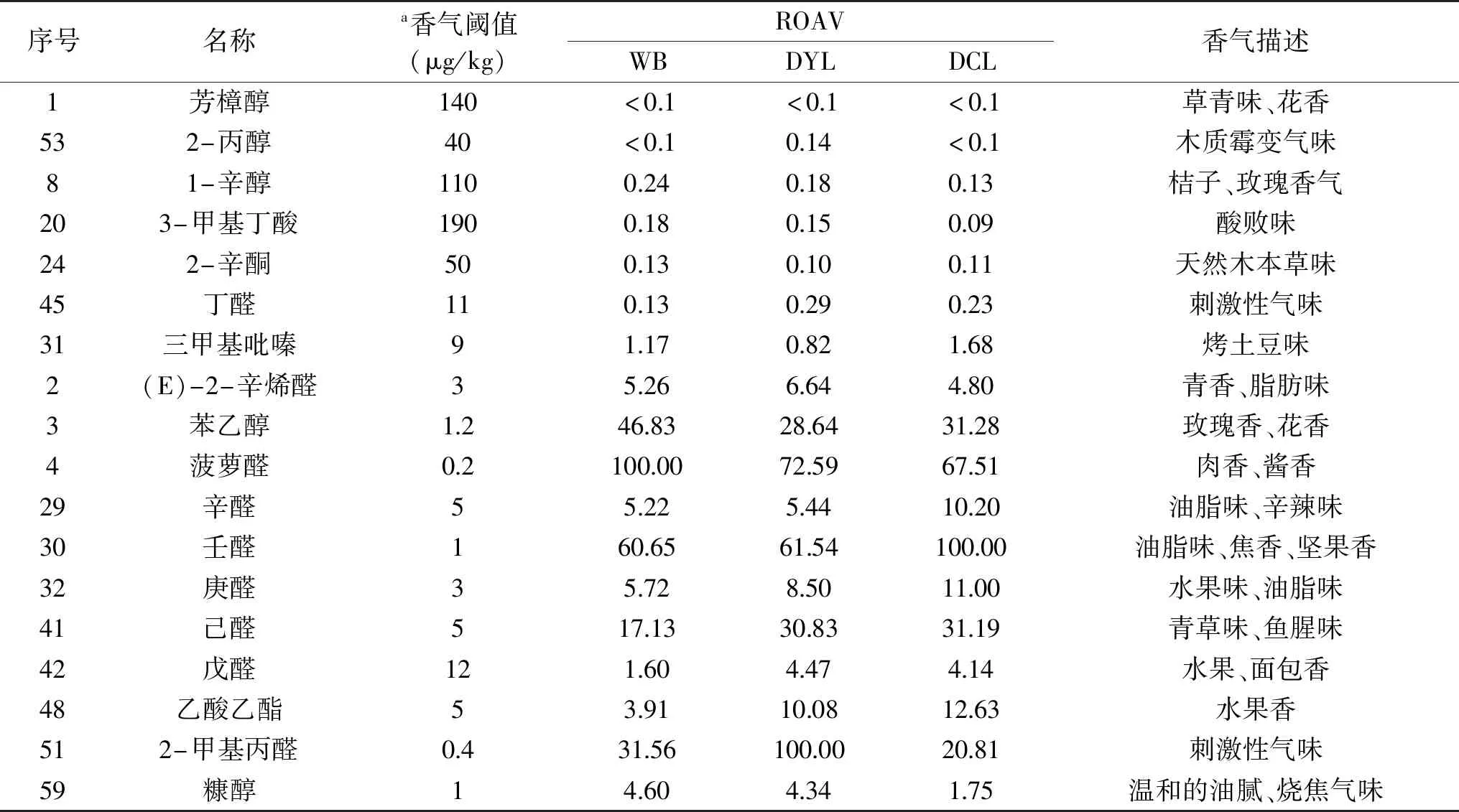
表3 竹燕窝菌汤中已定性VOCs的ROAV值列表
结合表2、表3和图4可知,已定性的VOCs中,以醛类为主,醛类化合物含量最高,且香气阈值低[25],为竹燕窝菌汤贡献了主要的风味。比如:具有油脂味、焦香、坚果香的壬醛[26]为DCL的最重要的风味贡献物质(ROAV=100);此外,该物质对WB(ROAV=60.65)和DYL(ROAV=61.54)的风味贡献亦较大。具有肉香、酱香的菠萝醛[27]为WB的最重要风味贡献物质(ROAV=100),对DYL(ROAV=72.59)和DCL(ROAV=67.51)的风味贡献亦很大。具有青香的己醛[26]、(E)-2-辛烯醛[28]对三种样品的风味贡献亦在ROAV>1的范围。醇类化合物香气阈值偏高[29],但含量较高,对竹燕窝菌汤的整体风味也有贡献。如:具有玫瑰香、花香的苯乙醇[28]对三种样品的风味贡献均较大(ROAV均大于28)。具有桔子、玫瑰香气的1-辛醇[28]对三种样品的风味均具有修饰作用(ROAV均大于0.10)。酯类化合物普遍具有水果香气,在3种样品中均检测出具有果香气的乙酸乙酯[28],其中乙酸乙酯对DCL的风味贡献最大(ROAV=12.63),对WB贡献最小(ROAV=3.91)。具有酸败味的3-甲基丁酸[30]对WB和DYL风味仅有修饰作用,对DCL风味影响较小;具有天然木本草味的2-辛酮,对3种样品风味均仅有修饰作用(ROAV均大于0.10);含SN杂环类化合物阈值较低[31],本文检测出的具有烤土豆味的三甲基吡嗪[30],对DCL风味贡献最大(ROAV=1.68),对DYL风味仅有修饰作用(ROAV=0.82)。而含氧杂环糠醇具有温和的油腻、烧焦气味[26]对WB风味贡献最大(ROAV=4.60)。
2.3.6 基于主成分分析(PCA)的竹燕窝菌汤VOCs特征分析 主成分分析(PCA)是一种多元统计分析方法,通过降维,将多个有一定关联的变量进行线性变换成少数几个互不关联的主成分来揭示多个变量间的关系。通常,当累积贡献率达到60%时,可选择PCA模型作为分离模型[32]。将竹燕窝菌汤样品所有VOCs对应的峰面积进行归一化处理后,计算出各VOCs的峰面积对应的协方差矩阵及特征值和特征向量,再确定主成分,计算相应的贡献率,PCA分析结果如图5所示。由图5可知,PC_1[61%]与PC_2[30%]之和为91%,说明对原始数据进行线性变换和降维时,核心成分有效的保留,分析结果能反映样品的总体特征。其中PC_1[61%]可将三种熬制工艺所得竹燕窝菌汤样品进行很好地区分;电压力锅熬制所得菌汤样品的PC_1和PC_2均与微波和电磁炉熬制样品存在明显差异,微波和电磁炉熬制的样品PC_2无明显差异。该结果与二维图谱、指纹图谱和ROAV分析结果一致。以上说明,基于GC-IMS检测技术,测定竹燕窝菌汤的VOCs,再将VOCs峰面积进行PCA分析,可对不同熬制工艺进行很好地区分。

图5 竹燕窝菌汤VOCs的PCA分析
3 结论
3种不同熬制工艺制得的竹燕窝菌汤中固形物溶出率、游离氨基酸含量、鲜味氨基酸谷氨酸含量最高的均为DYL。GC-IMS二维图谱和指纹图谱中,3种不同熬制工艺制得的样品挥发性风味成分的种类和含量差异较大,关键风味化合物对3种菌汤整体风味贡献度差异明显。已定性的VOCs中,以醛类、醇类化合物为主,其中醛类化合物对竹燕窝菌汤的整体风味贡献最大。PCA分析中,3种菌汤样品分布在不同区域,根据PC_1[61%]可将3种样品进行很好地区分。由此可知,不同熬制工艺代表不同的热传导方式,传热方式的不同,菌汤中固形物溶出率、游离氨基酸的含量有明显差异,所产生的挥发性风味成分亦不同。综上,根据GC-IMS联用技术,通过检测挥发性风味成分,对竹燕窝菌汤的不同熬制工艺进行区分是可行的。同时,由于IMS数据库尚在不断完善过程中,所以,尚未能完全鉴别出竹燕窝菌汤的所有特征风味化合物,未定性的30个峰还需进一步研究。

