红枣多糖提取、分离纯化及生物活性研究进展
冀晓龙,尹明松,侯春彦,刘延奇,*
(1.郑州轻工业大学食品与生物工程学院,河南郑州 450001;2.河南省冷链食品质量安全控制重点实验室,河南郑州 450001;3.食品生产与安全河南省协同创新中心,河南郑州 450001)
红枣(Jujube),又名中华大枣,是鼠李科(Rhamnaceae)枣属(ZizyphusjujubaMill.)植物枣树的果实[1-2]。枣树在我国已有四千多年的种植栽培历史,主要分布在西北地区、黄河流域沿岸地区和东部地区[3-4]。我国红枣的栽培面积及产量均居世界第一,同样也是世界唯一的红枣出口国,因此我国在开发红枣及深加工产品方面具有独特的优势[1,5]。红枣营养十分丰富,《本草纲目》记载红枣具有补虚益气、养血安神、健脾和胃等多种保健功能,被国家卫健委列为药食同源食品[6-7]。红枣中含有许多十分重要的生物活性成分,如:VC、多酚、黄酮、多糖、环核苷酸等[1,8-9]。近些年来,对红枣的研究主要集中在多酚、黄酮、环磷酸腺苷等方面,随着糖化学和糖生物学技术的快速发展,红枣多糖也逐渐进入国内外学者的研究视野中,有相关研究表明红枣多糖具有抗氧化、免疫调节、抗肿瘤、抗衰老、保肝、抗溃疡、调节肠道菌群等多种功能活性[3,10-12]。植物多糖的生物活性与其结构特征密切相关,多糖的单糖组成情况、糖苷键类型与链接方式、空间构型等都影响其活性[13-15];对红枣多糖结构的化学研究是其作为功能性食品应用的基础条件[16-17]。本文基于对红枣多糖各方面的研究成果为基础,并结合最新研究动态,就红枣多糖的提取、分离纯化、理化性质及结构特征、生物活性等方面的研究进展进行综述,以期为红枣多糖构效关系提供理论依据;为进一步开发利用红枣多糖提高其在食品和医药领域的应用提供参考。

表1 红枣多糖的提取方法及评价
1 红枣多糖的提取、分离纯化
1.1 红枣多糖提取
提取红枣多糖前需对原料进行预处理,即洗净红枣、去核、脱水干燥(冷冻干燥)、粉碎、过筛得红枣粉[3,18-19]。红枣的品种、料液比、提取温度、时间、溶剂、pH、提取次数等提取条件以及不同提取方法等因素对提取红枣多糖的得率、结构及活性都有一定的影响[3-4]。红枣多糖的提取方法有很多,主要包括溶剂浸提法(水浸提法、稀碱浸提法)、酶水解法、超声波辅助提取法、微波辅助提取法、超高压辅助提取法、亚临界辅助提取法等,主要相关方法比较与评价见表1[20-31]。在实际生产与实验室提取多糖中常采用两种或更多的方法联合使用,如上述涉及的酶法协同超声波热水浸提法,一般联合使用会比单独提取效率更高[32-33]。
1.2 分离纯化
采用上述不同方法提取的红枣粗多糖,常含有蛋白质、色素、小分子物质等杂质,这不仅影响红枣多糖的质量与纯度,还影响下一步纯化、结构分析、高级结构表征及构象关系的研究[3,34-35]。除去红枣粗多糖里杂蛋白常采用三氯乙酸法和Sevag法,Sevag法是植物多糖脱蛋白中最为常用的方法,具有成本低、检测速度快,但也存在多糖损失量大、多糖活性被部分破坏等缺点[36-37]。有时制得的红枣粗多糖干燥后颜色较深,需要进行脱色处理,采用离子交换树脂法(DEAE纤维素吸附法、大孔吸附树脂AB-8)和双氧水法[38-40]。H2O2氧化法脱色效果好,但高浓度处理会破坏多糖的分子结构并影响其生物活性。
为进一步研究红枣多糖的单糖组成、平均分子量、糖苷键类型、高级结构特征等,还需在提取红枣粗多糖的基础上对其做进一步分离纯化[3,41]。常用的分离纯化方法主要有离子交换树脂法和凝胶过滤柱色谱。对于纯化制备大量的红枣多糖,报道最多的是利用DEAE-52、DEAE Sepharose CL-6B、DEAE-Sepharose Fast Flow纤维素离子交换柱层析和Sepharose CL-4B/6B、Sephadex G-200、Sephacryl S-300葡聚糖凝胶柱层析两种层析方法(表2)[42-51]。Li等[42-43]采用水提醇沉获得金丝小枣粗多糖,经超滤和DEAE-Sepharose CL-6B色谱柱分离、Sepharose CL-6B凝胶柱洗脱、Sephadex G-200进一步纯化获得单一组分金丝小枣组分ZSP3c。Ji等[48-51]采用超声辅助热水浸提木枣以提取多糖,经过DEAE-Sepharose Fast Flow分离、Sephacryl S-300纯化得到均一的三种木枣多糖组分。
2 红枣多糖的理化性质及结构特征
大多数植物多糖具有分子量大、空间结构复杂、生物化学活性不活跃等特点,因而研究难度比多酚类、黄酮类等化合物要大[52-53]。现在对植物多糖的结构特征主要研究集中在其一级结构特点,包括单糖组成、平均分子量、糖苷键连接方式、以及主链的基本构型等[54-56]。化学结构决定其功能活性,探究植物多糖的结构对研究其生物活性及潜在的构效关系十分重要[57-59]。由于原料来源、提取工艺、纯化方法、分析方法的差异,植物多糖的研究结果也有所不同,如多糖的平均分子量、单糖组成均存在一定的差异[60-61]。
2.1 理化特性
红枣多糖为淡黄色粉末,易溶于水,难溶于乙醇、丙酮、正丁醇等有机试剂[12]。研究表明,纯化的红枣多糖碘-碘化钾实验呈阴性(说明不含淀粉)和Molish反应为阳性(说明具备多糖一般性质)、紫外光谱检测(260、280 nm处无检测吸收峰)说明不含蛋白质和核酸,红外光谱可检测到红枣多糖的特征吸收峰[16,48-51]。
2.2 平均分子量
植物多糖的理化特性与其平均分子量有很大关系[62-63]。要测定植物多糖的分子量,首要就是对其纯度的鉴定[64]。目前,在红枣多糖纯度鉴别与平均分子量测定研究中普遍使用高效液相凝胶色谱法(HPGPC)[3,65]。Wang等[45]测得木枣多糖HJP1、HJP3的分子量分别是 6.762×104和2.936×104Da。Rostami等[23]对来自伊朗东部的红枣进行分离纯化得到两种多糖组分JCP-1和JCP-2,其分子量大小分别为1.5×105和9.1×104Da。在红枣多糖平均分子量的测定中,红枣多糖的品种、提取工艺、测定方法的不同对红枣多糖分子量的测定都有影响,红枣多糖平均分子量大致范围在104~106Da[3,16]。
2.3 单糖组成
分析植物多糖的单糖组成是研究其结构与生物活性的必要基础前提。目前,研究红枣多糖单糖组成的方法主要有气相色谱法(GC)和液相色谱法(HPLC)[66-67]。Zhao等[68]首次对来自河北地区的冬枣果实、叶、花提取多糖并进行单糖分析,发现提取的三种多糖均含有不同摩尔比的鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和糖醛酸(半乳糖醛酸和葡萄糖醛酸)。Cui等[20]采用气相分析对新疆大枣提取的酸性多糖(RQP1d、RQP2d)进行单糖组成分析,研究发现两种红枣多糖均由鼠李糖、阿拉伯糖、木糖、半乳糖、葡萄糖、甘露糖组成,其中PQP1d单糖摩尔比为9.76∶23.44∶18.77∶31.15∶2.07∶4.39,PQP2d单糖摩尔比为3.17∶32.78∶35.72∶7.82∶5.50∶0.35。Ji等[48]对木枣多糖进行纯化并采用气相方法进行分析,发现三种木枣多糖由不同比例的鼠李糖、半乳糖、半乳糖醛酸组成。就红枣多糖的单糖组成和比例已报道的文献结果虽不尽一致,但研究结果总体表明红枣多糖主要由不同摩尔比的鼠李糖、阿拉伯糖、半乳糖、半乳糖醛酸构成,这主要是红枣品种不同、提取工艺、纯化方法、检测手段不同等因素可影响红枣多糖单糖组成的结果[3]。
2.4 化学结构
除对红枣多糖的单糖组成和平均分子量研究之外,关于红枣多糖的结构也逐渐被研究者所关注(表2);主要采用甲基化分析、高碘酸氧化、Smith降解、GC-MS、核磁共振技术(NMR)确定植物多糖的单糖残基类型和糖苷键连接主要位点[48-51]。木枣多糖组分HJP3经部分酸水解,Smith降解和甲基化反应、近红外光谱,NMR一维图谱解析,研究结果表明HJP3主要由(1→2)-Rhap(11%),(1→5)-Araf(11.7%),(1→3,5)-Araf(14.8%),(1→4)-Galp(13.5%)和(1→4)-GalpA(15.1%)组成。理化研究表明HJP3是包含I型鼠李半乳糖醛酸结构域的典型果胶结构[45]。
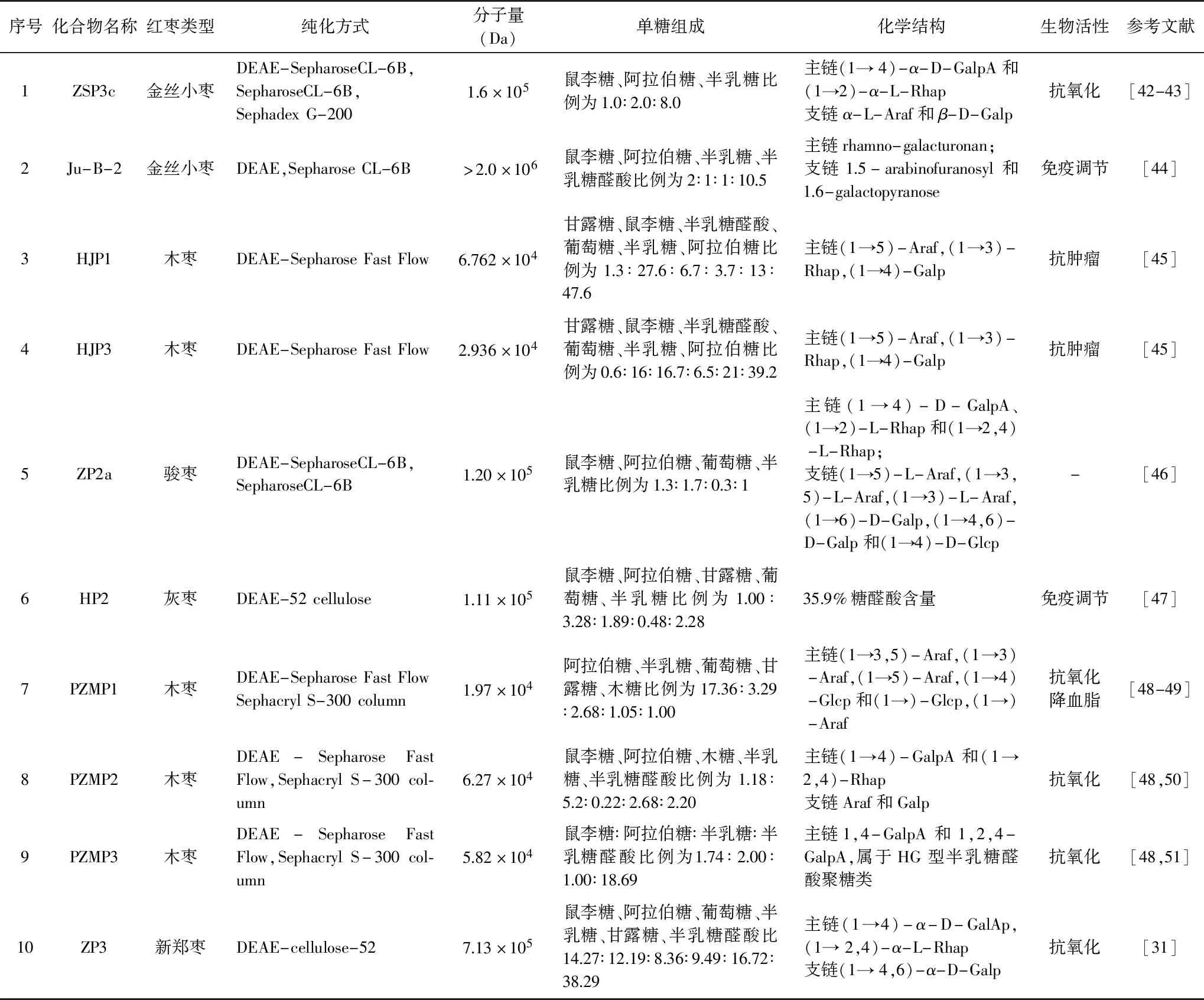
表2 红枣多糖理化特性、化学结构与药理活性
冬枣多糖经化学分析和多种仪器检测之后,发现其结构主要由含有(1→5)-和(1→3,5)-Araf 残基的阿拉伯糖残基,含有(1→4)-和(1→2,4)-Galp 残基的半乳糖残基和含有(1→2)-和(1→2,4)-Rhap残基组成,且具有较强的免疫活性[20]。骏枣多糖经气相分析、甲基化分析、核磁分析和液相色谱-电喷雾质谱分析,发现其主链主要为1,4-D-GalpA重复单元[69]。
陕北木枣多糖经理化分析及气相分析、近红外分析、甲基化分析、核磁技术解析结构,研究结果表明PZMP1主链主要以1,3,5-Araf和1,5-Araf连接方式构成,1,4-Galp可能在主链存在[49]。PZMP2主链由半乳糖醛酸通过1,4-GalpA与鼠李糖通过1,2,4-Rhap相连接构成,属于I型鼠李糖半乳糖醛酸聚糖类[50]。PZMP3主链由半乳糖醛酸通过1,4-GalpA和1,2,4-GalpA相连接构成,属于HG型半乳糖醛酸聚糖类[51]。
2.5 高级结构特征
植物多糖对应的高级结构特征主要是由植物多糖在较为稀释溶液中的分子不同参数所确定的,同时也可利用现有的先进的显微技术直接进行扫描观察[70-71]。现有关于红枣多糖高级结构特征主要涉及其潜在的分子形貌特征,所涉及的仪器主要有X-射线衍射法、差示扫描量热法、原子力显微镜、原子力显微镜[73]。Cui等[20]研究来自新疆大枣多糖的扫描电镜结构,表明红枣多糖组分RQP1d和RQP2d的表面相似,并出现粗深皱纹。Rostami等[23]研究红枣多糖的乳化活性和乳化稳定性。研究结果显示,在水包油型乳液模型中,1.5% JCP-1具有较高的乳化稳定性(95.5%)和具有较低的表面张力(44.1 mN/m)并形成小的液滴尺寸(1.32 μm)。木枣多糖溶液为非牛顿假塑性流体,表现出剪切变稀的特性;在频率扫描的范围内,储能模量(G′)始终大于损耗模量(G″),表明木枣多糖在实际生产中更适合于做稳定剂[72]。X-衍射发现,中性木枣多糖仅含有1个弥散峰,而酸性糖可含有3~4个弥散峰;扫描电镜结果显示中性糖表面最为光滑,酸性糖呈现特殊结构性状;原子力显微镜发现木枣多糖各组分在溶液中均并没有完全的延展,这可能由于红枣多糖分子量大小、酸性糖含量及分子结构特性对其微观形态特征具有重要的影响所导致的[48]。
3 红枣多糖的生物活性
目前关于植物多糖功能活性的研究主要集中在两个方面:一方面是作为非特异治疗剂,作用于相类似的对应分子,调节各种生理功能或纠正病理过程,目前研究较多;另一方面则是作为信息分子进入机体发挥补充调节或抑制的作用,目前研究相对较少[32,57]。多糖是红枣中最主要的有效成分之一,具有多种药理活性,主要有抗氧化、保肝、抗癌、抗炎、增强免疫力、调节肠道菌群等功效[73]。
3.1 抗氧化作用
越来越多的研究表明在生物体中由自由基(ROS)导致的氧化损伤是许多慢性疾病如心脏病、肿瘤等重要的诱因[74-76]。植物中的天然活性成分是一种非常有效的抗氧化剂来源,尤其是多糖,具有明显的抗氧化活性[77-78]。Wang等[79]通过实验研究证实陕北的滩枣多糖(ZSP)具有DPPH自由基、羟基自由基、超氧阴离子自由基的清除作用,且具有一定的抗氧化活性,随着多糖浓度升高抗氧化能力也逐步提高;当ZSP浓度为200 μg/mL时,DPPH自由基清除作用达到79.2%,羟基自由基的清除能力为50.6%。Li等[42-43]发现提取的金丝小枣多糖(ZSP3c和ZSP4b)具有相似的单糖组成,但在清除自由基方面ZSP3c有直接的较强的体外抗氧化能力,这可能与金丝小枣多糖基本的理化性质和结构特征有直接关系。Ji等[48]发现提取的木枣多糖(PZMP1、PZMP2、PZMP3),分别测定其对DPPH自由基、羟自由基的清除能力及Fe2+螯合能力,结果表明三个纯化多糖组分均表现出与浓度正相关的体外抗氧化活性,其中以PZPM3的体外抗氧化活性最强;这可能是单糖组成和结构活性区域的不同造成的。
3.2 免疫调节作用
天然植物多糖最重要的生物活性就是免疫调节功效,植物多糖可通过多种途径与免疫细胞表面的多种受体相结合、激活不同的相关信号通路来调控动物机体的免疫系统[80-82]。Zhan等[69]研究骏枣多糖(ZJP)对RAW264.7巨噬细胞发挥抗炎免疫作用,ZJP可显著抑制NO的产生,降低COX-2、TNF-α、IFN-γ和IL-17等促炎细胞因子的表达。分子水平研究分析表明,ZJP能抑制信号蛋白p38和JNK的磷酸化,揭示ZJP发挥抗炎免疫作用是通过抑制NF-κB和p38/JNK MAPK信号转导通路来实现的。Chi等[83]研究了冬枣多糖(JPC)在慢性疲劳综合症(CFS)大鼠模型上的免疫调节活性;JPC能促进T淋巴细胞增殖,增强机体免疫细胞(NK)活性;JPC处理能增强白细胞介素2(IL-2)的相关基因表达和IL-2蛋白的生产,降低IL-10的产生;JPC可增加CFS大鼠抗氧化的能力并以此增强机体的免疫系统。Zou等[47]提取的灰枣多糖可增加实验小鼠的脾脏和胸腺指标,促进血清溶血素形成,增强巨噬细胞吞噬活性,发挥免疫作用,抑制小鼠足垫水肿。
3.3 抗肿瘤作用
植物多糖的抗肿瘤活性受其形态、分支程度、分子量大小、水溶性等因素的影响;一般规律来说,分子量较小、水溶性相对较好的植物类多糖具有较强的抗肿瘤活性[84-85]。目前植物多糖发挥其抗肿瘤作用的机制如下:通过口服植物多糖预防肿瘤发生;增强抗肿瘤潜在免疫反应;直接发挥抗肿瘤活性,诱导肿瘤细胞凋亡;预防体内的肿瘤细胞的扩散或转移[86-88]。为研究红枣多糖的抗肿瘤作用机制,Wang等[45]从木枣中分离和纯化两个均匀的酸性多糖(HJP1和HJP3),细胞试验表明HJP3能显著性地抑制HepG2细胞的增殖,但对非肿瘤细胞株却不存在细胞毒性,分析可能是红枣多糖直接发挥抗肿瘤活性,诱导肿瘤细胞凋亡。从若羌枣籽经超声提取的多糖是由阿拉伯糖、葡萄糖、木糖、半乳糖和鼠李糖组成,对宫颈癌(HeLa)细胞存在浓度依赖性通过诱导凋亡介导的机制抑制其增殖[89]。
3.4 保肝作用
只有部分的研究证实红枣多糖对肝脏有直接保护作用,还需详细深入的研究阐明红枣多糖保肝的具体作用机制。Wang等[79]和Liu等[90]研究表明,黄河流域陕北滩枣多糖(ZSP)可剂量依赖性地抑制四氯化碳诱导的肝损伤;400 mg/kg的ZSP可显著降低四氯化碳诱导的丙氨酸氨基转移酶、门冬氨酸氨基转移酶活性以及血清中乳酸脱氢酶和肝组织中MDA水平,ZSP处理的小鼠表现出较好的肝指数(HI)和较好的抗氧化作用;陕北滩枣多糖可通过清除机体自由基,有效保护CCl4诱导损伤的肝脏。酸枣多糖可通过诱导Nrf2核易位,增加HO-1、GSTA和NQO1在肝损伤小鼠中的蛋白表达;酸枣多糖可通过增强肝组织中Nrf2通路的表达而达到保肝作用[91]。
3.5 调节肠道菌群
现代药理学研究表明,植物多糖可作为功能性食品来保护胃肠粘膜,调节肠道微生物,预防炎性应激损伤结直肠癌[92-93]。植物多糖可直接或者间接的诱导不同的生长因子产生从而促进组织修复,还可通过抑制胃肠道中性粒细胞/细胞因子,产生直接的抗炎作用;促进肠道有益微生物的增殖,产生短链脂肪酸抑制结直肠癌的发生发展[94-96]。在氧化偶氮甲烷(AOM)和葡聚糖硫酸钠(DSS)造模结肠癌小鼠过程中,红枣粗多糖通过灌胃处理进行膳食干预,研究发现红枣多糖处理的小鼠粪便中有益菌种类增加,有害菌比例显著降低;梭菌属、双歧杆菌属、拟杆菌属、乳酸菌属等丰度显著提高。红枣多糖膳食干预所导致的差异代谢物,参与三羧酸循环途径、糖酵解/糖异生途径,调节肠道菌群,从而抑制结肠癌的发生发展[97-98]。摄入红枣多糖可有效缩短胃肠转运时间,增加粪便中水分,减少盲肠和粪便氨含量,增加盲肠中不同浓度的短链脂肪酸,同时降低粪便中不同结肠细菌酶的活性,调节结直肠处菌群比例,使有益菌菌群显著增加[99]。
4 红枣多糖结构对活性的影响
4.1 红枣多糖分子量对活性的影响
植物多糖分子量的大小是影响多糖生物活性的重要因素,不同的植物多糖产生生物活性的分子量范围也是不同的[100-101]。红枣多糖中大分子量的多糖组分所占比例较大,同时也具有较好的生物活性[3]。Li等[42-43]从金丝小枣中提取得到单糖组成相似、但分子量不同的两种红枣多糖组分(ZSP2、ZSP4b),较大分子量ZSP2具有较高的抗氧化活性,这可能分子量较大的金丝小枣多糖更易在水溶液中保持原有的多糖空间构象,更易在体外发挥抗氧化作用。Ji等[48]比较了分子量大于50 kDa的多糖组分(PZMP2、PZMP3)和分子量小于50 kDa的红枣多糖组分(PZMP1)的体外抗氧化活性,结果显示分子量大的多糖组分具有更强的羟基自由基和DPPH自由基清除活性;这表明分子量更大的红枣多糖可能具有更强的体外抗氧化活性。
4.2 红枣多糖单糖组成对活性的影响
红枣多糖作为一种杂多糖,主要含有鼠李糖、阿拉伯糖、半乳糖、半乳糖醛酸[3,10,16]。同时,不同的红枣多糖组分之间所含单糖种类和各单糖比例也存在显著性的差异,这种差异性可能是与其具有多种生物活性相关[3]。研究表明含有更多糖醛酸(半乳糖醛酸、葡萄糖醛酸)的红枣多糖组分具有更好的抗氧化活性与免疫活性。Li等[43]曾经报道过金丝小枣中含糖醛酸较高的两个多糖组分ZSP3c和ZSP4b,在体外含有较强的抗氧化活性。Ji等[43]和Liu等[31]都报道过半乳糖醛酸含量较高的红枣多糖组分具有较强的体外清除羟基自由基和DPPH自由基的能力。
4.3 红枣多糖糖苷键对活性的影响
红枣多糖属于果胶多糖、阿拉伯半乳聚糖、半乳聚糖类,它们同样影响着多糖的活性[3,102]。植物多糖中含有β-(1→3)糖苷键可增加免疫活性细胞的活动而增强其抗肿瘤活性[103];而在红枣多糖研究中,Wang等[45]发现木枣多糖中含有主链(1→5)-Araf和(1→4)-GalpA具有较强的抗肿瘤活性,而Ji等[48]发现红枣多糖主链含阿拉伯糖糖苷键、半乳糖醛酸糖苷键具有较强的抗氧化活性,不同的研究结果可加深红枣多糖对其功能活性作用及其机制的基础认识。
5 结语
近年来,伴随着国内外相关学者对红枣多糖研究的日益重视,红枣多糖的许多生物活性及功能已逐步进入大众视野,国内学者对红枣多糖的提取、分离纯化、免疫保肝、抗氧化、调节肠道菌群等方面进行相关基础的研究,同时也取得很大的进展。红枣多糖作为一种天然活性物质,研究价值极大、市场前景非常的广阔。但是,就目前的研究成果而言,还存在很多亟待解决的问题。其一,红枣多糖的结构研究还处在研究其一级结构中单糖的组成、糖基排列顺序、糖苷键连接方式、糖链有无分支、分支的大小与位置的基础阶段,还需深入研究红枣多糖的空间构象等高级结构表征问题,为揭示红枣多糖分子结构与功能之间关系奠定基础。其二,仍需在动物模型、肠道微生物菌群宏基因组学、代谢组学水平上对红枣多糖的抗氧化、免疫调节、抗肿瘤等活性进行构效关系研究。其三,鉴于红枣多糖具有的多种生理活性和潜在良好的市场前景,可大力发展其作为新型的功能性食品强化剂和重要的药物载体原料。

