核桃青皮乙醇提取物对采后无花果的保鲜效果
刘 伟,曹文利,薛雨菲,杨永兴,杨 茜,李 芳,孔令明,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.新疆轻工职业技术学院,新疆乌鲁木齐 830021)
无花果(FicuscaricaL.)作为一种药食同源的果品,拥有较高的营养与药用价值[1-2]。由于无花果中水和糖的含量高,外表皮极易受到机械损伤,使无花果易被微生物侵染,出现软化、褐变、腐烂等现象,常温条件下通常只能贮藏3~5 d[3-4],导致难以远销,经济效益受到了严重影响,因此无花果采后保鲜成为亟待解决的问题和研究热点。许多学者研究表明一些化学药剂可对无花果贮藏保鲜起到有效作用,如二氧化氯、1-甲基环丙烯、氯化钙、二氧化硫等[5-11]。应铁进等[12]发现3% CaCl2处理能使无花果果实呼吸强度和乙烯释放量明显降低,并能较好地维持超氧化物歧化酶(SOD)活性,抑制丙二醛(MDA)的生成。Celia等[10]发现用25(μL·h)/L SO2熏蒸处理可抑制链格孢菌、根霉菌、葡萄孢菌和青霉菌对无花果的侵害,减少病原微生物在果实表面的萌发。Karabulut等[13]发现高浓度的ClO2雾化处理一段时间后能保持无花果品质的同时降低其腐烂率和微生物侵染的机率。化学保鲜剂的使用会存在一定残留、长期使用会产生抗药性的问题,但目前将天然植物提取物用于无花果贮藏的报道很少。张合亮等[14]通过对比不同浓度无花果叶醇提取物对无花果的保鲜效果,得出浓度为5% 的无花果叶醇提物保鲜效果最佳。

表1 试验分组情况
核桃,学名胡桃(JuglansregiaL.),乔木。新疆作为我国核桃的第二大产区,种植历史悠久,新疆核桃的产量和品质也位居我国前列,截止到2017年新疆核桃的种植面积达到39万公顷,年产量83万吨,但核桃青皮作为副产物对其的利用方式单一,利用率低,造成一定的资源浪费。核桃青皮提取物的抗氧化、抑菌活性也被多次证实。王刚霞等[15]通过研究发现15 mg/mL的核桃青皮乙醇提取物对果蔬采后5种主要的病原微生物的抑制率在79.72%以上,随着核桃青皮乙醇提取物浓度的增加,对这5种主要病原微生物的孢子萌发和菌丝生长均有良好的抑制作用,可运用于果蔬采后的病害防治。
通过课题组前期的研究发现,利用醇提法得到的核桃青皮提取物对微生物的抑制率高于碱提法,3%的核桃青皮醇提物和5%的核桃青皮醇提物能够有效抑制微生物的生长繁殖[16]。同时核桃青皮提取物中的活性物质具有较好的杀虫、抑制真菌活性[17-18],但目前还没有直接将其作为天然植物保鲜剂用于无花果采后保鲜的报道。
本文以“新疆早黄”无花果为材料,研究核桃青皮乙醇提取物对无花果采后保鲜的影响,分别以0.3 mol/L CaCl2和清水处理作为阳性对照和阴性对照组,测定贮藏期间无花果的生理生化指标,以期为核桃青皮提取物应用于无花果保鲜提供相关数据支持。
1 材料与方法
1.1 材料与仪器
无花果 “新疆早黄”品种,于2018年8月16日采摘于新疆阿图什市,挑选八成熟(泛绿微黄)、无损伤、无病虫害的果实,用聚苯乙烯多孔塑料周转箱(规格:41 cm×27 cm×19 cm)分格挡包装,内装两个冰袋,密封,当天运至实验室备用;核桃青皮(品种:温-185) 购于新疆阿克苏,购置的新鲜核桃手工剥下青皮,平铺在纸上,在自然晾晒干后用粉碎机进行粉碎,过 60目筛,粉末置于塑料密封袋中低温避光保存;氯化钙、氢氧化钠 天津市致远化学试剂有限公司;酚酞、氯化钡、草酸 上海源叶生物科技有限公司;使用试剂 均为分析纯。
GY-4型果实硬度计 浙江省建德市梅城电化分析仪器厂;PL2002型电子天平 上海市海特勒-托利多仪器有限公司;WYT-J型手持糖量计 深圳市三利化学品有限公司;TDL-5-A型低速台式离心机 上海安亭科学仪器厂;TU-1810PC型紫外可见分光光度计 北京普析通用仪器有限责任公司;KQ-250DE型数控超声波清洗器 昆山市超声仪器有限公司;SHB-III型循环水式多用真空泵 郑州长城科工贸有限公司;FW-100型高速万能粉碎机 北京市永光明医疗仪器有限公司。
1.2 实验方法
1.2.1 保鲜液的配制 参照曹文利等[16]的制备方法,以乙醇浓度为70%(体积分数)、料液比为1∶40 (g/mL)、提取时间为80 min、超声温度为60 ℃、超声功率为100 W的条件进行超声提取,旋蒸后得核桃青皮浸膏。将提前制备好的核桃青皮浸膏用无菌水溶液配制成浓度为100 mg/mL的溶液作为实验原液,再稀释成浓度梯度不同的核桃青皮乙醇提取物。化学保鲜剂以无菌水配置浓度为0.3 mol/L的CaCl2为保鲜溶剂。
1.2.2 无花果处理 将无花果分别置于体积分数不同的核桃青皮乙醇提取物溶液内,共480个果实,每组处理60个果实,按表1的分组情况进行浸果处理5 min,自然条件晾干后不同条件贮藏,依据无花果表形变化常温1 d取一次样,低温(0±2) ℃,6~7 d取一次样,测定指标。试验分组情况见表1。
1.2.3 指标的测定
1.2.3.1 失重率的测定 采用称重法测定,按下式计算:
失重率(%)=(处理时果实质量-贮藏后果实重量)/处理时果实质量×100
1.2.3.2 硬度的测定 围绕无花果果实赤道轴,等间距选取3点,用数显手持硬度计从果皮内向果肉1 cm处测定,取其平均值。
1.2.3.3 可滴定酸含量、维生素C含量、呼吸速率的测定 参照《果蔬采后生理生化实验指导》[19]。
1.2.3.4 可溶性固形物含量的测定 用纱布将无花果果肉挤出果汁滴加在数显手持糖度计检测镜上,读取读数,即为样品液中可溶性固形物的含量。重复三次。
1.3 数据处理
实验重复三次,实验数据运用Excel 2013统计处理本次试验的相关数据信息,运用OriginPro 8.5进行本实验样本图表的制作。利用SPSS 21.0进行显著性分析(P<0.05表示差异显著)。
2 结果与分析
2.1 核桃青皮乙醇提取物对无花果果实失重率的影响
水分的流失和能量物质的消耗是采后无花果失重的主要原因,这不仅直观反映出果实的新鲜程度,还使果实降低了商品价值[20]。图1是不同温度下无花果果实失重率的变化,伴随贮藏时间的延长,失重率上升趋势越来越大。常温环境下,每日测定失重率,可看出在保鲜的第3 d,A组、B组、C组、D组失重率分别达到16.53%、13.9%、12.98%、9.92%;4 d后,C组、D组与对照果实的失重率相差较大(P<0.05);5 d后常温组腐烂率急剧上升,已无贮藏意义。在低温贮藏期间,每隔5 d测定一次失重率,在18 d之前,C1组、D1组的失重率始终低于对照组,且差异性显著(P<0.05),对照组的失重率在第30 d时,达到最大值为15.11%,B1组、C1组、D1组的失重率分别为10.83%、10.09%、7.58%。核桃青皮乙醇提取物与0.3 mol/L CaCl2处理的无花果失重率均低于对照组,说明核桃青皮乙醇提取物处理能够降低无花果的失水速度,减少营养流失,且提取物浓度增大,这种趋势越明显。

图1 核桃青皮乙醇提取物对无花果果实失重率的影响
2.2 核桃青皮乙醇提取物对无花果果实硬度的影响
硬度是体现水果保鲜品质的重要指标。如图2所示是不同保鲜处理在不同温度下无花果果实硬度的变化,可以看出无花果的硬度跟随贮藏时间的延长呈不同程度的下降走势。常温环境时,C处理组、D处理组的硬度相比对照组均有很大程度延缓,在贮藏期前后,对照组果实硬度整体下降74.69%,B、C和D处理组果实硬度分别下降了5.96、5.23和5.09 N。低温条件下,C1和D1处理组较于对照组均能显著延缓果实硬度的下降(P<0.05),其中C1处理组在贮藏至第12 d时,硬度为8.85 N,高于D1处理组7.85 N与对照组相比差异性显著(P<0.05)。整体来看,在常温环境下,D处理组延缓硬度下降的效果最佳;低温环境时,D1处理组保鲜效果最佳,其次是C1处理组。表明核桃青皮乙醇提取物能够在常温和低温条件下延缓果实硬度的下降。

图2 核桃青皮乙醇提取物对无花果果实硬度的影响
2.3 核桃青皮乙醇提取物对无花果果实可滴定酸含量的影响
无花果中的可滴定酸(Total acid,TA)主要包括柠檬酸和酒石酸[3],是保持果实风味与口感不可或缺的物质,更能阻止病原菌的侵染进程。时间随贮藏延长,一部分酸转化成糖,一部分被用来供应果实采后的呼吸代谢消耗[21]。由图3可知,无花果可滴定酸的含量在果实贮藏期间整体呈下降趋势。常温下对照组可滴定酸含量由初始的0.22%下降到第5 d的0.18%左右,下降最快,C、D处理组与对照组差异显著(P<0.05),且各处理组在第3 d均出现了高峰,可能是果实内部已出现了酸败,导致酸含量上升。低温条件下对照组TA含量由起始的0.19%下降到第30 d的0.14%左右,其他处理组的TA含量下降相对较慢,其中,C1、D1处理组显著高于A1组(P<0.05)。这表明核桃青皮乙醇提取物保鲜处理能有效减缓了果实有机酸的解离程度,从而提高无花果的贮藏期限。
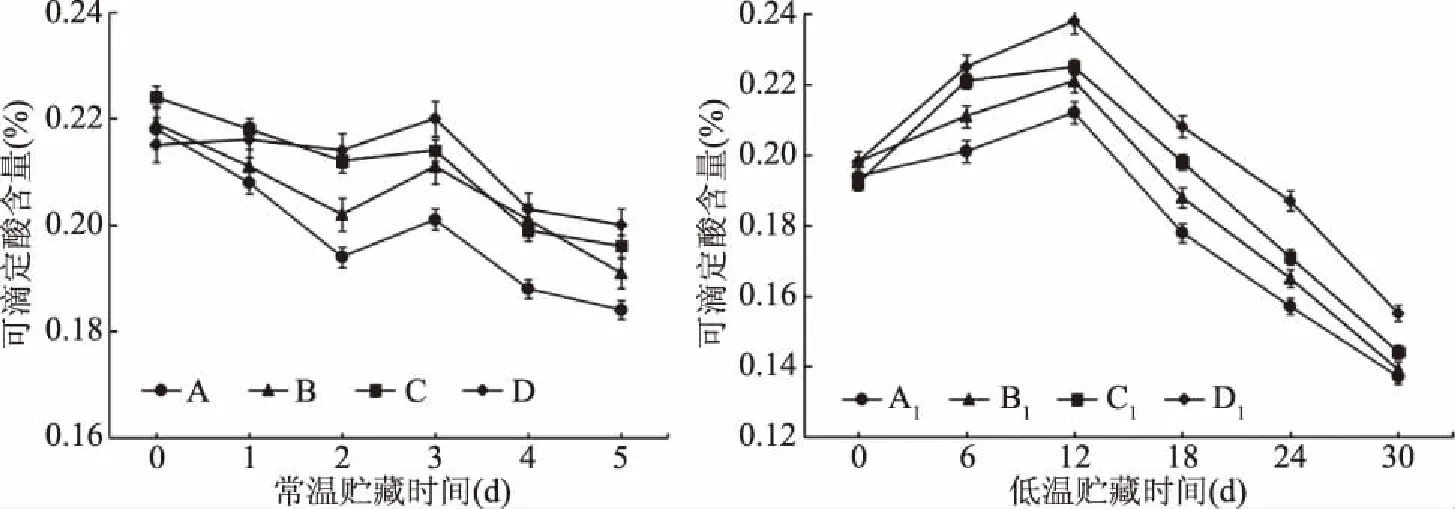
图3 核桃青皮乙醇提取物对无花果果实可滴定酸含量的影响
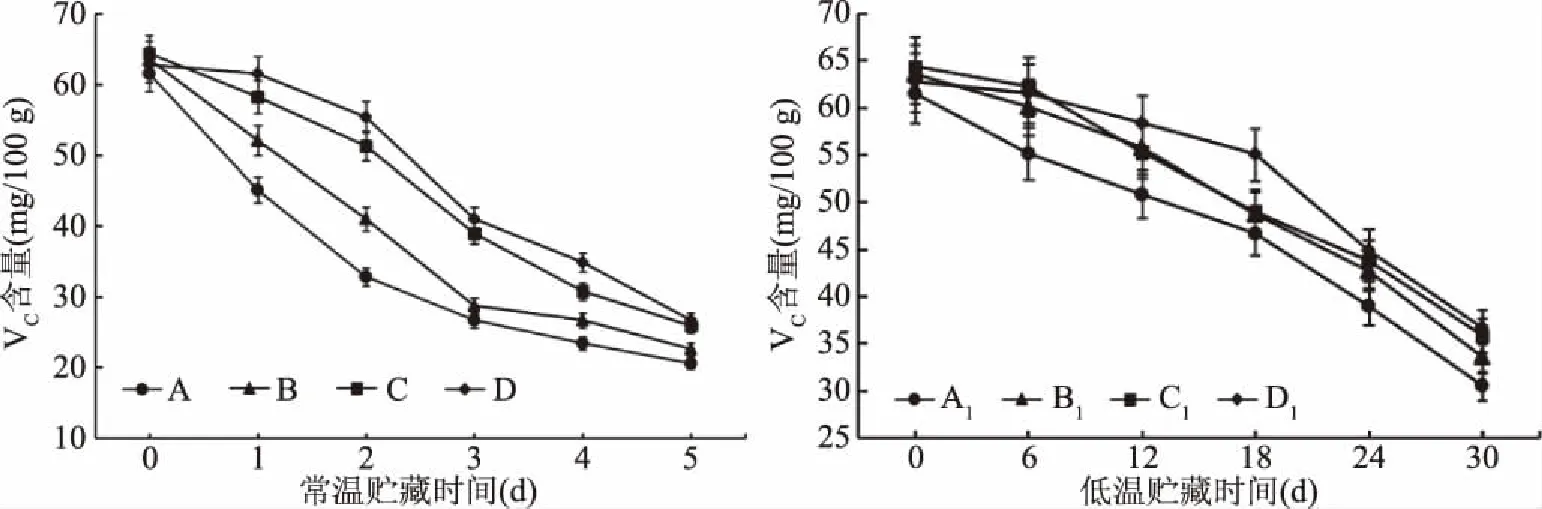
图4 核桃青皮乙醇提取物对无花果果实维生素C含量的影响

图5 核桃青皮乙醇提取物对无花果果实呼吸速率的影响
2.4 核桃青皮乙醇提取物对无花果果实维生素C含量的影响
无花果中维生素C(Vitamin C,VC)的含量很高,作为无花果的一大卖点,它拥有对生长代谢产生的活性氧基团的清除作用,保护细胞免遭氧化损害[22]。由图4可知,VC含量随时间延长以及成熟度、贮藏条件等其他因素的影响呈不断下降的趋势。常温贮藏环境时,对照组无花果的VC含量为61.50 mg/100 g,贮藏末期时,B、C、D处理组无花果的VC含量分别比初期低了47.21%、44.34%、41.58%。在低温贮藏环境下,VC含量的变化为平缓下降趋势,其中D1处理组下降的速度最慢,B1和C1处理组在12~24 d时下降速度大致相同,A1对照组下降的速度最快。表明核桃青皮乙醇提取物处理可以保持维生素C含量,延缓无花果营养价值的流失,对延缓果实衰老起到一定的作用,并且核桃青皮乙醇提取物含量越高,营养流失越慢。
2.5 核桃青皮乙醇提取物对无花果果实呼吸速率的影响
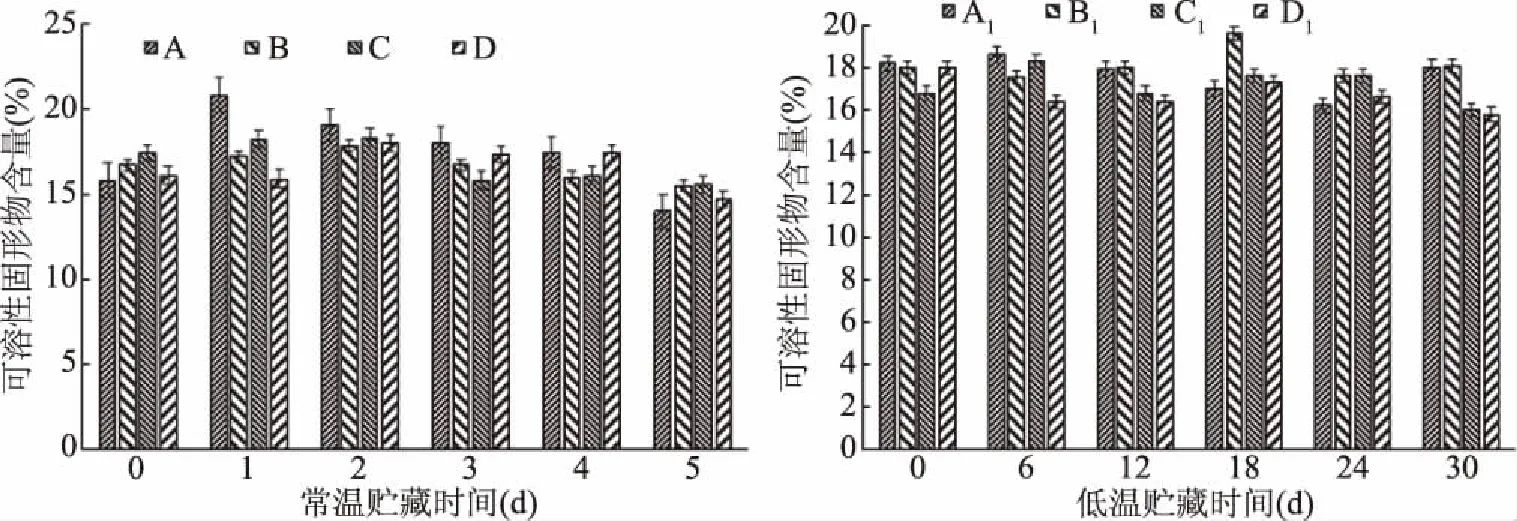
图6 核桃青皮乙醇提取物对无花果果实可溶性固形物含量的影响
根据呼吸速率可估计果蔬的贮藏潜力,呼吸强度大则会加速果蔬营养物质的消耗,呼吸强度弱则果蔬品质能更好的维持,提高其商品价值[23]。由图5可知,呼吸强度变化在不同温度下均呈现呼吸高峰。在常温下贮藏时,A对照组无花果呼吸强度比其他处理组的高,并在第1 d时出现呼吸高峰,峰值为58.12 mg CO2/(kg·h),受温度的影响,无花果代谢速率随着贮存时间的延长而一直呈下降趋势,变化趋势与魏佳等[24]得到的结论相似,在相同代谢时期内,经CaCl2化学处理组的无花果的呼吸强度最低,其次是5%核桃青皮乙醇提取物处理组。低温贮藏时,各处理组均在第12 d时到达呼吸高峰,A1、B1、C1、D1四组的呼吸峰值依次分别为28.74 mg CO2/(kg·h),26.35 mg CO2/(kg·h),26.89 mg CO2/(kg·h)和22.91 mg CO2/(kg·h),贮藏后期,A1对照组的呼吸速率保持最高的状态,与5%核桃青皮乙醇提取物处理组果实有显著差异(P<0.05),与3%降解产物处理组无显著差异(P>0.05)。研究说明低温贮藏比常温贮藏的效果好,且5%核桃青皮乙醇提取物处理对无花果贮藏期间抑制果实呼吸强度有显著效果。
2.6 核桃青皮乙醇提取物对无花果果实可溶性固形物含量的影响
可溶性固形物(total soluble solids,TSS)含量可反映果蔬营养成分在贮藏过程的损失情况[25]。由图6可以看出,常温环境时可溶性固形物含量呈略微上升又逐渐下降趋势,变化不显著。可能是果实采后有一段后熟阶段,果实中的物质发生一系列代谢活动转化成糖,而后糖又随呼吸作用的消耗而逐渐降低[26]。常温对照组在第1 d测定时出现最高值为20.80%。低温条件时,无花果在跟随贮藏时间的变化期间TSS含量呈现无明显规律变化,含量在15.80%~19.60%范围内波动,猜测是低温环境使果实当中的酶活性降低,代谢活动减缓,对无花果的呼吸速率有所抑制,从而减少无花果果实可溶性固形物含量的损失。
3 讨论与结论
本文研究了不同保鲜处理的无花果在常温和低温(0±2) ℃条件下的生理生化变化,实验表明三种不同的处理方法都有助于无花果贮藏保鲜。在不同温度条件下实验组呼吸速率都低于对照组。无花果为呼吸跃变型果实[27],在低温条件下呼吸强度出现先上升后下降的趋势,在0~12 d呼吸速率增加,说明无花果进入呼吸跃变,在第12 d达到峰值,在12~30 d随着贮藏时间延长呼吸速率降低。由于采后无花果继续成熟,TA含量继续积累,在0~12 d出现上升的趋势,随着贮藏时间的延长果实完全成熟后开始衰老,有机酸被分解,同时呼吸作用消耗了底物和能量,使TA含量出现了下降的趋势[28]。在贮藏过程中无花果的失重量较大,但是TSS含量变化不大,并且出现了略微上升后下降的趋势,考虑是在前期果实出现后熟的情况,果实中的淀粉被分解,在贮藏后期果实完全成熟呼吸作用,消耗了大量的能量,最终导致果实中TSS含量变化不大。无花果腐败主要有两个方面的原因:第一是果实自身在采后继续发生呼吸作用消耗营养物质;二是由于细菌和真菌的入侵[14]。核桃青皮乙醇提物对果实的呼吸速率有一定的抑制作用,降低了能量消耗,同时具有良好的抑菌性,从而达到了对无花果的保鲜作用。
呼吸速率是反映果蔬贮藏保鲜中最重要的指标,失重率和硬度能够反映果蔬在贮藏保鲜过程中果实形态的保持,TA、VC、TSS的含量能够反映果蔬贮藏保鲜过程中果实营养物质和口感的优劣,通过对比呼吸速率、果实形态保持、果实营养物质和口感三个方面,得出实验组对无花果果实的保鲜效果。
目前,对无花果的贮藏保鲜主要使用一些化学试剂,虽然核桃青皮提取物不及0.3 mol/L CaCl2对无花果的保鲜作用,但也能起到有效的保鲜作用。随着生活水平的提高,消费者对食品的安全性要求越来越高,相比于化学保鲜剂,核桃青皮提取物更具有安全性;其次新疆作为核桃的主产区,核桃青皮通常作为废料被处理,因此将核桃青皮提取物作为保鲜剂,价格更低廉且更容易获得。因此,进一步探究核桃青皮乙醇提取物对果蔬的保鲜作用和机理,将核桃青皮乙醇提取物作为一种新型的植物保鲜剂运用在无花果的保鲜和储运中,具有一定的应用前景和经济价值。综合考虑,可在低温(0±2) ℃条件下,将5%核桃青皮乙醇提取物用于无花果的贮藏保鲜。

