昆虫病原线虫的分子鉴定
李春杰, 王鑫鹏,2,黄铭慧,2,姜 野,2,王从丽
(1.中国科学院 东北地理与农业生态研究所 黑土区农业生态重点实验室,黑龙江 哈尔滨 150081;2.中国科学院大学,北京 100049)
0 引 言
昆虫病原线虫作为重要的昆虫天敌因其无毒高效的特征越来越受关注,应用的生防制剂主要包括异小杆属(Heterorhabditis)和斯氏线虫属(Steinernema)两个属的线虫[1]。具有广寄主的昆虫病原线虫三龄幼虫侵染寄主后,释放线虫体内的共生细菌,在昆虫体内迅速繁殖,被该类线虫侵染的昆虫一般在24~48 h内死亡[2-3]。昆虫病原线虫广泛地存在于大自然中,样品的采集和分类鉴定是有效利用其防治昆虫的前提条件,因为不同种或品系的昆虫病原线虫对昆虫的致病力有很大差异。目前已报道的有100多个昆虫病原线虫种和品系[4],早期发表的分类鉴定工作多数局限于线虫的形态学鉴定[2,5-6]。但由于有些种的线虫形态特征差异不大,很难从形态上进行区分,因此很多种群未能鉴定到种。
分子鉴定作为辅助手段开始于20世纪90年代,基于核苷酸序列的分子技术不仅是线虫鉴定的强有力工具,而且对于线虫的遗传进化研究提供了有价值的数据[7-8]。最常见的是利用种内保守和种间变异大的核糖体DNA(rDNA)靶标序列进行线虫鉴定,rDNA区域是多拷贝序列,具有容易被扩增的特点。利用rDNA的18S-28S内转录间隔区(ITS)(ITS1-5.8S-ITS2)[9]以及28S D2-D3扩展片段(D2A/D3B)[10]进行线虫种类的鉴定。分子鉴定方法速度快,简单方便,用量少,单条线虫就可以用于鉴定。近些年关于昆虫病原线虫的分子生物学分析法已有报道[11-18]。我们在长期的研究过程中收集、分离和保存了一些昆虫病原线虫[19],根据线虫侵染寄主使大蜡螟死后体表颜色可以初步判断线虫是斯氏属(昆虫体表不变或变灰黑色)还是异小杆属(昆虫体表变红或红棕色)。从线虫形态学可以看出有些种的昆虫病原线虫大小形态明显不同,同一种内不同地域的分离品系在形态学上一般没有明显差异,但对寄主的识别能力和毒性存在差异[11,20-22],说明基因型可能有变异,但是缺少对这些线虫的分子鉴定数据。因此快速鉴定昆虫病原线虫并进一步验证这些多年保存的线虫种或品系,本研究利用18S-28S rDNA的ITS和D2-D3遗传区域对本实验室收集和保存的昆虫病原线虫进行了分子鉴定。
1 材料与方法
1.1 昆虫病原线虫的来源、分离和培养
供试昆虫病原线虫共13个种或品系(表1),嗜菌异小杆线虫(H.bacteriphora, Hb)5个品系:Hb-HBN(哈尔滨)、Hb-ZT(哈尔滨)、Hb-NT-82(内蒙)、Hb-CD-11(河北)和Hb-NJ(美国),前2种是由本实验室分离、鉴定和保存, Hb-NT-82和Hb-CD-11由河北省农林科学院植物保护研究所陈书龙研究员提供,Hb-NJ从美国引进;斯氏属线虫包括小卷蛾斯氏线虫(S.carpocapsae,Sc-All)、格氏斯氏线虫(S.glaseri,Sg-NC)、海滨斯氏线虫(S.litorale,Sl-HBN)及芫菁夜蛾斯氏线虫(S.feltiae)4个品系(Sf-IGA,Sf-QTH,Sf-MRS,Sf-Gansu和Sf-SN),其中Sf-IGA、Sf-QTH、Sf-MRS和Sl-HBN采集分别来自黑龙江哈尔滨市、七台河市、帽儿山和哈尔滨市,Sf-Gansu由甘肃农业大学刘长仲教授提供,Sc-All、Sg-NC和Sf-SN引自美国。参试线虫在实验室的保存时间见表1。线虫从采集的土壤样品中用活体大蜡螟(Galleriamellonella)诱集法分离获得[17],再用活体大蜡螟纯化培养,纯化后的线虫利用潜水层法储藏在10 ℃冰箱中30 d内备用。
1.2 线虫DNA提取、PCR扩增和测序
线虫DNA提取和PCR扩增按照李春杰等[23]的方法略有改动。挑取每个储存样品的活体线虫3~5条,放入带有10 μl裂解液(同等体积混合的10x PCR 缓冲液和20 mg·ml-1蛋白酶K)的载玻片上。于显微镜下利用眼科手术刀将虫体尽可能的切碎,然后将约8 μl的虫体悬液转移至PCR管中。随后把PCR管放入-80 ℃冰箱冷冻处理30 min,取出样品放入PCR仪中在65 ℃反应90 min,样品再95 ℃处理10 min,以使蛋白酶K失活,然后在室温下12 000 rpm离心5 min,上清液作为DNA模板用于PCR扩增,保存于-20 ℃备用。
根据检测线虫的通用引物ITS和D2-D3对线虫rDNA所在区域进行扩增。ITS的引物序列[9]:18S-F 5′-TTGATTACGTCCCTGCCCTTT-3′;26S-R 5′-TTTCACTCGCCGTTACTAAGG-3′,28S-rDNA-D2D3的引物序列[10]:D2A-F 5′ -ACAAGTACCGTGAGGGAAAGTTG-3′;D3B-R 5′-TCGGAAGGAACCAGCTACT A-3′。PCR反应总体系是50 μl,包括8 μl DNA模板,5 μl 10x PCR 缓冲液,1 μl 10nM dNTPs,上游和下游引物各1 μl,加水至50 μl。PCR扩增40个循环,预变性94 ℃ 4 min,每个循环变性94 ℃ 30 s,退火58 ℃ 45 s,延伸72 ℃ 50 s,40个循环后延伸72 ℃ 10 min。然后取5 μl PCR产物在1X TAE缓冲液,1%琼脂糖凝胶上电泳验证,电压85 V。扩增产物大小根据已知标准大小100 bp分子标记验证后,剩余的PCR产物送到公司测序。
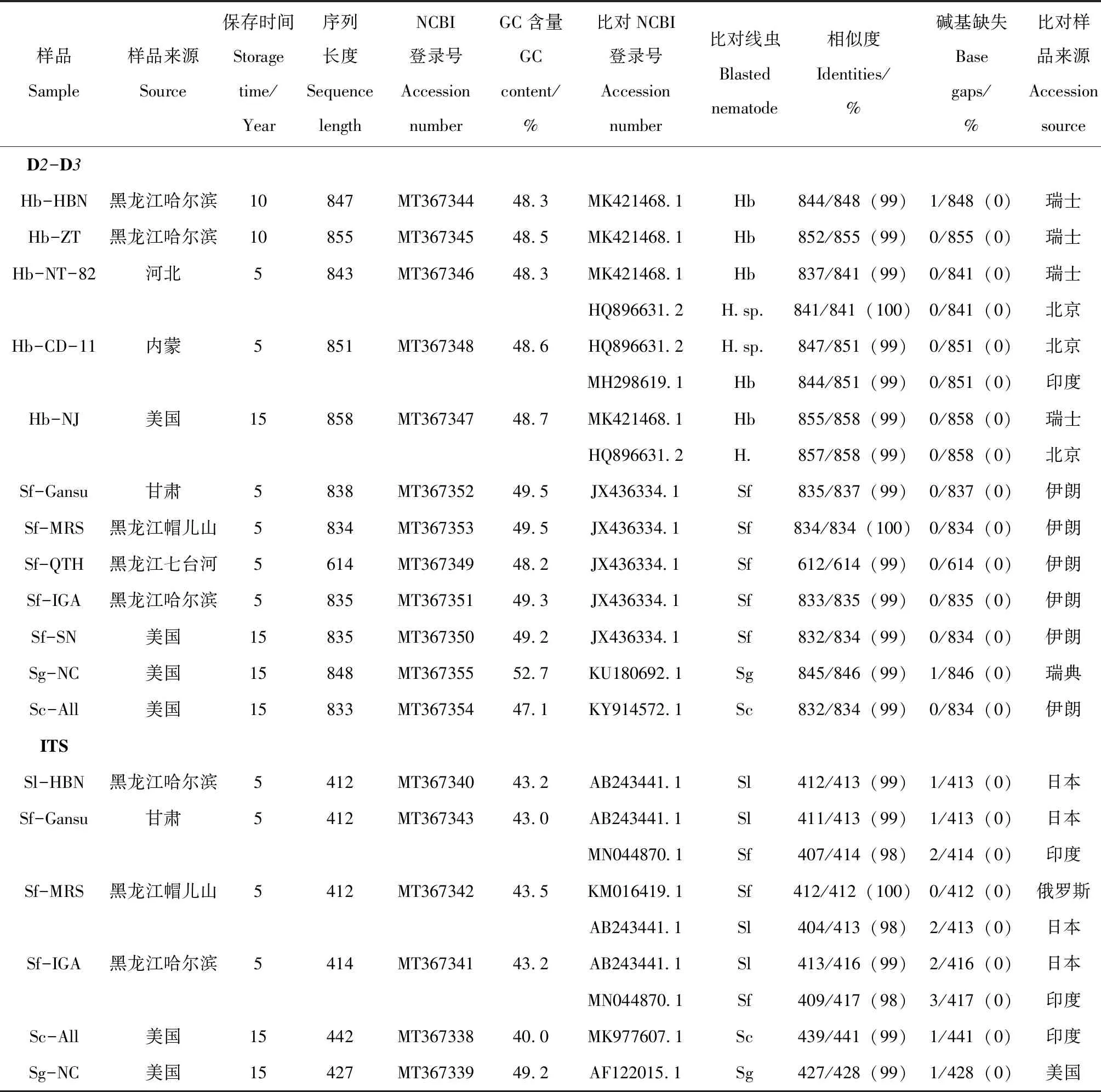
表1 线虫样品来源、序列长度和碱基GC含量及线虫序列与NCBI数据库比对结果Table 1 The sources of collected nematodes,the sequence length and GC content,and the comparison with NCBI databank
1.3 遗传进化树的构建
所测的序列利用BIOEDIT v7.2.5软件进行序列编辑,GC含量的计算方法是(G+C)/(A+T+C+G)*100。利用NCBI数据库BLASTn(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对检测线虫序列,每个比对序列选取相似度列在前1-3位的同源序列,然后下载这些rDNA序列,和所测序列一起利用MEGA X软件[24]中的ClustalW程序。首先对这些序列进行多重比较,利用MEGA X进行进化树分析[24],用UPGMA方法构建系统进化树[25]。从1000个重复中推断出的bootstrap consensus tree被用来代表所分析的分类单元的进化历史[26]。进化距离用Maximum Composite Likelihood method方法[27]计算,单位是每个位点的碱基代换数,分析消除所有包含缺口和缺失数据的位点。
2 结果与分析
2.1 序列长度和GC含量
对12个线虫样品28S rDAN的D2-D3区域测序和序列编辑,除了Sf-QTH (614 bp)例外,其它每个样品的序列长度在833 bp~858 bp内(表1),碱基GC含量是47.1%~52.7%;每个种之间的GC含量是稳定的。对6个斯氏属Steinernema的种和品系的ITS测序得到了412 bp~427 bp的长度,S.carpocapsae的碱基GC含量是40.0%,S.glaseri的GC含量是49.2%,S.litorale和S.feltiae的GC含量非常接近,大约在43.2%左右(表1)。这些序列已被征订到GenBank,每个线虫样品扩增的rDNA序列在NCBI 基因库中的登录号为MT367338-MT367355,表1中已列出。
2.2 线虫序列与NCBI数据库比对
每个样品的D2-D3区域序列与数据库比对结果(表1),其相似度达到99%~100%,表明这些分子鉴定和形态学鉴定的结果基本一致。ITS分子鉴定结果表明所测序列主要包括18S-ITS1-5.8S,所测S.litorale和S.feltiae的序列与基因库中的相似度达到98%~100%,Sc-All和Sg-NC分别和所属种的序列达到99%以上。表1中列出了与每个序列最为相近的前1~2个GenBank的登录号,并列出了比对的长度和相似度、碱基缺失和比对样品的来源。这些比对的序列与所测线虫一起进行了进化树的构建。
2.3 基于D2-D3-rDNA和ITS-rDNA遗传进化树的构建和种内序列的比较
利用MEGA X构建D2-D3和ITS1遗传进化树如图1和图2所示。D2-D3进化树很清晰地表明形态学鉴定和分子鉴定的结果一致(图1),而且能够显示出这些线虫种或品系间的差异,从Hb-CD-11、Hb-NT-82、Hb-HBN、Hb-ZT、Hb-NJ可以看出同种不同品系之间在遗传上也存在距离的差异。序列比对结果表明,Hb-CD-11与Hb-HBN的相似度是99.3%,与Hb-NJ和Hb-ZT的相似度是99.6%,与Hb-NT-82的相似度是99.8%,共有5个碱基序列的差异(图3)。其它同种不同分离地的品系有一定的距离,例如,Sf-MRS与其它S.feltiae(Sf-IGA,Sf-SN,Sf-NC,Sf-Gansu)相比距离不同,进一步比对种内D2-D3序列,结果显示比对区间Sf-MRS与其它三个序列相似度达到99.7%~99.8%,仅有2个碱基不同(112C/T,390C/T)(图3)。ITS1进化树明确地区分了Sg-NC和Sc-All,但对S.litorale和S.feltiae两个种交叉在一起,难以区分(图2),Sl-HBN与Sf-Gansu和Sf-IGA的相似度分别达到99.8%和99.5%,而Sf-MRS与这三个序列相似度大约是98.1%,共有8个碱基序列与Sl-HBN、Sf-Gansu和Sf-IGA不同(图3)。通过比对基因库中报道的这两个ITS序列发现,S.litorale和S.feltiae的18S-ITS1-5.8S序列同源性高达97.3~100%,而ITS2区域的同源性只有88%左右,因此ITS2区域能够灵敏区分这两个相近的种。
3 讨 论
该研究对实验室所收集和保存5~15年的昆虫病原线虫进行了分子鉴定,结果表明线虫28S rDNA的D2-D3扩增片段能够有效的区分不同种的线虫,而且序列很清晰地区分Steinernemaspp.和Heterorhabditissp.两个属为不同的分类群(图1)。ITS1 rDNA序列能够有效的区分S.glaseri和S.carpocapsae,但是不能有效的区分S.litorale和S.feltiae,因为本试验得到的数据只是ITS1序列,长度仅为412 bp~427 bp,包括18S-ITS1-5.8S,而不包括ITS2。根据GenBank中比对的同源序列发现,S.litoraleITS的序列长度大约是1 000 bp(AB243441.1),ITS1序列在S.litorale和S.feltiae中同源性很高,而ITS2的序列同源性只有88%左右,因此如果区分这两个种,需要测序ITS2能够区分这两个相近种。本研究也发现了同种不同分离地的品系有一定的遗传距离,距离不同是由于个别碱基序列不同而形成的。本研究利用了常见ITS和28S rDNA引物(D2-D3),rDNA区域被利用分类的其它引物也有报道[28-32],另外,线粒体基因编码的细胞色素氧化酶I亚基(COI)也被用于线虫鉴定[33]。
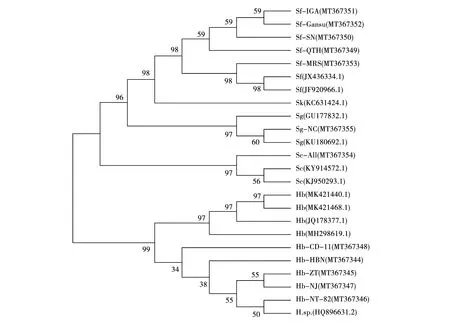
注:Hb代表Heterorhabditis bacteriphora;H.sp.代表Heterorhabditis sp.;Sf代表Steinernema feltiae;Sk代表S.kraussei,Sc代表S.carpocapsae;Sg代表S.glaseri。Note:Hb:Heterorhabditis bacteriphora;H.sp.:Heterorhabditis sp.;Sf:Steinernema feltiae;Sk:S.kraussei;Sc:S.carpocapsae;Sg:S.glaseri.图1. 12种昆虫病原线虫28S rDNA的D2-D3区域系统发育树Fig.1 Phylogenetic tree of D2-D3 region of 28S rDNA among 12 entomopathogenic nematodes
昆虫病原线虫一些种类GC含量有明显不同,例如,线虫S.glaseri的28S rDNA D2-D3序列的GC含量无论是ITS还是D2-D3区域明显高于其它斯氏属线虫,而S.carpocapsae的GC含量明显低于其它斯氏属线虫。有趣的是,S.glaseri的体长明显大于其它Steinernemaspp.,S.carpocapsae的体长明显小于其它几个斯氏线虫,S.litorale和S.feltiae的体长非常相近[34],难以区分,而GC含量也非常接近,可以看出分子手段和形态学鉴定结果有很好的一致性。形态学的鉴定非常重要,但费时费力,该研究表明分子方法可以初步快速确定未知线虫的属或种,结合形态学方法更准确地鉴定到种和品系,也可以用分子方法快速验证已知线虫的属或种。另外,我们利用PCR产物进行测序,没有克隆ITS和D2-D3的完整序列,但这些数据足以准确鉴定昆虫病原线虫到种,且根据序列碱基差异还能表明同种不同品系间存在DNA差异。而克隆这些基因从时间上要求更长,技术和成本上都要求很高,因此利用PCR产物直接测序是非常经济有效的。

注:Hb代表Heterorhabditis bacteriphora;Sl代表Steinernema.Litorale;Sf代表S.feltiae;Sc代表S.carpocapsae;Sg代表S.glaseri。Note:Hb:Heterorhabditis bacteriphora;Sl:Steinernema.Litorale;Sf:S.feltiae;Sc:S.carpocapsae;Sg:S.glaseri.图2 6种昆虫病原线虫18S-28S核糖体rDNA的ITS区域系统发育树Fig.2 Phylogenetic tree of ITS region of 18-28S rDNA among 6 entomopathogenic nematodes

注:序列左右两端数字显示两端碱基在所测序列中的位置。Note:The numbers in the two ends of each sequence indicate the positions of the two bases in each sequence of the sample.图3 H.bacteriophoris(Hb)、S.feltiae(Sf)和S.litorale(Sl)D2-D3和ITS rDNA区域变异序列比对Fig.3 The alignment of the sequence variation of D2-D3 and ITSrDNA region of Heterorhabditis bacteriophoris (Hb),Steinernema feltiae(Sf) and S.litorale (Sl)
目前,我们在黑龙江省内分离到的线虫多数是S.feltiae,检出率明显高于其它种,这个线虫比较耐低温,在俄罗斯、加拿大、芬兰、瑞典、北爱尔兰等多国寒冷地区均有分布[35],该线虫发生在我国东北,与前人报道的寒冷气候比较相符。分离本地昆虫病原线虫资源,对于控制本地害虫非常重要。对于分布在寒带和温带的昆虫病原线虫,只有安全越冬,其种群才能得以存活和繁衍。由于本土线虫群体对本土适应性强,有利于线虫在土壤中定居、种群建立以及发挥持效性,所以筛选本土昆虫病原线虫是提高其防治效果的最佳途径。因此,线虫S.feltiae将对低温土壤害虫的生物防治应用提供很好的材料。因种内不同分离地的品系形态上没有差异,但对寄主和寄主栖境的识别能力有差异,对寄主的侵染能力也有差异[20-22],本研究所检测到种内rDNA的序列差异与它们对寄主毒力的不同可能有一定关系,但相关性还需要进一步研究,种内碱基变异将为线虫的进化提供理论依据。

