气道滴注与腹腔注射脂多糖建立小鼠急性肺损伤模型的效果比较
顾 玮,张 丽,刘国权(蚌埠医学院检验医学系生化与分子生物学教研室,蚌埠 33030;安徽省癌症转化医学重点实验室;通信作者,E-mail:guoquanliu@bbmc.edu.cn)
急性肺损伤(acute lung injury,ALI)是各种致伤因素造成的肺弥漫性炎症损伤,重度ALI会发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),临床表现为严重低氧血症和弥漫性肺泡损伤,是一种临床常见危重症,死亡率高达40%[1,2]。目前,ALI的发病机制尚未阐明,动物模型的建立与评估对研究ALI病理生理改变、发病病因及发病机制至关重要[3,4]。
严重感染等各种诱因可引起ALI,尤其是细菌感染(多为革兰阴性细菌)[5]。脂多糖(lipopolysaccharides,LPS)又称内毒素,是革兰氏阴性细菌细胞壁外壁主要组成成分,在炎症反应中起重要作用,被广泛用于ALI模型的建立[6]。气道滴注LPS直接进入肺可建立感染后的肺内ALI模型[7],腹腔注射LPS可用于模拟细菌感染所导致继发性肺部损伤,建立肺外ALI模型[8]。
本研究采用气道滴注法和腹腔注射法建立肺内和肺外ALI小鼠模型,对比两种模型病理生理、炎性因子、肺功能等指标变化进行客观、系统的评价,为更有效的肺损伤模型提供实验依据。
1 材料与方法
1.1 实验动物
8周龄清洁级C57BL/6J小鼠,雌雄各18只(13-20 g),分为4组,每组9只,购于济南朋悦实验动物繁育有限公司,由蚌埠医学院实验动物中心饲养。
1.2 主要试剂
异戊巴比妥钠购于上海新亚药业有限公司,LPS购于Sigma-Aldrich(上海)贸易有限公司,RNA提取和逆转录试剂盒购于北京天根生化科技有限公司,荧光定量试剂盒购于南京诺唯赞生物科技有限公司,迪夫快速染色液试剂盒购于北京索莱宝科技有限公司,BCA蛋白定量试剂盒购于上海碧云天生物技术有限公司,引物由上海生工生物工程有限公司合成。
1.3 ALI小鼠模型制备
36只C57BL/6J小鼠随机分为四组,PBS气道滴注组、LPS气道滴注组、PBS腹腔注射组和LPS腹腔注射组(每组9只)。气道滴注法:腹腔注射异戊巴比妥钠(10 mg/kg)麻醉小鼠,小鼠四肢被固定于泡沫板上,于颈部做一纵行切口,暴露气管。用1 ml注射器经气管壁插入气管内,分别将LPS(5 mg/kg)或等量体积PBS快速滴注小鼠气管中。气管滴注完成后将泡沫板与桌面平行并呈60°-70°倾斜角,静置5 min,注射后4 h收集样本。腹腔注射法:用注射器分别将LPS(5 mg/kg)或等量体积PBS快速注入小鼠腹腔,注射后24 h收集样本。
1.4 肺泡灌洗液(BALF)蛋白浓度测定和染色
颈椎脱臼法处死小鼠,固定于泡沫板,小鼠头部后仰使气管暴露,分别收集肺泡灌洗液和肺组织。小鼠气管暴露后做一切口,用一次性静脉留置针对其进行气管插管,取PBS用注射器灌洗支气管肺泡。用PBS冲洗双侧支气管肺泡,重复3次,回收BALF,1 000 r/min离心5 min,收集上清液和细胞沉淀,分别测定总蛋白浓度和白细胞迪夫染色。
1.5 肺湿/干质量(W/D)比值测定
将肺脏组织完全取出,用手术剪小心去除残存支气管和结缔组织,置于超纯水中清洗,吸水纸拭干水分,称湿重。将组织置于60 ℃恒温箱干燥72 h后,称干重,计算并统计湿/干质量(W/D)比值。
1.6 肺组织病理学观察
分离小鼠肺组织置于5%多聚甲醛溶液中,石蜡包埋,切片,苏木素-伊红(HE)染色,观察肺组织病理学变化,拍片保存。
1.7 肺组织炎性因子检测
提取小鼠肺脏组织RNA,反转录cDNA,实时荧光定量PCR法(南京诺唯赞生物科技有限公司)分别测定白介素-6(IL-6)、细胞间黏附分子-1(ICAM-1)、单核细胞趋化因子-1(MCP-1)mRNA表达量,引物序列见表1。利用2-ΔΔCt计算炎性因子mRNA表达水平。

表1 RT-PCR引物序列
1.8 小鼠肺通气实验
麻醉后的小鼠固定于操作台,在小鼠颈部做一纵行切口,剥离周围组织,暴露气管,做切口后连接于小动物肺功能仪(SCIREQ公司FX2),收集呼吸频率、潮气量、每分钟通气、吸气时间、呼气时间、1/2潮气量呼气流量、2/3潮气量所需时间、最大吸气流量、最大呼气流量、呼吸间歇和增强的呼吸间歇等呼吸数据。
1.9 统计学分析
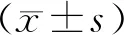
2 结果
2.1 实验动物一般状况
对小鼠的活动状态进行观察,气道滴注LPS组存活小鼠精神沉郁、四肢无力,死亡率22.2%。腹腔注射LPS组存活小鼠精神和活动状态均较差,死亡率33.3%。两种方法的对照组小鼠精神和活动状态均良好。
2.2 BALF总蛋白浓度变化和细胞染色
BALF总蛋白浓度变化可反映肺部血气屏障的完整性,将回收的小鼠肺部BALF离心后取上清液,测定BALF总蛋白浓度变化。结果发现,腹腔注射LPS组与腹腔注射PBS组相比BALF中总蛋白浓度显著升高(P<0.01),气道滴注LPS组与气道滴注PBS组相比BALF中总蛋白浓度显著升高(P<0.01),且气道滴注LPS组支气管肺泡灌洗液中的总蛋白浓度高于腹腔注射LPS组(P<0.05,见图1)。
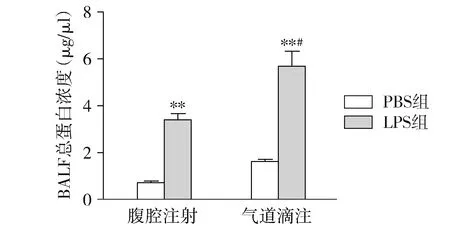
与PBS组比较,**P<0.01;与腹腔注射LPS组比较,#P<0.05图1 四组支气管肺泡灌洗液中的总蛋白浓度比较Figure 1 Total protein concentration in bronchoalveolar lavage fluid in four groups
将BALF离心后,取沉淀细胞进行迪夫染色,选取5个镜下视野,对中性粒细胞计数。结果显示:与腹腔注射PBS组相比,腹腔注射LPS组中性粒细胞数显著增多(P<0.01),与气道滴注PBS组相比,气道滴注LPS组的中性粒细胞数显著增多(P<0.001,见图2)。气道滴注LPS组的中性粒细胞数与腹腔注射LPS相比有增加的趋势,表明气道滴注法可诱导更多中性粒细胞的浸润。
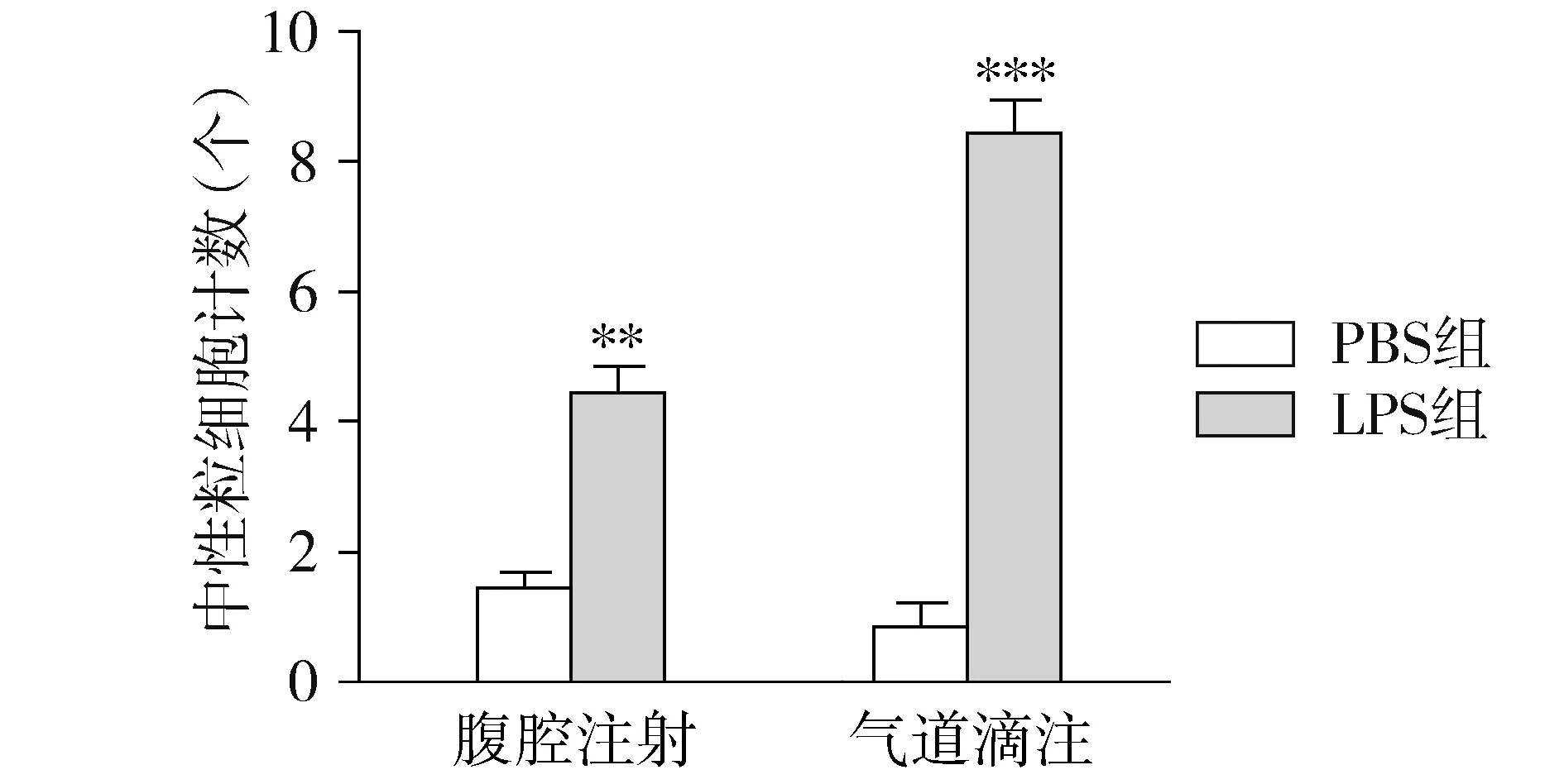
与对应的PBS组比较,**P<0.01,***P<0.001图2 四组支气管肺泡灌洗液中的中性粒细胞数比较Figure 2 Neutrophil counts in bronchoalveolar lavage fluid in four groups
2.3 肺组织W/D比值测定
肺组织W/D比值是反映小鼠肺脏水肿严重程度的一个重要指标,可评估肺水肿的严重程度。与气道滴注PBS组相比,气道滴注LPS组的W/D比值显著升高(P<0.001,见图3),表明气道滴注法可造成小鼠的肺水肿。
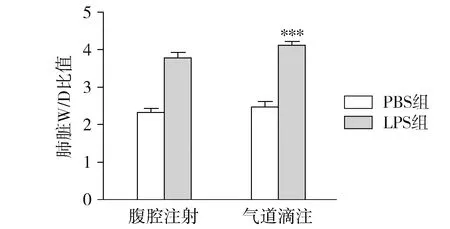
与相应的PBS组比较,***P<0.001图3 四组肺组织湿/干质量比值Figure 3 Lung tissue wet/dry weight ratio in four groups
2.4 肺组织病理学观察
将小鼠的肺组织通过病理学HE染色,结果显示:PBS对照组肺泡结构完整,肺泡腔清晰、完整,肺泡隔未见明显水肿和炎性细胞浸润(见图4A和C)。腹腔注射LPS组可见肺间质及肺泡腔内有红细胞渗出,炎性细胞浸润,肺泡壁增厚,肺组织可见少量充血、水肿(见图4B)。气道滴注LPS组可见肺间质及肺泡腔内大量红细胞渗出和炎性细胞的浸润,肺泡壁明显增厚,肺组织可见大量充血、水肿(见图4D)。
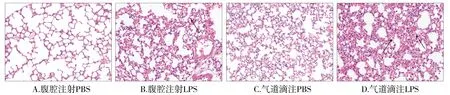
图4 急性肺损伤小鼠肺组织苏木素伊红染色 (×200)Figure 4 HE staining of lung tissue in acute lung injury mice (×200)
2.5 肺组织炎性因子表达水平比较
收集气道滴注组和腹腔注射组的肺组织,提取RNA,反转录为DNA,分别检测肺组织炎性因子的表达水平,结果显示:与腹腔注射LPS组相比,气道滴注LPS组的肺组织炎性因子ICAM-1和IL-6的mRNA表达显著增加(P<0.01-0.001,见图5),MCP-1的mRNA表达有降低的趋势。
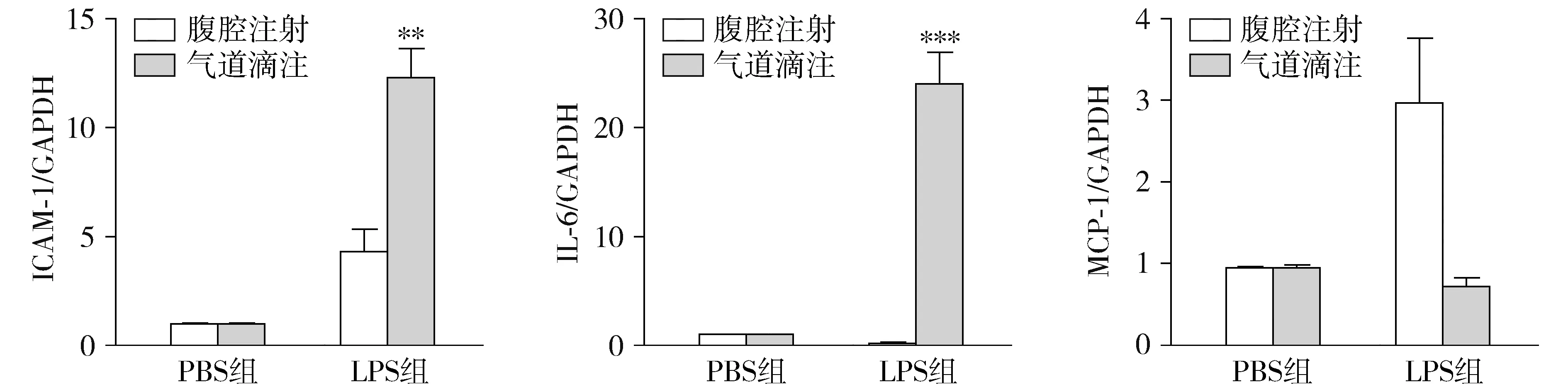
同组与腹腔注射比较,**P<0.01,***P<0.001图5 四组肺组织炎性因子ICAM-1、IL-6和MCP-1的mRNA表达量比较Figure 5 Inflammation factors ICAM-1,IL-6 and MCP-1 mRNA expression in lung tissue in four groups
2.6 肺通气实验
对小鼠进行气道滴注和腹腔注射后,分别进行有创阻抗法检测各项肺功能指标。与相应的PBS组相比,腹腔注射LPS组和气道滴注LPS组的深吸气量增加,呼吸系统弹性明显增加(P<0.01),且气道滴注LPS组的呼吸系统弹性的变化比腹腔注射LPS组明显(P<0.05)。与相应的PBS组相比,腹腔注射LPS组和气道滴注LPS组的中枢气道阻力降低(P<0.05),呼吸系统阻力(Rrs)也呈降低的趋势(P<0.001),且气道滴注LPS组的呼吸系统阻力的降低程度比腹腔注射LPS组明显(P<0.05,见表2)。对肺功能指标检测的结果表明,气道滴注LPS组肺损伤的程度明显高于腹腔注射LPS组。

表2 各组小鼠肺呼吸功能指标的测定
3 讨论
急性肺损伤(ALI)和急性呼吸窘迫综合征(ARDS)具有高发病率和高死亡率等特点,发病机制还不清楚,且缺乏有效的药物,严重危害人类健康。目前,由于伦理学等方面的原因,临床标本的收集存在困难,因此ALI/ARDS动物模型的建立,对深入研究诱导肺损伤进展的机制和对该病临床预防及治疗具有重要意义,为减轻ALI/ARDS造成的肺损伤提供研究思路。
小鼠具有繁殖快、易于饲养、便于操作、价格低廉等优点,适用于大样本的动物实验,广泛用于ALI动物模型的建立[9]。研究表明,LPS致伤4 h后,肺泡腔和间质液淋巴细胞、中性粒细胞聚集,肺泡壁变薄,表现出急性弥漫性肺部炎症特征[10]。TNF-α、IL-1β、IL-6等是ALI炎症反应过程中重要的促炎性因子,在ALI炎症反应和发病过程扮演重要角色[11,12]。现有的动物模型多关注于肺组织学损伤、肺泡毛细血管膜通透性增加及炎症因子等[13],但有关肺生理功能障碍的研究较少[14,15]。陈英华等[16]从组织学水平、细胞学水平、细胞因子水平评价了气道滴入和腹腔注射ALI模型,认为气道滴入可使LPS在气道内分散,刺激导致直接肺损伤,是一种有效的小鼠急性肺损伤模型制备方法,但其对炎性细胞因子的表达水平和肺生理功能障碍等方面未进行系统评价。本研究通过气道滴注和腹腔注射脂多糖分别建立小鼠ALI模型,对这两种模型的效果进行比较。从肺生化指标、肺组织形态、肺组织炎性因子的表达和肺呼吸指标等多角度系统评价小鼠的肺损伤程度,为ALI动物模型的建立提供方法。
本研究通过比较脂多糖气道滴注法与腹腔注射法建立的小鼠ALI模型,发现气道滴注法的小鼠肺组织会出现更为明显的肿胀,部分小鼠肺部表面有明显的出血点,BALF中的总蛋白浓度明显升高、中性粒细胞数目增加,W/D比值显著升高,可诱导更为严重的细胞损伤。HE染色显示,气道滴注法小鼠的肺组织炎性细胞浸润明显,肺组织可见充血、水肿、肺泡膈增厚等。气道滴注法小鼠肺组织炎性因子ICAM-1和IL-6的mRNA表达显著增加,MCP-1的mRNA表达有降低的趋势,腹腔注射法小鼠肺组织中MCP-1 mRNA表达有增加的趋势,这表明气道滴注法和腹腔注射法可能会通过不同的信号通路导致肺内炎症的产生。气道滴注法造成的肺功能障碍更为明显。气道滴注法可通过支气管直接输送LPS至肺泡腔内,通过与肺泡上皮的直接作用,进一步诱导更为明显的急性肺部反应,能够更好地模拟ALI的发病过程。
综上所述,本研究通过比较脂多糖小鼠急性肺损伤模型气道滴注法与腹腔注射法,从病理和生化、炎性细胞因子、肺功能障碍等方面对肺的损伤程度进行系统评价。气道滴注法ALI模型所诱导的急性肺部炎症更加明显,可作为有效的肺损伤模型,用于后续对细菌感染引起的急性肺损伤发病机制的研究。

