LL-37在肺癌组织中的表达及对A549细胞转移和凋亡的影响
李晓霞,张彦坤,安晓颖,郝 蒙,朱桂云,宋会改,徐美丽(河北省胸科医院病理科,石家庄 00000;河北省胸科医院眼科;河北省胸科医院分子生物实验室;河北省胸科医院影像科;河北省胸科医院检验科;通信作者,E-mail:xxw98@6.com)
肺癌仍然是全球癌症相关死亡的最常见原因,因为肺癌的复发率和转移率很高,治疗策略缺乏重大进展[1,2]。非小细胞肺癌(NSCLC)占肺癌病例总数的80%-85%,分为腺癌、大细胞癌和鳞癌[1,3]。虽然近几十年来在早期发现、根治性手术切除和多种治疗方面取得了很大进展,但NSCLC的5年总生存率一般<15%[4,5]。因此,迫切需要了解非小细胞肺癌的侵袭和转移机制,以便更好地个体化治疗。
LL-37是Cathelicidin蛋白N端的37个氨基酸,因其开始的氨基酸分别为L-L而得名。它是Cathelicidin家族中唯一存在于人体的抗菌肽。因此其在体内的作用受到越来越多的重视。LL-37以无活性的前体形式贮存,主要贮存在中性粒细胞的胞浆颗粒内,在白细胞被激活时释放出有活性的抗菌肽。其分子量小、热稳定、水溶性好,而且具有广谱抗菌性。近来研究表明,其在抗感染、免疫调节、促血管生成、抑癌等方面均发挥生物学作用[6-8]。LL-37已被认为是一种既能抑制先天炎症又能抑制免疫的基本抑制剂。LL-37可抑制多种促炎因子的表达,包括IL-6、IL-1α、IL-1β和TNF-α[9,10]。最近,有报道称LL-37可以抑制大肠癌、肾癌、肝癌和结肠癌以及类似疾病的进展。其机制有IL-6/STAT3信号通路抑制、pSmad3C/P21抑瘤信号、β-catenin抑制和CD57NK募集。然而,LL-37在非小细胞肺癌中是否也有抗肿瘤作用尚不清楚。本研究旨在探讨LL-37在NSCLC中的表达及对A549细胞转移和凋亡的作用。
1 材料与方法
1.1 临床标本的收集
2018年7月至2019年9月共有40例经组织学证实的非小细胞肺癌患者入选本研究。入选的所有患者在采集样本前接受过任何抗癌治疗。NSCLC组织学分型依据世界卫生组织(WHO)标准,分期依据国际癌症控制联盟肿瘤淋巴结转移分类(TNM)(第7版)。选择40名年龄和性别匹配的健康人作为健康对照。采集非小细胞肺癌患者和健康对照者的空腹外周静脉血。采用酶联免疫吸附试验严格按照生产厂家说明书检测血浆LL-37的表达;每例标本包括一对配对的非小细胞肺癌组织和邻近的正常肺组织(距肿瘤≥5 cm)。术后1 h内取材。每份标本中,一半立即在液氮中闪速冷冻,然后在-80 ℃冷冻,直到进行核酸和蛋白质提取,其余的用福尔马林固定进行免疫组化。河北省胸科医院研究伦理委员会批准了本研究,并征得所有参与者和健康对照的书面知情同意。
1.2 免疫组化法检测NSCLC患者组织中LL-37的表达水平
分析由两位独立的病理学家以盲法进行。用Leica DM IRB倒置研究显微镜在低倍视野(100倍)筛选组织切片,在高倍视野(400倍)筛选出5个最具代表性的视野。根据阳性细胞百分率和染色强度定量LL-37密度。根据阳性细胞百分率对染色程度进行评分:0分,<5%;1分,5%-25%;2分,25%-50%;3分,>50%。染色强度分为:0分,无染色;1分,弱染色(浅黄色);2分,中度染色(棕色);3分,强染色(黄褐色)。LL-37表达的最终评分以阳性百分率×染色强度评分计算,0-1分为阴性,+为2-3分,++为4-6分,+为7-9分。当两位病理学家之间存在差异时,使用平均得分。最终染色评分≥4分的肿瘤为LL-37高表达组。
1.3 细胞株和细胞培养
人非小细胞肺癌A549细胞系保存在我院生物技术治疗中心。A549细胞系在Dulbecco的改良Eagle培养基中培养:营养混合物F-12(DMEM/F-12)中添加1%青霉素/链霉素和10%胎牛血清,在5%CO2的加湿培养箱中保持在37 ℃。将LL-37加入A549细胞培养液中。
1.4 主要仪器和试剂
Leica DM IRB倒置研究显微镜(德国Leica Microsystems);10%胎牛血清(美国Life Technologies);LL-37(美国明尼阿波利斯R&D系统公司);A549人肺癌细胞系和人脐静脉内皮细胞(HUVEC)均取自美国典型培养库(美国ATCC细胞库);DMEM(上海GIBCO公司);cDNA开放阅读框(Origene Technologies,中国,北京);Transwell系统(美国康宁);Matrigel胶水(R&D系统);1%结晶紫(中国北京,Solarbio生命科学);裂解缓冲液(上海Beyotime Biotechnology);BCA分析试剂盒(Beyotime Biotechnology);聚偏氟乙烯膜(Solarbio Life Sciences);抗体(英国Abcam);G辣根过氧化物酶(Beyotime Biotechnology);电化学发光流体(Solarbio Life Sciences);Gel Dox XR系统(上海柯达);TRIzol试剂(中国大连塔卡拉);GeneAmp PCR系统9700(美国ABI);RT试剂盒(日本Takara);SYBRGreen PCR试剂盒(美国Invitrogen)。
1.5 细胞转染

1.6 划痕愈合实验检测A549细胞的迁移
转染48 h后,将PC细胞接种于6孔板中,每孔1×106个细胞。当细胞融合率达到95%左右时,用20 μl的微吸管尖端在6孔板上进行垂直划痕。剩余细胞经D-Hanks液洗涤后,用无血清培养基进一步培养。分别于划痕后0 h和24 h取材,在相差显微镜下随机选择3个视野(×100),比较各组间细胞迁移的差异。
1.7 Transwell检测A549细胞的侵袭
用Transwell系统测定A549细胞的侵袭能力。将Matrigel胶水稀释并加入到Transwell上部腔室中。将细胞重新悬浮在无血清培养基中,然后在上部小室中进行培养。完整的培养基覆盖了底部的腔室。在37 ℃孵育24 h后,膜上的细胞被清除。将迁移到膜底部的横穿细胞固定,用1%结晶紫染色3 min。在×200倍显微镜下计数穿过基质层的细胞,取随机视野的平均数。
1.8 Western blot检测凋亡相关蛋白的表达
用放射免疫沉淀分析裂解缓冲液裂解培养细胞的总蛋白。使用BCA分析试剂盒测定蛋白质浓度。在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳上分离等量的蛋白质,转移到聚偏氟乙烯膜上,然后与抗Caspase-3(1 ∶1 000)、Bax(1 ∶1 000)、Bcl2(1 ∶1 000)和GAPDH(1 ∶2 000)的抗体反应。然后用三缓冲液+吐温20洗涤蛋白质,并与山羊抗兔免疫球蛋白G辣根过氧化物酶孵育30 min。使用电化学发光流体对条带进行可视化。照片由Gel Dox XR系统拍摄。
1.9 酶联免疫吸附法检测LL-37在NSCLC患者血浆中的表达
用TRIzol试剂从A549细胞中提取总RNA。根据说明书和GeneAmp PCR系统9700使用RT试剂盒进行逆转录(RT)。使用白金SYBRGreen PCR试剂盒(Invitrogen,Carlsad,CA,USA)进行实时PCR扩增。使用7500快速实时PCR系统(美国加州福斯特城的应用生物系统)制备定量PCR(QPCR)。PCR产物经熔融曲线分析验证。用2-ΔΔCt法计算靶基因的相对信使核糖核酸水平。
1.10 统计方法
使用SPSS版本17.0(SPSS Inc.,伊利诺伊州芝加哥,美国)、GraphPad Prism软件(加利福尼亚州La Jolla)、Adobe Photoshop CS4(加利福尼亚州圣何塞)和Image J软件(NIH)执行所有统计分析。数据以均数±标准差表示。两组间的比较采用t检验进行分析。多组间比较采用单因素方差分析。P<0.05被认为差异具有统计学意义。
2 结果
2.1 非小细胞肺癌患者血浆和组织中LL-37表达降低及其与病情进展的关系
数据显示非小细胞肺癌患者血浆LL-37表达较健康对照组降低(P<0.05,见图1A)。另外,采用免疫组化法检测NSCLC组织中LL-37的表达,结果显示,与癌旁组织相比,NSCLC组织中的LL-37的表达下调(见图1B)。进一步分析非小细胞肺癌患者血浆LL-37表达与临床特征的关系,LL-37低表达与晚期TNM分期显著相关(P=0.034,见表1)。
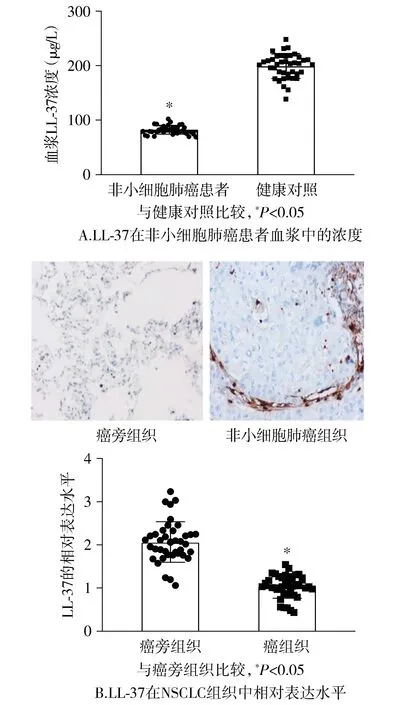
图1 LL-37在非小细胞肺癌患者组织和血浆中的表达Figure 1 Expression of LL-37 in tissue and plasma of patients with non-small cell lung cancer
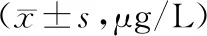
表1 非小细胞肺癌患者血浆LL-37表达与临床特征的关系
2.2 LL-37剂量依赖性地抑制A549细胞的侵袭和迁移
为证实LL-37在非小细胞肺癌(NSCLC)中的作用,检测了不同浓度的LL-37对人NSCLC A549细胞的侵袭和迁移作用。LL-37对A549细胞的迁移具有剂量依赖性抑制作用(见图2),500 ng/ml时抑制效率为(10±1)%,对照组为(50±5)%。LL-37对A549细胞侵袭的抑制作用呈剂量依赖性(P<0.05,见图3),500 ng/ml时抑制效率为(50±5)%,对照组为(100±10)%。
2.3 LL-37以剂量依赖方式促进A549细胞的凋亡
Western blot检测不同LL-37浓度下Bax、Bcl-2和caspase-3的表达,结果显示,LL-37对A549细胞的凋亡具有剂量依赖性促进作用,随着LL-37浓度的上调,Bax和caspase-3的表达显著上调,而Bcl-2的水平显著下调(P<0.01-0.001,见图4)。
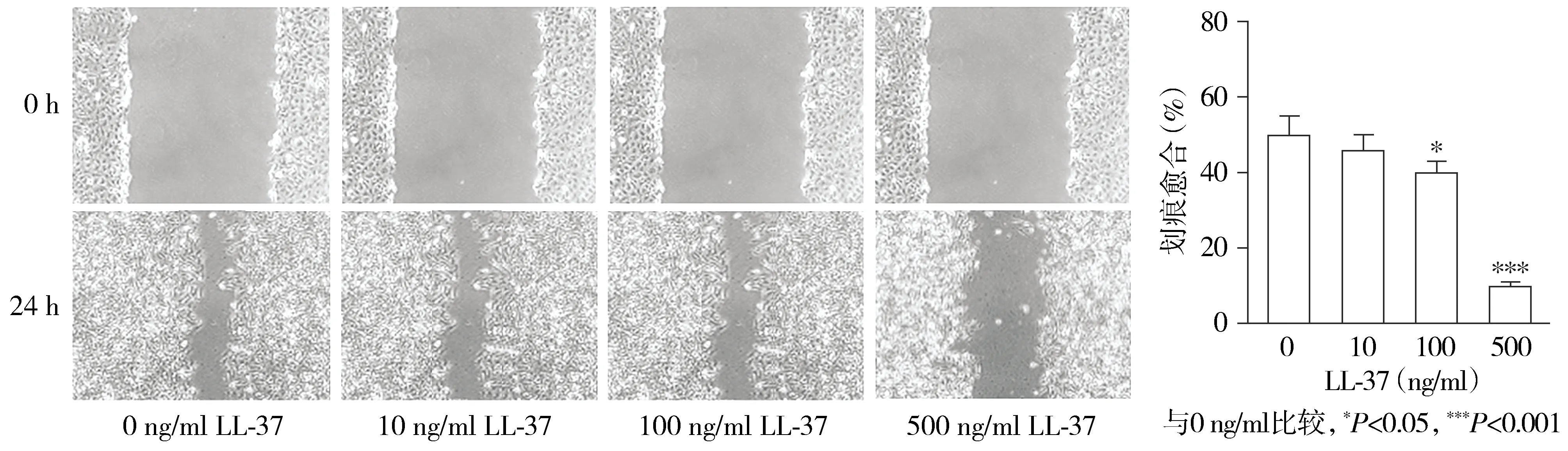
图2 LL-37对非小细胞肺癌迁移的抑制作用 (×100)Figure 2 The inhibitory effect of LL-37 on A549 cell migration in non-small cell lung cancer (×100)
图3 LL-37对非小细胞肺癌(NSCLC)侵袭的抑制作用 (×100)Figure 3 Inhibitory effect of LL-37 on A549 cell invasion in non-small cell lung cancer (×100)
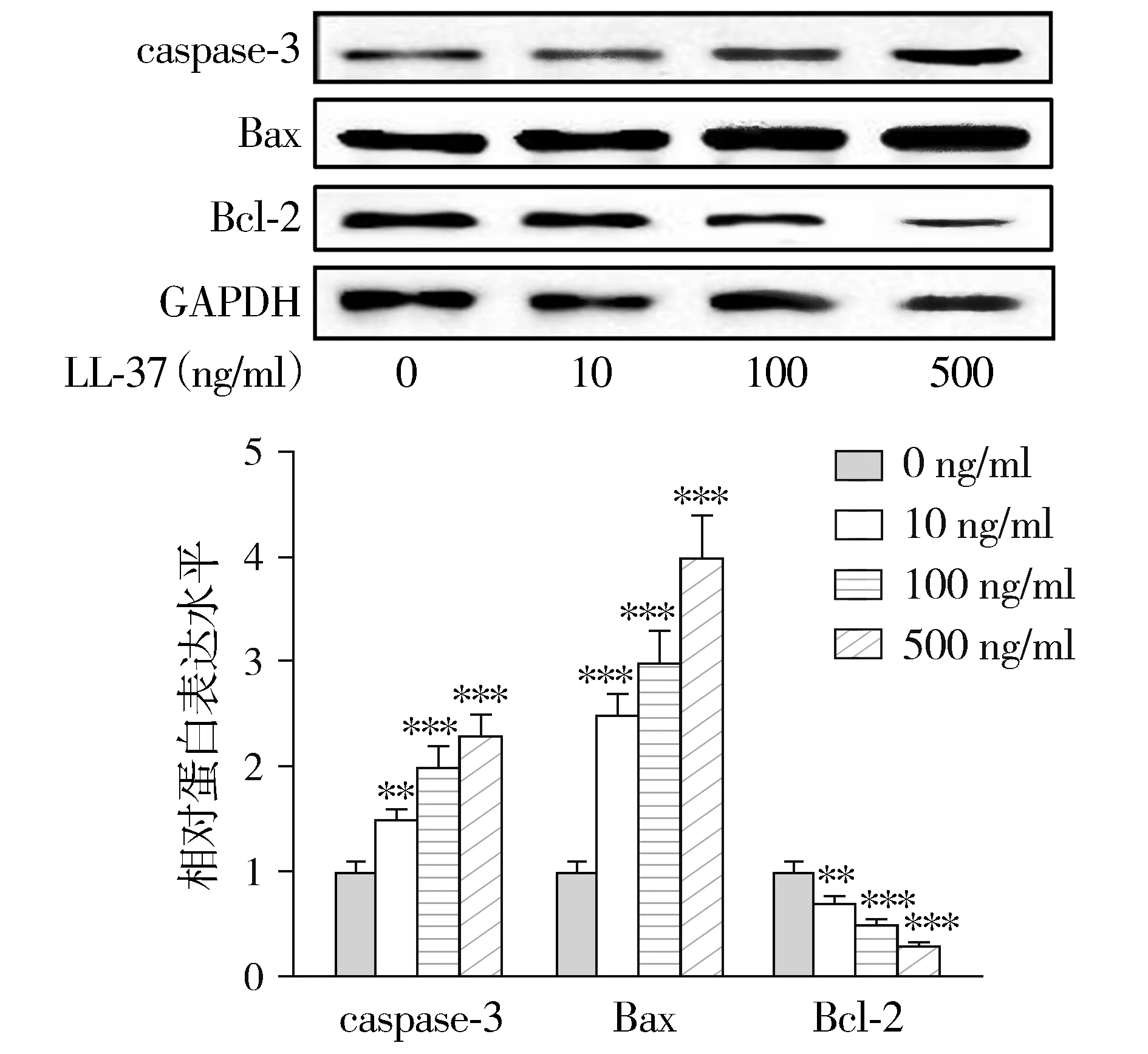
与0 ng/ml比较,**P<0.01,***P<0.001图4 不同浓度的LL-37对A549细胞中凋亡相关蛋白水平的影响Figure 4 Effects of different concentrations of LL-37 on the level of apoptosis-related proteins in A549 cells
3 讨论
LL-37已被确认为先天炎症和免疫反应的天然抑制因子[11]。它在炎症组织中高表达,抑制过度的炎症反应。最近的研究表明,LL-37在小鼠纤维肉瘤、人肝癌和宫颈癌的肿瘤进展中起到保护作用[12-14]。然而,目前还没有关于LL-37是否影响NSCLC的发生、发展和预后的报道。本研究首先探讨了LL-37蛋白在非小细胞肺癌患者中的表达模式及其临床意义。免疫组化染色发现LL-37在非肿瘤组织中表达,而在肺癌组织中表达下调。Zhao等[13]研究报道,LL-37在HCC中的表达水平与肿瘤大小呈显著负相关,提示LL-37可能在肿瘤微环境中抑制肿瘤生长。越来越多的证据表明,LL-37具有很强的抗炎和抗免疫作用。最近的研究表明,LL-37在多种人类肿瘤的发生、发展中起保护作用[15-18]。然而,关于血浆LL-37的表达是否影响非小细胞肺癌患者的临床特征以及其对人NSCLC A549细胞的抗侵袭和抗转移作用机制的研究很少。在本研究中,我们发现与健康对照组相比,非小细胞肺癌患者血浆LL-37的表达显著降低。进一步分析表明,LL-37在NSCLC患者血浆内的低表达与TNM分期有关,提示LL-37可能在NSCLC的发生发展中起抑制作用。
在本研究中我们发现LL-37抑制A549细胞的侵袭和迁移,促进细胞的凋亡,且呈剂量依赖性。然而,与我们的发现相反,有报道称,宫颈癌细胞系过表达LL-37抑制细胞增殖和侵袭[14]。由于宫颈癌与人乳头瘤病毒(HPV)感染和机体慢性炎症有关[19,20],而慢性炎症与肿瘤发生密切相关[21],提示LL-37在不同肿瘤中可能发挥不同的作用。
综上所述,我们确定LL-37在NSCLC患者血浆中下调,并与肿瘤TNM分期呈负相关。LL-37能够抑制A549细胞的迁移和侵袭,促进细胞的凋亡。之前的研究显示,LL-37可能通过抑制IL-6的表达,抑制NSCLC的侵袭转移或部分抑制STAT3的活化,降低EMT的表达[22]。因此,LL-37不仅可以作为天然免疫和炎症反应的基础抑制剂发挥作用,而且可以作为一种潜在的新的肿瘤抑制因子在非小细胞肺癌中发挥作用。然而,LL-37在非小细胞肺癌中的机制需要进一步实验去探讨。

