浅谈“工艺流程题”中pH 的调节
◇ 河南 王清泉
高考改革的核心是由知识的传授转化为核心素养的培养,由教学生“考高分”转化为培养高能学生“创高分”.“工艺流程题”符合核心素养的考查要求,已经成为化学试题的一道亮丽的风景.如何引导学生分析解答此类试题的方法,提高运用知识解决实际问题的能力,成为高考备考需要进行深入研究的课题.本文以几道例题为例进行分析,进一步探究调节p H的原因及该类试题的解答策略.
例1(2019年全国卷Ⅰ,节选)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺.一种以硼镁矿(含 Mg2B2O5·H2O、Si O2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如图1所示.
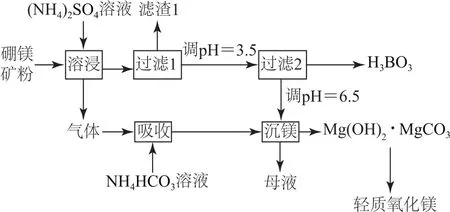
图1
根据H3BO3的解离反应:H3BO3+H2O⇌H++[B(OH)4]-,Ka=5.81×10-10,可以判断 H3BO3是________酸;在“过滤2”前,将溶液的p H调节至3.5,目的是________.
分析本题以硼镁矿制备硼酸的生产工艺为载体,将实际生产与化学知识相结合,考查考生独立思考、逻辑思维、信息加工、分析和解决问题的能力.由题给解离反应:能电离出1个H+,又为可逆反应可知,H3BO3为一元弱酸.向其盐溶液中加入H+,平衡向左移动,生成H3BO3.此问以由电离平衡移动的知识考查考生的逻辑思维能力、应用知识的迁移处理陌生问题的能力.调节p H是控制反应条件的一个重要手段,其目的可概括为“调酸、碱,促沉淀,除杂质,生成酸”.
例2硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为 Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、Fe O、Ca O、Al2O3和Si O2等)为原料制备硼酸(H3BO3)的工艺流程如图2所示.

图2
请回答以下问题:
“净化除杂”需先加 H2O2溶液,作用是________,然后再调节溶液的p H约为5,目的是________.
分析本题以铁硼矿为原料制备硼酸的生产工艺为载体,考查相关化学知识.由流程图可知,加H2O2溶液是将Fe2+氧化成Fe3+,调节溶液的p H,目的是使杂质Fe3+与Al3+转化成氢氧化物沉淀而除去.此题中调节p H的目的是生成弱碱,产生沉淀.
例3工业上回收利用某合金废料(主要含Fe、Cu、Al、Co、Li等)的工艺流程如图3所示.

图3
已知:①Co、Fe都是中等活泼金属.
②Ksp[Al(OH)3]=1.0×10-32,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-19.
③常温下,p H=7.3时Li+或Co3+开始沉淀.
氨水的作用是调节溶液的p H,常温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1认为完全沉淀).需调节溶液的p H范围为________.
分析根据流程图分析可知金属M为Cu,加H2O2溶液是将Fe2+氧化为 Fe3+.对比Fe3+和 Al3+的Ksp可知,Al3+沉淀完全时,Fe3+也沉淀完全,应按照Al3+进行计算.由题意知:

解得c(OH-)=1.0×10-9mol·L-1,可知p H=5,因此要使Al3+沉淀完全,p H>5.结合题中已知,p H=7.3时,Li+或Co3+开始沉淀,故p H<7.3.所以p H范围为5.0<p H<7.3.
例4以铁硼矿为原料,利用碳碱法工艺生产硼和镁,其工艺流程如图4所示.

图4
已知:铁硼矿的主要成分为 Mg2B2O5·H2O和Fe3O4,还有少量Al2O3和Si O2等;硼砂的化学式为Na2B4O7·10 H2O.
碳碱工艺需两次调节p H:
① 常用H2SO4调节硼砂溶液p H=2~3,其目的是________,该反应的离子方程式为________.
② 制取 Mg Cl2·6 H2O时,在“净化除杂”过程中,需先加H2O2溶液,然后用Mg O调节p H约为5,其目的是________.
分析①用H2SO4调节硼砂溶液的p H=2~3,目的是降低溶液的p H,增大c(H+),生成H3BO3,其离子方程式为:②用Mg O调节p H的目的是使Fe3+水解转化为Fe(OH)3而除去.
总之,生产工艺中p H调节是真实的操作过程,需要结合具体问题进行具体分析,回答此类试题的关键是纵观全局,分析每一步操作的作用,认清p H控制的目的,规范写出答案.


