数字PCR在新型冠状病毒检测中的应用前景
胡思宏,游国叶
信阳职业技术学院药学院, 河南 信阳 464000
2019年末出现的新型冠状病毒潜伏期久、传染性极强,导致2020年新型冠状肺炎(COVID-19)疫情在世界各国大规模爆发,疫情防控形势严峻,对全球的公共安全造成了严重的威胁。2020年1月30日,世界卫生组织(Word Health Organization,WHO)宣布新型冠状病毒肺炎为“全球突发公共卫生事件(Public Health Emergency of International Concern,PHEIC)”,2020年2月11日,国际病毒分类委员会(the International Committee on Taxonomy of Viruses,ICTV)将其命名为SARS-CoV-2(severe acute respiratory syndrome-related coronavirus 2),由SARS-CoV-2导致的新型冠状肺炎命名为COVID-19(Corona Virus Disease 2019)。截至2020年11月5日,全球累计新冠病毒感染病例已逾4 850万余例,死亡超122万例;其中美国累计确诊980万余例,死亡超23万例;巴西累计确诊559万余例,死亡超16万例;印度累计确诊836万余例,死亡超12万例[1];中国累计确诊病例86 115例,死亡病例4 634人[2]。
由于SARS-CoV-2传染性极强、潜伏期久,因此,对于新型冠状病毒的检测至关重要。目前广泛采用的荧光定量PCR(RT-PCR)检测SARS-CoV-2存在可能出现“假阴性”结果、需多次取样、重复检测等缺点。为避免超级传播者和“假阴性”检测结果等情况出现,实现“早发现、早隔离、早治疗”,因此亟需研发出一种更准确、更灵敏、更及时地筛查COVID-19的检测方法。
1 新型冠状病毒检测现状
1.1 新型冠状病毒病原学特征
SARS-CoV-2外形椭圆,有包膜,遗传物质为连续线型的单链RNA,基因序列全长29 891 kb,共包含10个编码区,分为:开放读码框1ab(ORF1ab)、棘突蛋白(S)基因、ORF3ab基因、包膜蛋白(E)基因、膜糖蛋白(M)基因、ORF6基因、ORF7a基因、ORF8基因、核壳蛋白(N)基因、ORF10基因[3],SARS-CoV-2基因组结构模式见图1。其中高度保守序列有3个:ORF1ab、N基因、E基因,通过检测这3个特异性序列可以判断是否感染SARS-COV-2。SARS-COV-2属于β属(Betacoronavirus)冠状病毒,β属冠状病毒还包括:HCoV-OC43、HCoV-HKU1、MERS-CoV 和 SARS-CoV[4-5],其中HCoV-OC43、HCoV-HKU1较常见,致病性不高,可引起轻微呼吸道症状,MERS-CoV和 SARS-CoV可导致较严重的下呼吸道感染,SARS-CoV可引起人严重急性呼吸综合征(severe acute respiratory syndrome,SARS)[6],2003年,SARS-CoV对中国公共财产、卫生产生了较大威胁。SARS-COV-2与SARS-CoV有79.5%同源性[7],两者主要在ORF1ab基因和S基因序列存在差异[8]。
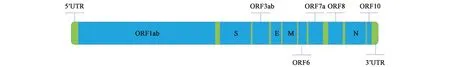
图1 SARS-COV-2基因组结构模式Fig.1 Structure model of SARS-COV-2 genome
1.2 目前SARS-COV-2检测方法
SARS-COV-2检测方法在不断发展和创新,现有的检测技术有:实时荧光PCR、基因组测序、抗体检测、高特异性的逆转录环介导等温扩增技术、SHERLOCK等[9]。截至2020年4月,国家药品监督管理局审核批准了核酸检测试剂19个,抗体检测试剂11个[10]。中国疾控中心发布《新型冠状病毒肺炎防控方案(第6版)》规定:实时荧光PCR核酸检测阳性或病毒基因组测序是金标准[11],荧光PCR被广泛运用于SARS-COV-2的检测中,随着新型冠状病毒检测的发展,即时检测、荧光热对流PCR等更多的核酸检测技术在开发并运用于SARS-COV-2检测[9];基因组测序成本周期长,成本较高,不适合疫情防控情况下的大面积快速检测筛查,可用于SARS-COV-2基因测序[12];抗体检测一般运用于SARS-COV-2核酸检测阴性的补充检测,可与荧光PCR检测互补使用,不作为COVID-19确诊和排查的依据。国外检测技术也在快速发展,比如:美国雅培公司研制出分子即时诊断产品-“ID NOW”检测仪,称其可在5 min内获得SARS-COV-2的检测结果,并获得了美国FDA的紧急使用授权;分子诊断公司Cepheid和Qiagen基于床边分子检测(molecular point-of-care)技术开发出了可在1 h内检测新冠病毒的检测方案。
1.3 荧光PCR检测新冠病毒现存的问题
初期COVID-19缺乏特异性症状,与流行性感冒症状相似,仅从临床表现难以确诊。现阶段,实验室主要采用实时荧光PCR为检测手段,判断SARS-CoV-2阳性的标准主要为:一是检测同一份样本ORF1ab和N基因,双指标均为阳性;二是再次重新采样检测仍有一个目标基因(ORF1ab或N基因)为阳性。根据已展开的检测情况,荧光PCR检测SARS-CoV-2存在多种问题。
1.3.1取样不同而导致病毒检测结果差异 目前,COVID-19检测样本类型有3种:呼吸道样本、消化道样本(粪便、肛拭子)、血液样本(全血、血清标本)。呼吸道样本分为上呼吸道样本(鼻咽拭子、口咽拭子等)和下呼吸道样本(深咳痰液、肺泡灌洗液、支气管灌洗液等);现常用标本类型为鼻咽拭子或口咽拭子,但是钟慧钰等[13]发现,病人同一病程的咽拭子样本只有30%~50%阳性检测率,明显低于深部咳痰;陈炜等[14]认为痰液标本病毒含量高于咽拭子标本,这可能与病毒攻击下呼吸道,引起咳嗽、肺炎等症状有关;杨立平等[15]发现同一病人的不同病程,咽拭子检测结果不同,病毒在病程初期含量较低,导致疑似患者最初检测结果为阴性,而隔几天的咽拭子检测结果为阳性,所以往往需要重复检测才能确诊;李萍等[16]检验了新冠肺炎患者的粪便样本、咽拭子样本、血液样本,结果显示粪便样本的阳性检测率显著高于咽拭子,认为粪便样本对于SARS-CoV-2的检测价值值得重视。样本选择会直接影响SARS-CoV-2检测结果,因此,建立一种受样本选择影响较小、灵敏度更高的检验方法非常重要。
1.3.2试剂盒不同导致病毒检测结果不同 COVID-19基因序列公布后,大量研发公司投入对COVID-19核酸检测试剂盒的开发,现已取得国家批准的新冠病毒核酸检测试剂盒公司有安达基因、华大生物、上海伯杰、圣湘生物等19家公司。不同的核酸检测试剂检测结果存在区别,郭元元等[17]对6种试剂盒进行了对比试验,发现能同时检测出ORF1ab 基因和 N 基因的试剂盒只有2种,且只有3个试剂盒可以敏感地检测出样本病毒含量增加。王旭东等[18]所在医院将3例医院检测为阳性的样本送检另一家实验室,结果显示阴性,其认为检测试剂盒质量参差不齐,其稳定性和可靠性需要提高。试剂盒的检测效果和探针特异性、引物扩增效率、以及PCR扩增抑制物含量、操作环境、仪器设备类型都有关系,某些试剂盒的PCR反应体系存在灵敏度低、重复性差等问题。核酸检测试剂盒的选择可以决定SARS-CoV-2的检出效率和结果,因此开发出特异性更强、抑制剂耐受性高、PCR扩增效率更高的试剂盒对疫情的控制至关重要。
2 数字PCR的原理与优势
2.1 数字PCR的原理
数字PCR(digital PCR,dPCR)是精准定量核酸分子的全新技术手段,具有灵敏度高、特异性强等特点,已在病毒核酸检测、稀有突变检测、拷贝数变异、DNA甲基化分析等医学分子诊断领域有较好的应用。数字PCR不同于传统实时荧光PCR的运行模式,其不需要依赖标准曲线,通过油包水技术或者微流控技术将含有DNA的反应混合液随机分配到众多纳升级的反应单元中,每一个反应单元都是独立的PCR反应体系,设置PCR反应程序后,目标DNA序列不断扩增,在反应终点对有荧光信号的反应单元进行统计,根据泊松分布公式进行校正和计算,从而得到靶标分子的绝对数量[19]。
2.2 数字PCR优势
数字PCR原理是将PCR反应混合液分配到大量的微小反应单元中,独特的分配方式使数字PCR具有众多优势。数字PCR仪将反应混合液中众多核酸分子随机分配到独立反应单元,降低了背景核酸对含量较少的靶序列扩增的干扰,增加了检测的灵敏度和重复性[20];靶标DNA分子分配到不同反应单元,PCR反应抑制剂随之分配,增加了数字PCR抑制剂的耐受性;数字PCR具有对反应抑制剂耐受性强、受背景野生DNA分子干扰小的特点,当样本珍贵、病毒载量低,或者样本核酸存在降解时,数字PCR优势明显。另外,数字PCR不依赖标准曲线和内参基因,采用终点计数的方法,根据阴阳微滴的数目和泊松分布原理,可以得到目标分子的绝对数量,实现真正意义上的绝对定量[21]。
2.3 数字PCR在病毒检测中的应用
数字PCR已用于HIV病毒、人鼻病毒、戊型肝炎病毒、乙型肝炎病毒、疱疹病毒、日本脑炎病毒等多种病毒的检测中,并在病毒学领域显现优势。比如:Strain等[22]以外周血为样本,用数字PCR对样本中HIV病毒的2-LTR(long terminal repeat,LTR)序列进行检测,研究表明数字PCR能有效检测HIV病毒载量在治疗过程中的微量变化,检测精确度比荧光PCR提高20倍以上;Sedlak等[23]用数字PCR和荧光PCR分别对人鼻病毒不同基因型进行检测,提出数字PCR是对人鼻病毒进行基因分型的最佳方法。Nicot等[24]应用数字PCR技术检测戊型肝炎临床标本,提出数字PCR是各种类型样本中戊型肝炎RNA定量的有效检测工具。
3 数字PCR应用于新型冠状病毒检测
3.1 数字PCR在新冠病毒核酸检测中的应用情况
现阶段,实时荧光PCR是检测SARS-COV-2的主流方法,但研究发现由于COVID-19患者的样本种类、病程阶段不同,病毒含量也不同[15],众多干扰因素都直接影响荧光PCR检测结果[17],比如部分患者需要多次检测才能确诊、已出院病人仍携带治病病毒等情况,降低了疫情控制的速度;数字PCR平台具有灵敏度高、抑制剂耐受性强、样本需求量少等特点,其核酸检测受样本病毒载量、试剂盒扩增效率、PCR抑制剂影响小[19-21],能够增加SARS-CoV-2低载量样本检测的准确率,避免重复取样检测。现已有研究团队采用数字PCR检测新型冠状病毒,以探究数字PCR检测该病毒的可行性。Suo等[25]选取了77例咽拭子临床样本,其中包括63个发热疑似病人、14个已接受新冠肺炎治疗并准备出院的病例样本,用ddPCR和RT-PCR进行检测比对,结果显示26例被RT-PCR判定为阴性的样本,ddPCR检测结果为阳性,14个已接受治疗即将出院的病人仍然检测出含有病毒,该团队认为ddPCR技术在SARS-CoV-2低载量临床样品检测中灵敏度和准确率更高;Yu等[26]对取自76例新冠肺炎确诊病例的323例样本进行检测,其中4例被RT-PCR方法检测阴性的样本和41例单基因阳性的样本,ddPCR判定为阳性,该研究认为针对高病毒载量的样本,RT-PCR和ddPCR的检测结果有较好的一致性,但是针对低载量病毒样本,ddPCR的表现更加完美。Falzone[27]和Liu等[28]通过研究发现ddPCR和RT-PCR相比,ddPCR拥有更高的灵敏度和特异性。数字PCR检测新冠病毒的试剂盒也已成功申请专利,比如深圳华因康基因科技有限公司申请的一种名为“一种基于数字PCR检测新型冠状病毒的引物探针组合及其应用”的试剂盒[29],苏州锐讯生物科技有限公司申请的一种名为“新型冠状病毒核酸检测微滴式数字PCR试剂盒及其应用”的试剂盒[30]。
3.2 基于数字PCR平台建立双重PCR检测模型
3.2.1数字PCR反应体系的建立 建立双重数字PCR或者多重PCR检测方法可在独立反应体系同时检测ORF1ab基因和N基因,大大提高了核酸检测的效率。目前,检测SARS-CoV-2的荧光PCR反应体系多为一般PCR,增加了检测的复杂性。此外,反应体系需设置检测人类RNA内参基因以增加检测准确性。数字PCR仪在反应终点检测到不同类型的荧光,通过数字PCR微滴二维图可直观判断DNA类型和含量,判读结果快速直观。深圳华因康基因科技有限公司和苏州锐讯生物科技有限公司已申请并公开了数字PCR检测新冠病毒试剂盒专利,其中深圳华因康基因科技有限公司建立的数字PCR体系为多重PCR,具体引物、探针的序列见表1。目前也有核酸检测试剂盒针对ORF1ab、N基因、E基因3个基因片段建立检测体系。

表1 数字PCR检测SARS-CoV-2试剂盒引物、探针序列Table 1 The sequences of primer and probe detecting SARS-CoV-2 by digital PCR
3.2.2数字PCR反应体系探针和引物设计
TaqMan探针已广泛运用于SARS-CoV-2检测荧光PCR试剂盒,TaqMan探针的特异性随着探针长度增加而降低;TaqMan-MGB探针具有长度短、特异性高等特点,TaqMan-MGB探针将MGB(minor groove binder)基团引入TaqMan探针中,显著增强了TaqMan探针对SNP的鉴别能力[31],采用MGB探针能更灵敏、快速地检测出SARS-CoV-2。TaqMan-MGB探针与引物设计要避免二聚体或者发夹结构的生成,其能影响PCR的扩增效率和TaqMan-MGB探针特异性,多重PCR反应体系包含多条引物与探针,容易产生发夹、二聚体等结构,从而干扰试剂盒检测的真实性和可靠性,多重PCR检测体系中TaqMan-MGB引物和探针设计可采用设计软件Primer Premier 5.0和TM Utility V1.5。
3.3 数字PCR检测SARS-CoV-2的不足及解决措施
3.3.1采取“两步法”检测SARS-COV-2 数字PCR检测成本较高,需要使用特定的数字PCR混合液、微滴生成油、微滴生成仪等试剂和检测仪器,成本远高于荧光PCR检测方法,这对数字PCR的广泛推广带来一定困难。为降低检测成本,可采用数字PCR检测和荧光PCR检测相结合的方式,比如在SARS-COV-2检测中,可首先采用荧光PCR初筛疑似病人样本,病毒载量较高的样本可顺利检出;第二步采用数字PCR平台,对疑似假阴性、弱阳性的样本进行再次检测,从而判定最终检测结果。采取荧光PCR初步筛选,数字PCR精准复检的“两步法”,可以降低检测成本,并提高检测的准确性和可靠性。
3.3.2建立严格质量控制以避免“假阳性”结果
数字PCR操作过程存在极易被污染的缺点,为避免出现“假阳性”结果,需要对实验室建立严格的内部质量控制规范,并严格规范检测操作流程。数字PCR平台对实验室空气环境、检验人员操作等环节有更高要求,防污染是实验室的重要工作之一,比如:在生物安全柜配置反应混合液;配液区与加样区绝对分开;在配液区和加样区使用不同的手套;移液枪加样时要一次性加样完毕,避免来回吹打;粘有样本的枪头要打进装有水的废品盒中,避免核酸漂浮在空气中,从而污染样本;实验结束,用75%乙醇擦洗桌面、1 000 mg·L-1有效氯消毒液拖地消毒,以清除残留核酸。
4 展望
全球新冠肺炎疫情防控形势依然严峻,能否及时准确地筛选出SARS-CoV-2阳性感染者,对疫情防控工作至关重要。用数字PCR平台建立多重检测系统,开发精准、灵敏的检测技术,可避免重复检测,及时对确诊病例进行治疗;基于数字PCR平台检测SARS-CoV-2试剂盒的不断研发,将有助于提高病毒检测的准确性和灵敏度,这对切断传播途径,缩短疫情防控期至关重要。随着流行病学研究的需要,数字PCR可应用于对环境中病毒的监测,尤其适用于复杂样本中低载量核酸分子的检测,如对人员密集区中生物气溶胶、水样等样本中微量病毒的核酸检测。数字PCR技术可实现快速、便捷、精准地监测环境中的病毒,做到早发现、早隔离、早治疗,这对维护全球公共卫生安全具有重要意义。

