半夹心钌分子催化剂的水氧化电催化
陈雪皎,彭伟,陆君涛,庄林
(1. 华侨大学 材料科学与工程学院,福建 厦门 361021;2. 武汉大学 化学与分子科学学院,湖北 武汉 430072)
人工光合作用是应对能源危机与环境污染所提出的一种可再生能源的利用方式,其目的是将太阳能转化为便于储运的化学燃料(如H2)或高附加值的化学品(如乙烯、乙醇等)[1-3].在基于水分解制氢的人工光合作用的研究中,制约制氢效率提高的主要因素为水氧化生成O2的半反应动力学缓慢[4-6].因此,研制高性能的水氧化催化剂是解决问题的关键.
与传统的基于无机纳米材料的催化剂相比,分子催化剂在人工光合作用中具有以下3点优势[7-11].1) 分子催化剂多以有机金属配合物为催化材料,除具有高原子利用率外,还具有类似酶催化的高效性和高选择性.2) 高度分散的分子催化剂不存在晶界,与吸光剂(如半导体材料)结合时,不会成为光生电荷的复合中心,更适于人工光合作用的应用需求.3) 分子催化剂具有明确的几何结构与高度可控的电子性质,在基础研究中是很好的模型催化剂,易于提取构效关系和研究反应机理,可为后续构筑其他类型的催化剂提供重要依据.然而,分子催化剂往往存在不易固载、稳定性差等问题[10-11],导致其在实际使用时的催化转化率(TOF)和转化数(TON)普遍低于纳米催化剂.基于此,本文设计和合成一种具有开放结构和高电荷密度的半夹心钌配合物分子催化剂,并将其应用于电催化水氧化反应.
1 实验部分
1.1 材料与方法
1,2,3,4,5-五甲基环戊二烯(Cp*H,北京百灵威科技有限公司);无水三氯化钌(RuCl3,天津市科密欧化学试剂有限公司);三苯基膦(PPh3)、氢氧化钾(KOH)、乙腈(AN)、无水乙醇、乙醚(上海国药集团);四丁基四氟硼酸铵(TBATF,上海市阿法埃莎(中国)化学有限公司).所有药品均采用分析纯及以上纯度,去离子水电阻率为18.2 MΩ·cm,氩气纯度为99.999%.TBATF经两次重结晶纯化,乙腈以CaH2回流和4A分子筛除水,其他试剂直接使用.
电化学实验均采用CHI 660A型恒电位仪(上海市辰华仪器有限公司)和三电极体系.在非水电解质溶液中,采用玻碳电极(Φ4 mm,天津市艾达恒晟科技发展有限公司)为工作电极,Pt丝为对电极,Ag/AgNO3(5 mmol·L-1)电极为参比电极,电势以内标物二茂铁的氧化还原平衡电势(Fc+/0)报道.在水电解质溶液中,以玻碳电极、Au电极或F掺杂SnO2(FTO)电极为工作电极,以碳纸为对电极,Hg/HgO(1 mol·L-1KOH)为参比电极,并将电势换算为可逆氢参比电极(RHE)报道,相关的换算公式为E(vs.RHE)=E(vs.Hg/HgO)+0.11+0.059pH.
利用在线微分电化学质谱(DEMS)测量电催化水氧化反应产物.将AMETEK Dycor型质谱仪通过一个毛细管采样探头(Φ2 μm,长为1 cm)与电化学池相连接.检测时,将探头包裹一层多孔聚四氟乙烯膜伸入电解液中,并抵近工作电极表面,以氩气作为载气,收集电化学过程中产生的气态产物和挥发性物质.
1.2 半夹心钌配合物分子的合成与表征
半夹心钌配合物分子的合成方案和结构示意图,如图1所示.
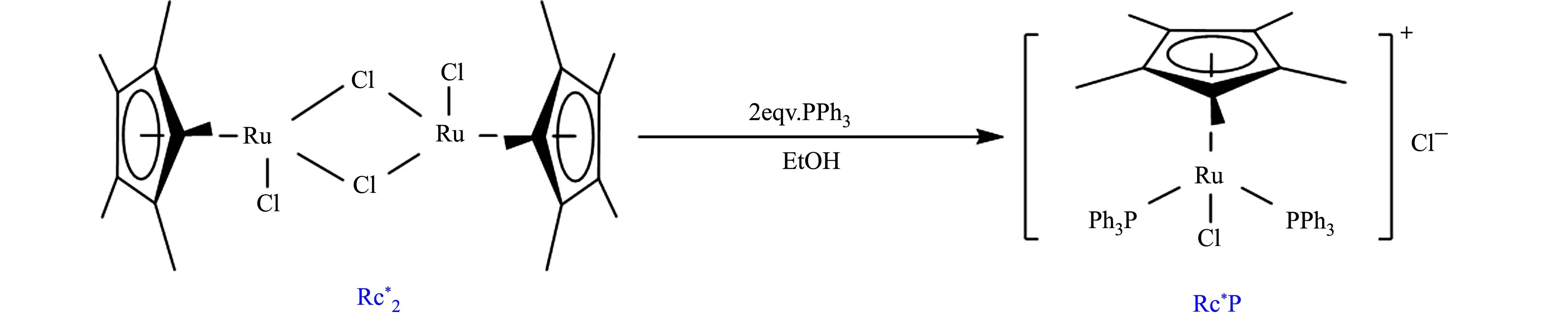
图1 半夹心钌配合物分子的合成方案和结构示意图Fig.1 Schematic diagram of preparation scheme and structure of half-sandwich ruthenium complex
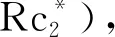
2 结果与讨论
2.1 半夹心钌配合物分子的氧化还原性质
在前期实验中,发现含Cp*Ru(记作Rc*)结构单元的半夹心钌配合物只在较强碱性的水溶液中才具有催化水氧化反应的活性.但高浓度的OH-却易进攻Ru金属中心,导致配体的解离和配合物分子的水解.因此,为提高半夹心钌配合物分子的稳定性,在保持Rc*结构单元的前提下,对其他配体的位阻、电荷密度及亲疏水性进行调控,筛选出Rc*P分子(图1).该分子不仅保留了半夹心钌配合物较开放的准四面体结构和较高的电荷密度,提供易于接近的催化活性中心,同时,PPh3配体较大的位阻使整个配合物分子具有很好的憎水性,抗水解能力显著提高.此外,Rc*P分子的憎水性使其易于固载到电极材料上,改善催化剂与电极材料间的电子接触,推动分子催化剂在电催化水氧化反应中的应用.
在以乙腈为溶剂的电解质溶液中,可以表征溶解的Rc*P分子的氧化还原性质.0.35 mmol·L-1Rc*P在0.06 mol·L-1TBATF/AN非水电解液不同电势窗口内的循环伏安(CV)图,如图2所示.图2中:I为电流;E为电势.实验测量时采用玻碳电极(Φ4 mm),并在氩气保护下进行测试,扫速为100 mV·s-1.由图2可知:该配合物有3个主要的氧化还原过程.
图2 Rc*P在TBATF/AN非水电解液不同 电势窗口内的循环伏安图(vs.Fc+/0)Fig.2 Cyclic voltammetry diagram of Rc*P in non-aqueouselectrolyte solution of TBATF/AN with different potential windows (vs.Fc+/0)
首先,从开路电势向负电势方向极化,可依次检测到还原峰P1(-0.75 V)和回扫时的P1′峰(-0.19 V),两者相互关联,是一个氧化还原电对,但根据两者的位置可知,该电对非常不可逆.结合不同扫速的实验可以推断,具有Ru(Ⅲ)中心的Rc*P在电势负扫时,最先是被还原为[Cp*Ru(PPh3)2Cl](P1),该中间体不稳定,易发生重排,“丢失”一个Cl-配体生成具有Ru(Ⅱ)中心的[Cp*Ru(PPh3)2]+,而且后者在-0.19 V附近被氧化生成[Cp*Ru(PPh3)2]2+(P1′).显然,P1和P1′对应不同配位环境的Ru配合物的得失电子过程,因此,该氧化还原电对不可逆.
其次,从开路电势向正电势方向极化,可检测到氧化峰P2(0.19 V)和其对应的还原峰P2′,两者仅间隔130 mV.根据Rc*P的初始价态和峰电流大小,可以判断此电对仅发生单个电子的转移,对应[Cp*Ru(PPh3)2Cl]2+/+,即Ru(Ⅲ)中心和Ru(Ⅳ)中心相互转换.
最后,电势继续正向极化,在1.53 V可检测到一个完全不可逆的氧化电流峰P3,其电流大约为P1,P2的3倍.因此,推测此时不仅会发生金属中心Ru(Ⅳ)→Ru(Ⅴ)的氧化,配体及电离的Cl-也会发生氧化.由于配合物的结构发生重排,且Ru(Ⅴ)中心极度活泼,该氧化过程完全不可逆.尽管如此,Cp*配体高的π电子密度在一定程度上稳定了Ru(Ⅴ)中间体,后者开放的空间结构和高活性的Ru(Ⅴ)金属中心可为水氧化反应提供理想的催化场所.
2.2 半夹心钌配合物分子的水氧化电催化
向上述含有Rc*P的非水电解质溶液中加入一定量的去离子水.测量在均相溶液中Rc*P的水氧化反应活性,如图3(a)所示.图3(a)中:实验在氩气保护下进行测试;工作电极为玻碳电极(Φ4 mm);电解液为溶有0.35 mmol·L-1Rc*P的0.06 mol·L-1TBATF/AN溶液,扫速为100 mV·s-1;“*”标记的电流峰表示内标物Fc+/0的氧化还原.由图3(a)可知:随着加入水体积(V(H2O))的增加,在开始出现Ru(Ⅴ)中间体的电势区间,不可逆氧化电流显著增大,而在其他范围,循环伏安图则未出现明显的变化.显然,1.5 V附近增大的氧化电流来源于水氧化反应的贡献.将该电流与相同水体积下空白支持电解质溶液的背景电流进行差减,可证明该区域内电流的增大不是简单的两个阳极反应电流的叠加,而是电极表面附近新鲜生成的Ru(Ⅴ)中间体催化了水氧化反应,使该反应以更高速率(更大电流)进行.
获得均相溶液中Rc*P催化水氧化的证据后,开始尝试将该分子催化剂修饰于惰性的FTO电极表面,测试电极在碱性水溶液中催化水氧化反应的能力,如图3(b)所示.图3(b)中:J为电流密度;实验在氩气保护下进行测试,工作电极为负载了不同载量Rc*P的FTO电极(2.5 cm2),电解液为1 mol·L-1KOH,扫速为20 mV·s-1.由图3(b)可知:当E≥1.6 V时,水氧化反应的电流密度J随着Rc*P载量(τ(Ru))的增加而逐渐增大,表明Rc*P是一种高活性的、易固载的水氧化分子催化剂.当极化电势(η)分别为400,500,600 mV时,将各载量下水氧化的阳极电流密度与Rc*P载量的平方((τ(Ru))2)作图,如图3(c)所示.由图3(c)可知:在低载量区间,电流密度与(τ(Ru))2成正比,并且当Rc*P载量继续增大时,电流密度逐渐达到饱和.这说明当催化剂载量较低时,Rc*P催化水氧化反应的微观机理可能包含2个Ru(Ⅴ)=O中间体复合生成O-O键的过程;而当载量较高时,由于分子催化剂修饰层变厚和分散性降低,电子转移和传质过程可能受到影响,导致其催化性能的继续提高受到限制.
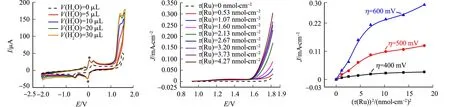
(a) 均相溶液中Rc*P催化水氧化(vs.Fc+/0) (b) 不同载量Rc*P修饰FTO电极电催化水氧化(vs.RHE) (c) 不同极化电势下图3(b)的电流密度与Rc*P载量关系图3 半夹心钌配合物分子的水氧化电催化反应Fig.3 Electrocatalytic reaction of water oxidation of half-sandwich ruthenium complex
2.3 半夹心钌配合物分子电催化水氧化反应的在线微分电化学质谱表征
尽管观察到水氧化电流,但要确定Rc*P电催化水氧化的产物,还需结合谱学技术.因此,采用微分电化学质谱方法在线检测电化学反应中生成的气体及挥发性产物.Rc*P电催化水氧化反应的在线DEMS表征,如图4所示.图4中:以Ar为载气,对该电极表面的气体产物进行采样分析,记录m/z=32的O2信号(SO2)、水氧化电流密度及施加电势的关系;工作电极为修饰了Rc*P的Au盘电极(Φ4 mm),电解液为1 mol·L-1KOH,扫速为2 mV·s-1;在标注的恒定电势下,测出曲线J-t并同步记录O2信号(图4(b)).
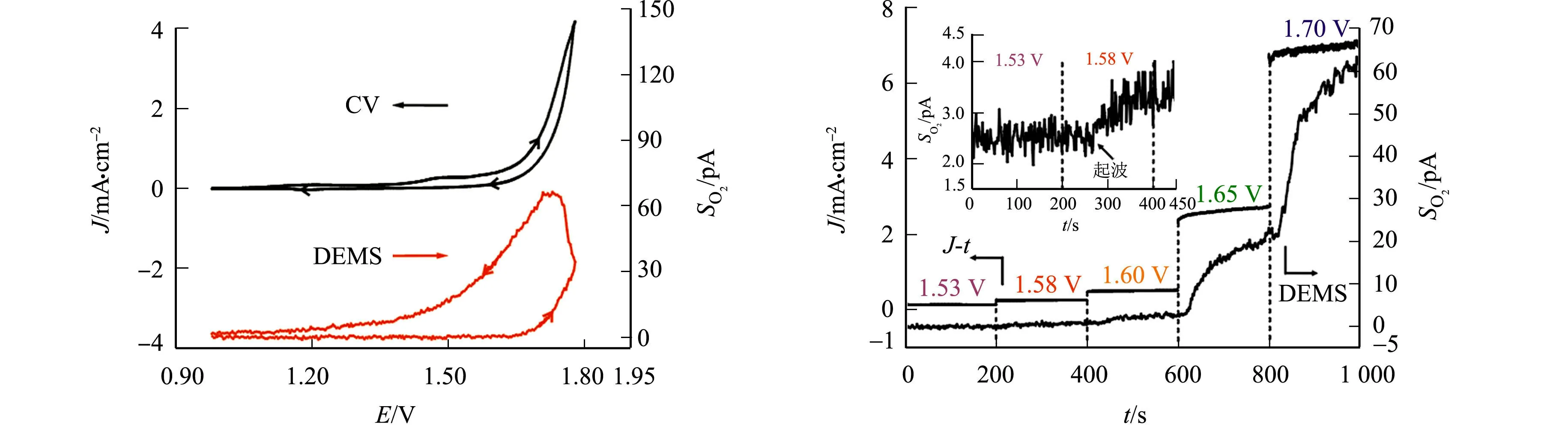
(a) 动态电势扫描测量(vs.RHE) (b) 稳态极化测量 图4 Rc*P电催化水氧化反应的在线DEMS表征Fig.4 On-line DEMS characterization of Rc*P electrocatalysis of water oxidation reaction
由图4(a)可知:随着水氧化电流的增大,O2信号随之增大,说明Rc*P电催化水氧化的主要产物为4e-的氧化产物O2.然而,该方法存在明显的质谱信号滞后,难以在循环伏安测量中确定Rc*P电催化水氧化生成O2的起波电势Eonset.因此,采用恒电位阶跃的方式(图4(b))记录从低到高每个极化电势下,稳态电流与O2信号随时间的变化,待O2信号平稳后,再切换下一电势.

表1 Rc*P/Au电催化水氧化反应的O2检出电势Tab.1 O2 detection potential of Rc*P/Au electrocatalytic water oxidation reaction
实验结果表明,当Rc*P载量为0.038~0.102 μmol·cm-2时,Rc*P电催化水氧化生成O2的起波超电势(极化电势)均在350~370 mV(表1).考虑到超低的Rc*P载量,该分子催化剂具有很高的水氧化反应电催化活性.
3 结束语
设计和合成以五甲基环戊二烯基钌配合物[Cp*Ru(PPh3)2Cl]Cl为代表的一种具有开放的空间结构和高电荷密度的半夹心钌分子催化剂,并应用于水氧化电催化的研究.实验表明,此类配合物分子在强碱性环境下具有良好的稳定性,可直接固载在电极表面催化水分子,发生四电子氧化反应生成O2,在极低的Ru载量和350 mV的极化下,即可推动该反应以较高的速率发生.未来将通过优化载体和催化剂的负载工艺,结合气体扩散电极的应用,进一步提高此类分子催化剂的载量和分散度,有望在实际应用中发挥更高的活性和稳定性.

