吕氏泰勒虫抗原蛋白PIP的表达及抗原性分析
杨 璐,王金花,赵建国,黄良圆,韩 谦,廖承红
(1.海南大学生命科学与药学院,海南 海口 570228;2.海南大学动物科技学院,海南 海口 570228)
吕氏泰勒虫(Theilerialuwenshuni)是属于顶器亚门(Apicomplexa)梨形虫目,泰勒科(Theileriisae)的一种血液寄生原虫,以蜱虫作为传播媒介,可引起动物感染泰勒虫病。吕氏泰勒虫主要感染山羊和绵羊等动物[1],导致动物出现高热、贫血、淋巴结肿大等症状,严重时可能导致动物的死亡,给畜牧业带来了巨大的经济损失[2]。目前我国发现的羊泰勒虫病的病原主要有3种,尤氏泰勒虫(T.uilenbergi)、吕氏泰勒虫和绵羊泰勒虫(T.ovis),虽然致病力依次减弱,但仍然存在潜在的暴发威胁[3-4]。所以迫切需要研究出能快速检测诊断和预防该病的方法,以控制羊泰勒虫病的传染。
羊泰勒虫病的诊断方法一般有血涂片染色镜检、分子生物学技术及血清学诊断等[5-7]。其中血清学检测具有方便、快速、高效的优点,利于疾病的检测和防控。ELISA是目前应用最多的血清学诊断方法。吕氏泰勒虫的抗原蛋白,已报道的有裂殖子表面抗原P32[8]、吕氏泰勒虫表面膜蛋白rTISP[2],但rTISP蛋白需要在真核细胞中进行表达,抗原蛋白产率较低[9],且其也可检测尤氏泰勒虫,不能特异性的检测吕氏泰勒虫,所以本研究以期找到一个可以在原核表达系统中大量表达的抗原蛋白用于吕氏泰勒虫的检测及诊断。PIP是吕氏泰勒虫预测免疫蛋白[10],目前并未见该蛋白表达及抗原性研究的相关报道。本研究将利用生物信息学软件对其抗原性进行分析,以pTYB12质粒为载体,构建羊吕氏泰勒虫原核表达质粒并表达,为吕氏泰勒虫的血清学诊断及基因工程疫苗的制备提供科学基础。
1 材料与方法
1.1 主要试剂 Ezup柱式血液基因组DNA抽提试剂盒、SanPrep柱式质粒DNA小量提取试剂盒、SanPrep柱式DNA胶回收试剂盒,均购自生工生物工程(上海)股份有限公司;T4 DNA Ligase、pMD18-T Vector Cloning Kit,均购自TaKaRa宝生物工程(大连)股份有限公司;FastDigestNdeI、FastDigestXhoI,均购自 Thermo Scientific公司;GreenTaqMix、DH5α Competent Cell,均购自南京诺唯赞生物科技有限公司;pTYB12表达载体,购自New England BioLabs公司;透析袋MD34,购自北京索莱宝科技有限公司;PVDF膜,购自Milliproe公司;Rabbit Anti-Goat IgG H&L(Alexa Fluor®488),购自Abcam公司。
1.2 基因组及血清 海南黑山羊抗凝全血、吕氏泰勒虫阳性血清,均由海南大学病媒生物学实验室制备及保存。
1.3 试验方法
1.3.1PIP基因的生物信息学分析 利用生物信息学软件GENSCAN(https://www.genes.mit.edu/GENSCAN.html)分析预测PIP基因中所含的外显子和内含子的数目及位置,并用在线分析网站(http://www.detaibio.com/tools/index.php?r=signal-peptide%2Findex)对CDS区的信号肽的大小及位置进行分析。利用Protean软件分析PIP蛋白预测该蛋白二级结构、表面可及性、可塑性及B/T淋巴细胞抗原表位等信息[11],并且用IEDB Analysis Resourse(http://tools.iedb.org/main)预测PIP的抗原表位分布情况[12],结果与Protean的结果对比后综合判断,为后续试验研究该蛋白的抗原性提供理论依据。运用在线工具MyHits(http://myhits.isb-sib.ch/cgi-bin/motifscan)分析PIP蛋白结构域,TMpred(http://embnet.vital-it.ch/software/TMPREDform.html)在线软件分析蛋白的跨膜区[13],在线工具SWISS-MODEL(https://www.swissmodel.expasy.org/)预测蛋白的三级结构。ProtParam(https://web.expasy.org/protparam)软件预测PIP的理化性质。
1.3.2PIP基因引物合成及扩增 根据GenBank公布的吕氏泰勒虫PIP基因CDS区序列(登录号为EU753118.1),利用Primer Premier 5.0软件对PIP基因CDS区序列设计1对引物。并分别在上下游引物的5′端引入限制性内切酶NdeI和XhoI的酶切位点及其相应的保护碱基,序列如下,下划线标记出了相应的酶切位点,上游引物为:PIP-NdeI-F:5′-CCAGGTTGTTGTACAGAATGCTGGTCATATGTTC-AAGGTCCTCGCCTTCTTTGCCTTTG-3′,下游引物为:PIP-XhoI-R:5′-CTGCAGTCACCCGGGCTCGAGTTAC-TTGAAGAACTTGAAGAGGGTAAGAGTGAAGAGGT-3′。引物由生工生物工程(上海)股份有限公司合成。
提取羊全血DNA,以DNA为模板进行PCR扩增,反应体系为50 μL:2×PapidTaqMaster Mix 25 μL,上下游引物各0.5 μL(10 μmol/mL),DNA 2 μL,ddH2O 22 μL。反应条件为:95 ℃预变性5 min;95 ℃ 扩增30 s,58 ℃退火30 s,72 ℃延伸30 s,共循环35次;最后72 ℃延伸10 min。将PCR产物做核酸电泳检测,并将目的条带做胶回收,基因扩增片段大小预计为516 bp,送生工生物工程(上海)股份有限公司测序。
1.4 pTYB12-PIP重组表达载体的构建及诱导表达 PCR产物与表达载体pTYB12进行双酶切、连接、转化至大肠杆菌DH5α感受态细胞中,筛选阳性克隆,振摇培养,提取重组质粒。经酶切测序鉴定,正确的重组表达质粒命名为pTYB12-PIP。
将阳性质粒pTYB12-PIP转入BL21(DE3)感受态细胞,挑取阳性克隆振荡培养,至OD600值为0.5左右时,加入诱导剂IPTG在37 ℃条件下进行诱导。诱导时间分别为0、2、4、6、18 h和24 h,IPTG的浓度为0.4 mmol/L和0.8 mmol/L,并用含有pTYB12空载的BL21(DE3)菌种37 ℃以0.4 mmol/L IPTG诱导6 h为对照组。通过SDS-PAGE电泳检测,筛选最佳诱导表达时间和诱导剂浓度。以最佳诱导表达条件,大量表达重组蛋白CBP-PIP,超声破碎提取总蛋白,离心收集上清和沉淀,做SDS-PAGE电泳分析观察蛋白的表达情况。
1.5 PIP蛋白包涵体的变性与复性 由于该蛋白主要表达于包涵体中,将诱导表达的菌体破碎沉淀用变性缓冲液在4 ℃溶解变性,然后将溶液移置离心管中4 ℃,15 000g离心30 min。取上清加入MD34的透析袋中,以复性缓冲液 A、B、C、D及2次E的顺序依次在4 ℃条件下透析,每次透析时间不少于3 h,使蛋白复性[14-15],离心取上清,最后经SDS-PAGE电泳检测上清中是否含有目的重组蛋白CBP-PIP。上述试剂配方见表1。

表1 蛋白包涵体的变性与复性缓冲液配方
1.6 Western Blot分析 以破碎后上清、沉淀及去除包涵体上清为样品,经SDS-PAGE凝胶电泳后,在100 V、90 min条件下将蛋白转置PVDF膜上,用超纯水洗涤3次,在封闭液(含5%脱脂奶粉的TBST)中室温封闭2 h。1∶100稀释血清(包括羊吕氏泰勒虫阳性血清和阴性血清)4 ℃过夜孵育,TBST(含1%的Tween-20)洗涤3次。二抗为1∶5 000兔抗羊IgG H&L(Alexa Fluor®488),孵育2 h。洗涤3次后利用扫膜仪通过荧光检测,观察结果。
2 结果
2.1PIP基因结构及抗原表位预测 根据GenBank中的吕氏泰勒虫PIP基因的全长序列,在线预测其仅有1个外显子,位于该基因序列668~1 183位,共516 bp,因此可用DNA作为模板以扩增其CDS区的序列用于蛋白的表达。CDS区的信号肽的大小及位置进行分析结果显示1~17位氨基酸为信号肽。
用MyHits预测PIP的蛋白结构,显示在18~41位 为His rich区,74~95位为亮氨酸拉链(LEUCINE ZIPPER),在其两端有2个肉豆蔻甲酰化位点位于71~76位和94~99位,另外在125~127有1个蛋白激酶C磷酸化位点位于125~127位氨基酸。软件TMpred预测发现其有3个跨膜区,位于1~19位、88~110位、125~144位氨基酸。ExPASy ProtParam分析其理化性质,预测该蛋白为非溶性蛋白,等电点pI为9.04,分子质量为18.89 kDa。SWISS-MODEL同源建模的方法分析该蛋白全长空间结构,得到95~153位氨基酸预测结构(见中插彩版图1),由图可知109~114位氨基酸为无规则卷曲,且位于蛋白结构表面,可变性强,是抗原表位的可能片段。
用IEDB Analysis Resourse预测B淋巴细胞表面抗原位于41~45位、68~75位和114位氨基酸(见中插彩版图2)。DNASTAR中Protean的Jameson-wolf法预测B淋巴细胞的表面抗原主要位于40~48位、62~64位、67~75位、110~116位、122~129位、147~149位和151~158位。用Gamier-Robson法和Chouer-Robs法分析其二级结构,结果显示主要为α螺旋占87.7%,有β折叠占26.9%,有9个β转角分布均匀占21.1%,无规则卷曲有5个 位于69位、72~74位、83~84位、125~126位和129~133位。利用Karplus-Schul做可塑性分析,有8个可塑性较好的区域占20.4%。通过Emini做表面可及性分析,在124~125位、148~149位、153位氨基酸表面可及性较高,占2.9%。并且利用该软件的AMPHI及Rothbard-Taylor法对T淋巴细胞抗原表位的分析结果预测PIP可能有8个T淋巴细胞抗原表位,分布于6~8位、31~41位、53~56位、63~68位、82~100位、125~129位、132~139位和145~157位(见中插彩版图3)。
2.2PIP基因扩增 以吕氏泰勒虫DNA为模板,用PIP基因CDS区的特异性引物进行PCR扩增。进行1%核酸凝胶电泳分析的结果显示,得到1条500 bp左右的特异性扩增条带,与预计PIP基因大小相符(图4A)。
2.3 pTYB12-PIP重组表达载体的构建PIP基因PCR胶回收产物与表达载体pTYB12双酶切连接,构建重组表达质粒。经双酶切鉴定结果显示,双酶切获得2个条带,分别为载体片段和目的片段(图4B),表明pTYB12-PIP重组表达质粒的构建成功。
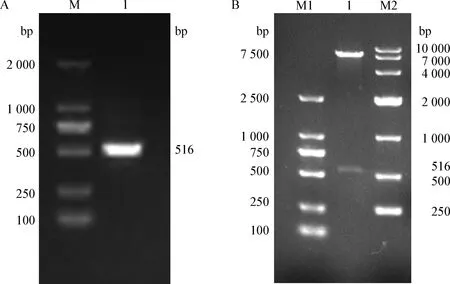
图4 PIP基因的PCR扩增及pTYB12-PIP重组表达质粒双酶切鉴定
2.4 PIP蛋白的诱导表达及纯化 根据条件摸索选用37 ℃、0.4 mmol/L诱导表达6 h作为最佳表达条件(图5)。通过超声破碎裂解菌体后低温高速离心,将上清与沉淀用SDS-PAGE凝胶电泳检测,结果表明该蛋白主要存在于沉淀中,是一种非可溶性蛋白。将沉淀用7 mol/L盐酸胍变性后梯度透析复性,取上清做SDS-PAGE电泳检测,结果显示,在上清中纯化得到较纯的可溶性CBP-PIP重组蛋白(图6A)。
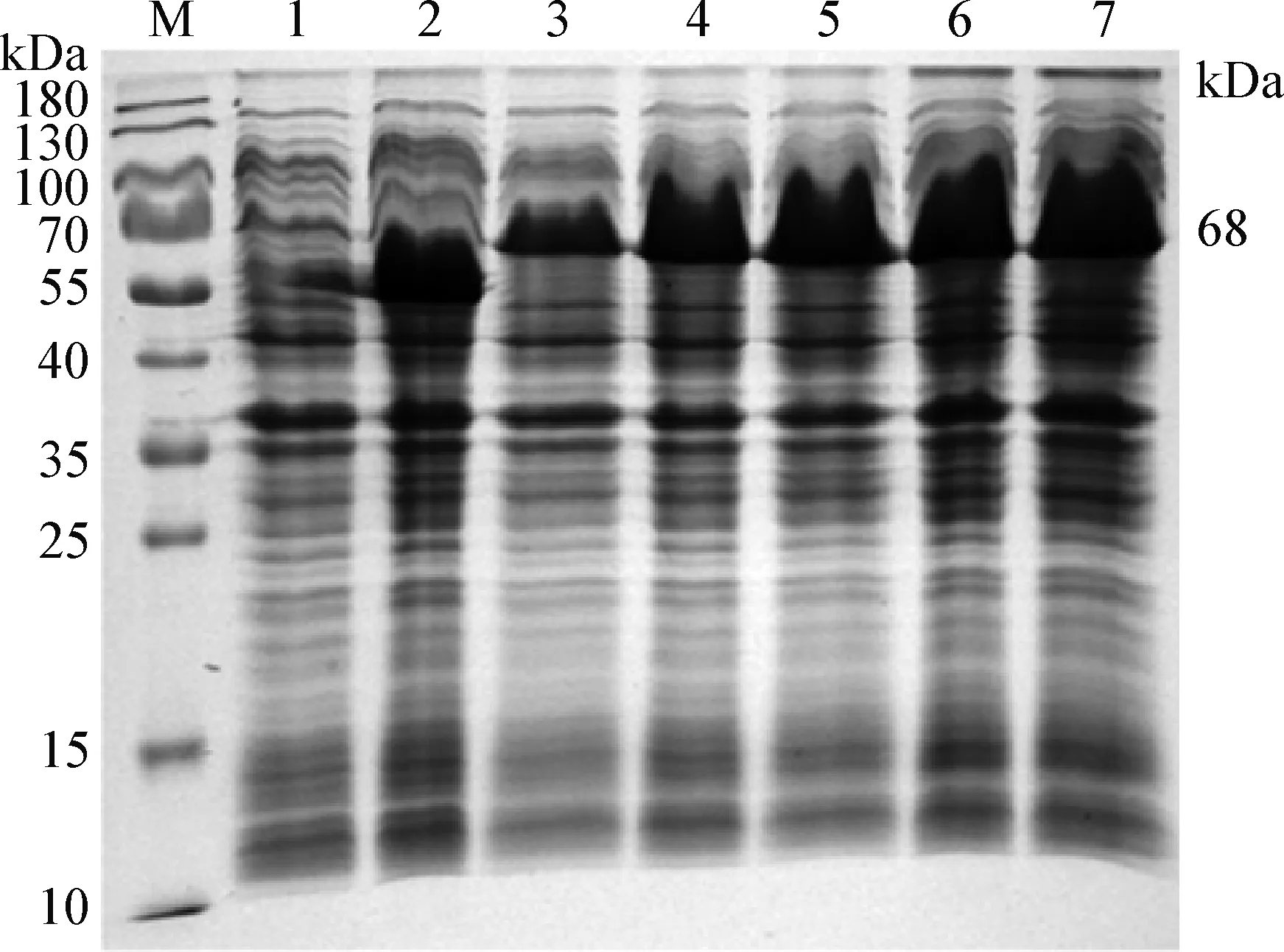
图5 重组蛋白CBP-PIP的SDS-PAGE电泳分析
2.5 Western Blot分析 以破碎后上清、沉淀及去除包涵体上清为抗原,进行Western Blot分析,结果表明破碎后上清、沉淀和去包涵体上清中的吕氏泰勒虫PIP蛋白与吕氏泰勒虫阳性血清反应,在68 kDa 左右处均有阳性条带(图6B)。
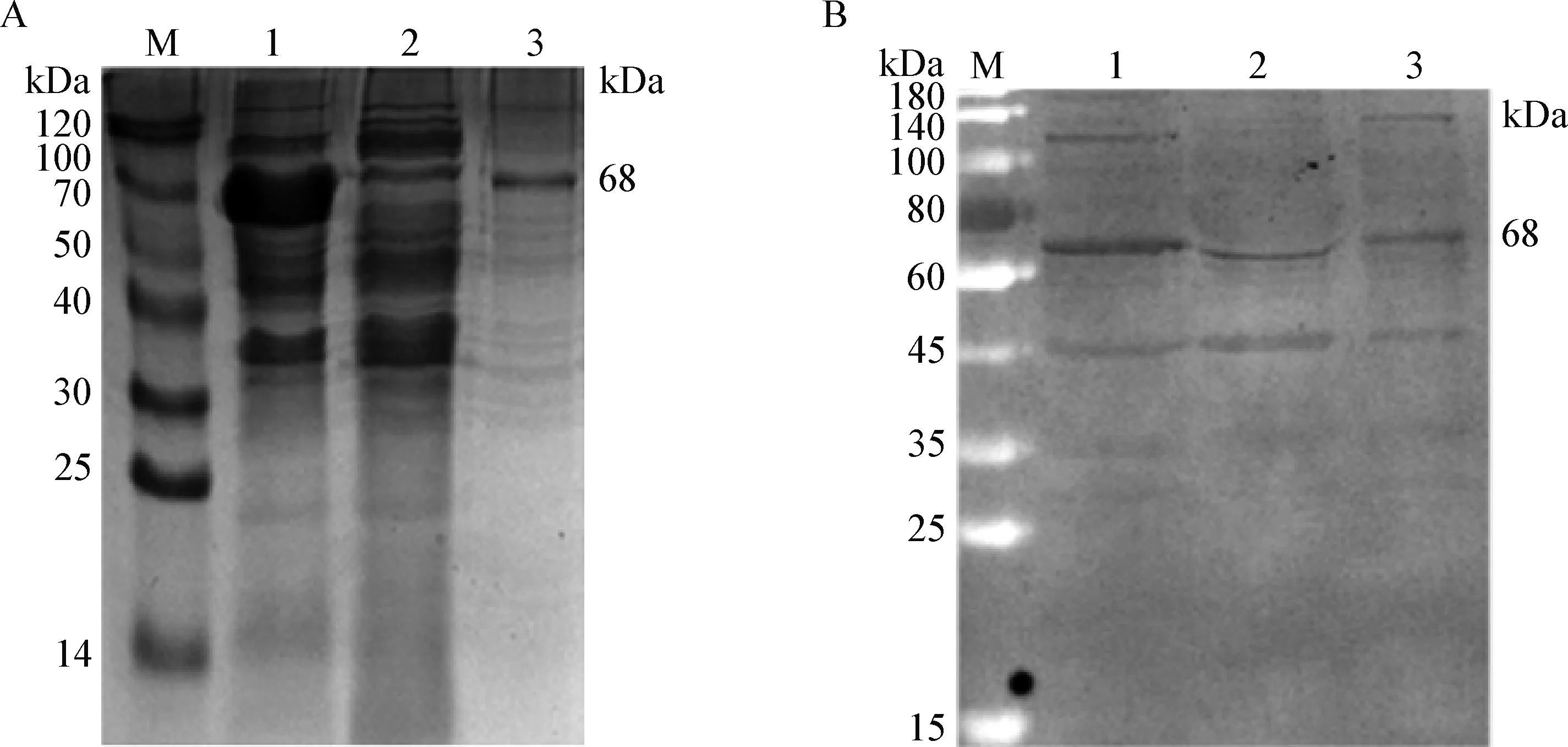
图6 重组蛋白CBP-PIP纯化结果及Western Blot分析
3 讨论
抗原表位分析表明该蛋白具有一定的抗原性,因β折叠和α螺旋通常位于蛋白质内部且其结构规则紧密,一般作为蛋白骨架不具有抗原性,而β转角和无规则卷曲一般位于蛋白表面,且具有较好的可塑性成为抗原表位的可能性比较大。同理,亲水性好的区域更容易在蛋白表面,故有利于形成抗原表位[11,16-18]。另外,可塑性与表面可及性较好的区域柔韧性更好,利于抗原与抗体嵌合,有利于抗原表位的形成。综合以上因素与Protean的Jameson-wolf法及IEDB Analysis Resourse生物信息学软件[12]进行PIP蛋白B淋巴细胞抗原表位的分析,表明PIP具有较好的抗原性。SWISS-MODEL预测的蛋白空间结构时,由于数据库中与PIP同源性片段较少,因此仅获得PIP蛋白95~153位氨基酸空间结构的预测结果,其中109~114位氨基酸为无规则卷曲,可变性强,可以推测其成为抗原表位的可能性比较大,这与Protean的Jameson-wolf法的B淋巴细胞抗原表位的分析结果一致,增加了结果的可信度。
本研究成功获得纯化后的可溶性重组蛋白CBP-PIP。免疫原性分析结果显示,表达的 PIP重组蛋白能被吕氏泰勒虫感染羊的血清所识别,这说明该蛋白对吕氏泰勒虫阳性血清有较好的抗原性。我们将对其他泰勒虫和巴贝斯虫种的阳性血清样本进行检测以确定其特异性,为下一步利用该蛋白对泰勒虫病的早期、快速诊断提供理论支持。

