Linifanib对胃癌模型大鼠胃黏膜组织细胞增殖、凋亡及周期分布的影响
黎玉容,彭颂兴,杨 兵
深圳市第九人民医院消化内科,广东 深圳 518116
胃癌的发病率、病死率均高居十大恶性肿瘤首位,对患者生命安全造成严重威胁[1-2]。在我国,中老年人群是胃癌发病的主要群体,随着社会经济的发展,日常生活节奏不断加快,近年来胃癌发病人群出现年轻化趋势[3]。随着胃癌症状的发生、发展,寻找一种安全有效的治疗方法具有重要意义[4]。利尼伐尼(Linifanib)是广谱的抗血管生成靶向药物,能够抑制VEGF、KDR、PDGFR的表达,常用于非小细胞肺癌、原发性肝癌等恶性肿瘤的治疗[5],但关于Linifanib治疗胃癌的研究还鲜有报道。本研究拟建立胃癌大鼠模型,使用Linifanib进行干预,现将结果报道如下。
1 材料与方法
1.1 材料研究动物:选取35只SD雄性大鼠[潍坊医学院,许可证号:SCXK(鲁)20170003],月龄(10.1±0.7)个月(9~11个月);体质量(230.3±6.5)g(221~242 g)。在相对湿度30%~35%、温度(23.8±1.5)℃的环境中喂养大鼠1周,光照12 h/d。试剂:胃癌细胞株(中国医学科学院);阿糖胞苷(天根生化科技有限公司);Linifanib(武汉欣欣佳丽生物科技有限公司);大鼠抗兔Bcl-2、Bax抗体(Invitrogen公司);小鼠抗大鼠caspase3抗体(Selleck公司);大鼠抗小鼠p-Akt、mTOR抗体(Hyclone公司);兔抗小鼠PTEN抗体(Sigma公司);MTT试剂盒(Gibco公司);ELISA试剂盒(上海酶联生物科技有限公司)。
1.2 方法
1.2.1 建模:取5只大鼠作为正常组,不作处理。参照史翠珍等[6]研究中建模方法,并作出适当改动,对其余30只大鼠进行建模,于大鼠腹部皮下注射200 mg/kg阿糖胞苷,2 d后行60 Co照射,于胃癌细胞中添加Ⅰ型胰蛋白酶重悬,取1 ml细胞悬液于大鼠腋部注射,1周后注射部位出现1 cm大小肿块为建模成功,最终建模成功28只,分为模型组10只、药物对照组、Linifanib组各9只,正常组、模型组大鼠蒸馏水灌胃,药物对照组大鼠使用胃复春溶液进行灌胃处理,Linifanib组大鼠使用Linifanib溶液进行灌胃处理。
1.2.2 标本采集:取各组大鼠尾部静脉血2 ml,2 000 r/min离心处理15 min后分离上清液,置于-80 ℃环境中保存待检。麻醉处死各组大鼠,取胃黏膜组织,液氮冷冻、固定、石蜡包埋,厚度3 μm,切片。
1.2.3 酶联免疫吸附试验法(ELISA)检测胃动素(MTL)、胃泌素(GAS)水平:将血清置于室温后,标记酶标板,制作标准品,然后取出试剂盒,以1∶2的稀释液稀释样品;在反应孔上依次加入稀释好的待测血清和标准品100 μl/孔,置于37 ℃恒温孵育箱中温育2 h;用专用的洗涤液将反应板清洗3次后,再加入抗体工作液(1∶100稀释后)100 μl/孔,置于37 ℃恒温孵育箱中湿育45 min;继续清洗反应板4次后,在反应孔内加入TMB溶液100 μl/孔,置于37 ℃恒温孵育箱中温育45 min后在反应孔内加入终止液100 μl/孔终止反应,在450 nm波长测定吸光度(OD)值,颜色反应深浅与MTL、GAS水平成正比,经绘制标准曲线计算MTL、GAS水平。
1.2.4 免疫组化染色:对待测标本进行脱蜡、水化等处理后,进行高压修复,并在3%的H2O2的环境下进行培育,15 min后滴入山羊血清进行封闭,在25~27 ℃的环境下孵育0.5 h,之后将封闭液抽离,加入1∶100一抗,将其置于4 ℃的环境中过夜培养,次日加入辣根过氧化物酶偶联的二抗,并在恒温箱中培养0.5 h(恒温箱温度37 ℃),清洗后进行DAB显色、封片。
1.2.5 细胞增殖检测:MTT法检测各组细胞增殖能力。将各组细胞加入96孔板中,每孔加入浓度为5 mg/ml的MTT液30 μl,37 ℃孵育4 h,弃培养液,加入150 μl的DMSO,酶标仪在498 nm波长处检测每孔的OD值。
1.2.6 TUNEL法检测细胞凋亡情况:常温环境中使用20 μg/ml蛋白酶K培养0.5 h后去除蛋白,使用PBS缓冲液进行彻底清洗,之后将平衡缓冲液100 μl加入其中,室温环境中平衡10 min,之后滴入TdT酶反应液100 μl,避光、室温环境中孵育1 h,之后加入浓度为10 mg/ml的SSC溶液100 μl,常温环境中静置20 min后进行清洗3次,之后使用DAPI进行复染,避光培养10 min后再次进行清洗,封片观察。DAPI复染细胞核呈蓝色,凋亡细胞的细胞核呈绿色,取每切片3个视野进行观察,计算细胞凋亡率,取平均值。
1.2.7 细胞周期分布、蛋白表达检测:流式细胞仪检测细胞周期分布,并进行组间比较。蛋白质印迹法(Western blotting)检测p-Akt、mTOR、PTEN、Bcl-2、Bax、caspase3表达:取150 ℃ RIPA裂解液,1.5 ℃ PMSF冰中孵育30 min,1 500 r/min离心15 min,取上清。每个样品取15 g蛋白,聚丙烯酰胺凝胶电泳,转入PDVF膜,质量浓度为50 g/L的脱脂牛奶常温下密封2 h。将4C加入抗体过夜。
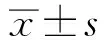
2 结果
2.1 各组胃黏膜组织病理学特点正常组大鼠胃黏膜组织细胞排列较为规则,模型组大鼠胃黏膜组织细胞排列不规则,且可见炎症细胞浸润;药物对照组大鼠胃黏膜组织细胞炎症细胞浸润现象减轻;Linifanib组大鼠胃黏膜组织细胞炎症细胞浸润现象明显缓解,细胞排列较为规则(见图1)。
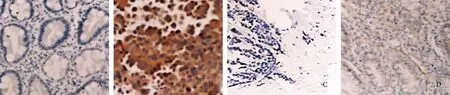
图1 各组胃黏膜组织病理学特点(放大200倍) A:正常组; B:模型组; C:药物对照组; D:Linifanib组Fig 1 Histopathological characteristics of gastric mucosa in each group A: normal group; B: model group; C: drug control group; D: Linifanib group
2.2 各组大鼠MTL、GAS水平比较如表1所示,模型组大鼠MTL、GAS水平均低于正常组,差异有统计学意义(P<0.05);药物对照组、Linifanib组大鼠MTL、GAS水平均低于正常组,高于模型组,且Linifanib组大鼠MTL、GAS水平均高于药物对照组,差异有统计学意义(P<0.05)。
2.3 各组大鼠胃黏膜组织细胞增殖率及凋亡率比较如表2所示,药物对照组、Linifanib组、模型组大鼠增殖率高于正常组,凋亡率低于正常组,差异均有统计学意义(P<0.05);Linifanib组、药物对照组增殖率低于模型组,凋亡率高于模型组,且Linifanib组大鼠胃黏膜组织细胞增殖率低于药物对照组,凋亡率高于药物对照组,差异有统计学意义(P<0.05)。
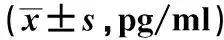
表1 各组大鼠MTL、GAS水平比较Tab 1 Comparison of MTL and GAS levels in rats of each
2.4 各组大鼠胃黏膜组织细胞周期分布情况比较如表3所示,模型组大鼠胃黏膜组织G1期细胞比例低于正常组S期、G2期细胞比例高于正常组,差异有统计学意义(P<0.05);药物对照组、Linifanib组大鼠胃黏膜组织处于G1期的细胞比例均低于正常组,高于模型组,S期、G2期细胞比例低于模型组,高于正常组;Linifanib组大鼠胃黏膜组织G1期细胞比例高于药物对照组S期、G2期细胞比例低于药物对照组,差异有统计学意义(P<0.05)。

表2 各组大鼠胃黏膜组织细胞增殖率、凋亡率比较Tab 2 Comparison of cell proliferation rate and apoptosis rate of gastric mucosal tissues in each group

表3 各组大鼠胃黏膜组织细胞周期分布对比Tab 3 Comparison of cell cycle distribution of gastric mucosa in rats in each group %)
2.5 各组大鼠p-Akt、mTOR、PTEN表达对比如表4、图2所示,模型组大鼠p-Akt、mTOR相对表达量高于正常组,PTEN相对表达量低于正常组,差异有统计学意义(P<0.05);药物对照组、Linifanib组大鼠p-Akt、mTOR相对表达量均高于正常组,低于模型组,PTEN表达高于模型组,且Linifanib组大鼠p-Akt、mTOR相对表达量均低于药物对照组,PTEN表达高于药物对照组,差异有统计学意义(P<0.05)。
2.6 各组大鼠Bcl-2、Bax、caspase3表达对比如表5、图3所示,药物对照组、Linifanib组大鼠Bcl-2、caspase3相对表达量均高于正常组,低于模型组,Bax表达低于正常组,高于模型组,且与药物对照组比较,Linifanib组Bcl-2、caspase3表达较低,Bax表达较高,差异有统计学意义(P<0.05)。
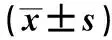
表4 各组大鼠p-Akt、mTOR、PTEN表达Tab 4 Expressions of p-Akt, mTOR and PTEN in each group

表5 各组大鼠Bcl-2、Bax、caspase3表达Tab 5 Expressions of Bcl-2, Bax and caspase3 in each group

图2 各组大鼠p-Akt、mTOR、PTEN表达Fig 2 Expressions of p-Akt, mTOR, PTEN in each group
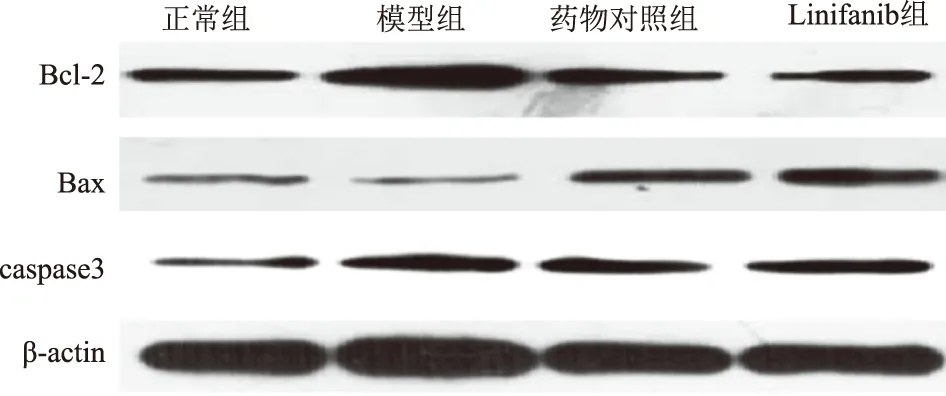
图3 各组大鼠Bcl-2、Bax、caspase3表达Fig 3 Expressions of Bcl-2, Bax and caspase3 in each group
3 讨论
胃癌症状的发生发展会对机体胃肠激素水平产生一定的影响,使机体胃肠道功能及胃动力造成严重的影响,进而使机体胃功能出现严重的下降[7-8]。MTL、GAS是广谱的胃肠激素,具有促进胃肠运动、维持消化道结构、调节消化道功能的作用,对MTL、GAS水平进行检测,能够对机体胃功能进行较为准确的评价[9-10]。本文研究结果显示,相比正常大鼠,胃癌大鼠MTL、GAS水平相对较低,说明胃癌症状的发生、发展抑制大鼠MTL、GAS的分泌,对大鼠胃功能造成严重影响;使用Linifanib进行干预后,胃癌大鼠MTL、GAS水平出现明显上升,说明Linifanib能够调控胃癌模型大鼠MTL、GAS水平,改善大鼠胃功能。胃癌发展与细胞增殖、凋亡关系密切[11]。王威等[12]在研究中对胃癌组织细胞增殖、凋亡能力进行检测,结果显示,胃癌细胞增殖、凋亡能力异常参与胃癌不断发展。陈冬雪等[13]在研究中对胃癌细胞增殖、凋亡能力进行研究,结果显示,使用刺五加皂苷对胃癌细胞进行干预,胃癌细胞增殖率下降,凋亡率上升,并由此得出适当的干预能够改善胃癌细胞增殖、凋亡能力的结论。本研究结果显示,使用Linifanib对胃癌大鼠干预,癌细胞增殖率下降,凋亡率上升。
Bcl-2和Bax是线粒体凋亡通路的重要成员,与癌组织细胞发生、发展密切相关[14-15]。caspase3作为caspase家族重要成员,与细胞凋亡密切相关[16]。本研究显示,使用Linifanib对胃癌大鼠干预,Bcl-2、Bax、caspase3表达受到调控,说明Linifanib能够通过调控Bcl-2、Bax、caspase3表达而抑制癌组织发展。
细胞周期分布是细胞活动的基础生物学行为,其变化对细胞增殖凋亡能力的变化造成一定的影响,对细胞周期分布进行调控,能够对细胞凋亡情况进行调控[17-18]。本研究显示,使用Linifanib对胃癌大鼠干预,癌组织G1期细胞比例上升,说明Linifanib能对胃癌组织细胞周期分布进行阻滞,从而调控癌细胞凋亡能力。
p-Akt、mTOR、PTEN表达变化与细胞周期分布密切相关[19-20]。相比正常大鼠,胃癌模型大鼠p-Akt、mTOR表达较高,PTEN表达较低,使用Linifanib进行干预后,胃癌大鼠p-Akt、mTOR表达下调,PTEN表达上调,说明Linifanib干预能够通过调控p-Akt、mTOR、PTEN表达而起到调控细胞周期分布的作用。
综上所述,Linifanib能调控胃癌大鼠MTL、GAS水平,调控p-Akt、mTOR、PTEN及Bcl-2、Bax、caspase3蛋白表达,从而对大鼠胃黏膜组织增殖、凋亡及周期分布进行调控,为胃癌的临床治疗提供一定的理论依据。

