Wnt7a、CyclinD1、β-catenin在结直肠腺癌组织中的表达及意义
李丛丛,孙佳欢,谢 敏,崔培林,李洪利
首都医科大学附属北京天坛医院 1.消化科; 2.病理科,北京 100070
结直肠癌(colorectal cancer,CRC)是全球最多见的恶性肿瘤之一,其全球范围的综合发病率在恶性肿瘤中男性排名第三位,女性排名第二位[1],是癌症导致死亡的第二大原因[2]。在我国,CRC的新发病例数及病死例数也逐年增多,2008年至2013年5年间,我国CRC的发病率从14.6/10万升至17.2/10万,病死率从6.18/10万升至7.76/10万[3],部分发达地区已接近高发达国家水平。在我国,超过50%的CRC患者错过最佳诊治时间,5年生存率不及40%[4]。因此,早期识别和诊断CRC,尽早采取干预措施,可提高CRC的生存率。
CRC的发病机制十分复杂,其病因仍不明确,目前认为是一个多种因素、多个阶段参与的疾病。在饮食、环境、生活习惯、遗传等多种因素影响下,通过多种信号通路,涉及众多肿瘤调控因子的激活、突变、失活和缺失,与肿瘤的发生、发展密切关联。据报道,90%以上的CRC存在Wnt经典信号通路异常激活[5],且发现其家族及众多可调控Wnt家族的蛋白因子均出现异常表达升高或降低现象[6-7]。
现阶段虽然对Wnt7a、β-catenin、CyclinD1三种基因单独在CRC中表达研究的比较多,但临床意义仍不十分明确。而且在CRC发生、发展过程中,三者是否存在相关性及通过何种途径共同发挥致癌作用的研究比较少。因此,本实验通过收集临床病理标本,使用免疫组织化学法检测Wnt7a、CyclinD1、β-catenin三种Wnt信号通路蛋白在结直肠腺癌、结直肠腺瘤、正常组织中的阳性表达水平,观察、统计它们在结直肠腺癌不同临床参数下的表达水平,分析三种蛋白之间的相关性及可能作用机制。这对于准确地评估CRC的诊断及恰当的临床治疗具有重要意义。
1 资料与方法
1.1 一般资料选取2013年6月至2017年3月于首都医科大学附属北京天坛医院行根治手术切除并经病理科确诊为结直肠腺癌的标本80例作为观察组。男49例,女31例;年龄(54.88±10.32)岁(24~73岁),<65岁者45例,≥65岁者35例;直肠腺癌26例,结肠腺癌54例;肿瘤直径≤5 cm者51例,直径>5 cm者29例;浸润到浆膜层者55例,未浸润到浆膜层者25例;高分化腺癌25例,中分化腺癌22例,低分化腺癌33例;无淋巴结转移者28例,有淋巴结转移者52例;有远处转移者9例,无远处转移者71例;Dukes分期A+B期32例,C+D期48例。所有病例均未行放、化疗,无合并其他部位肿瘤,无肿瘤出血、肠穿孔、肠梗阻、急慢性感染。对照组选取正常结直肠黏膜组织20例和结直肠腺瘤组织40例。选取合适的石蜡组织标本,连续切片4 μm厚,行免疫组化染色。并经两位病理科主任医师筛选及最后结果确认。
1.2 方法
1.2.1 免疫组化:参照Wnt7a、CyclinD1、β-catenin抗体说明书及免疫组化染色试剂盒来进行,阴性对照以PBS缓冲液代替一抗。由两名病理科医师在不知道临床资料的情况下独立判定免疫组化染色的结果,最后共同进行讨论作出统一诊断作为标准结果。肿瘤细胞胞膜、胞质或胞核出现棕黄色颗粒判定为阳性:Wnt7a在细胞质出现为阳性染色;CyclinD1在细胞核出现为阳性染色;β-catenin正常表达着色(棕黄色)部位为细胞膜,异常表达为细胞质(少数细胞核)出现棕黄色着色。
1.2.2 结果判读:采用半定量分析方法,选择切片染色良好区域,连续观察10个高倍镜视野(200倍),平均每个视野观察50个以上细胞。然后参照王爱民等[8]的阳性细胞所占比例评分标准:阳性细胞所占比例<10%为0分;10%≤阳性细胞所占比例<40%为1分;40%≤阳性细胞所占比例<70%为2分;阳性细胞所占比例≥70%为3分。细胞染色评分标准:0分:不着色;1分:染色呈黄色;2分:染色呈棕黄色;3分:染色呈黄褐色。将阳性细胞所占比例评分与细胞染色评分相加,最终得出蛋白水平评分结果:0分为-,1~3分为+,4~6分为++。两名病理学医师对染色组织切片进行分析,他们对患者的临床参数不知情。
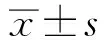
2 结果
2.1 一般情况正常结直肠黏膜、结直肠腺瘤、结直肠腺癌患者在年龄、性别之间比较,差异无统计学意义(P>0.05)(见表1)。

表1 正常结直肠黏膜组、结直肠腺瘤组、结直肠腺癌组一般临床资料比较Tab 1 Comparison of general clinical data among normal colorectal mucosa group, colorectal adenoma group and colorectal adenocarcinoma group
2.2 Wnt7a、CyclinD1、β-catenin在不同组织中的表达免疫组化法检测Wnt7a、CyclinD1、β-catenin在正常结直肠黏膜、结直肠腺瘤、结直肠腺癌组织中的表达如图1所示:Wnt7a主要表达于细胞质,CyclinD1主要表达于细胞核,β-catenin异常表达主要定位于细胞质。

图1 Wnt7a、CyclinD1、β-catenin在不同结直肠组织中的表达(放大200倍) Fig 1 Expressions of Wnt7a, CyclinD1, β-catenin in different colorectal tissues
2.3 Wnt7a、CyclinD1、β-catenin在不同结直肠组织中的表达结果比较Wnt7a、CyclinD1、β-catenin在正常结直肠黏膜、结直肠腺瘤、结直肠腺癌组织中的阳性表达均呈升高趋势(P<0.01)。在结直肠腺癌组的表达均高于正常结直肠黏膜组,差异有统计学意义(P<0.01);在结直肠腺瘤组的表达,除Wnt7a外(P=0.31),CyclinD1、β-catenin均高于在正常结直肠黏膜组的表达(P<0.01)(见表2)。
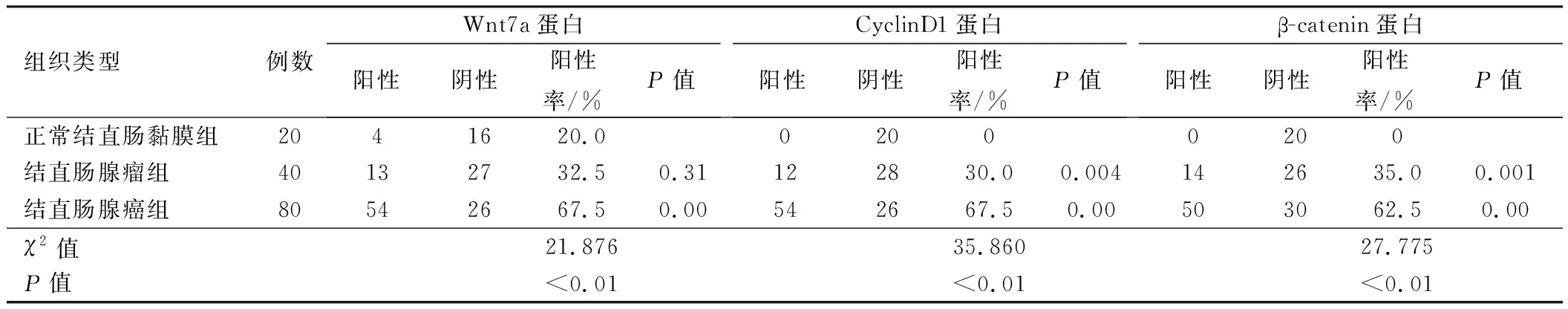
表2 Wnt7a、CyclinD1、β-catenin在三种不同结直肠组织中的表达情况Tab 2 Expressions of Wnt7a, CyclinD1 and β-catenin in three different colorectal tissues
2.4 Wnt7a、CyclinD1、β-catenin的表达与结直肠腺癌的病理关系结直肠腺癌组织中Wnt7a阳性表达、β-catenin的异常表达与患者的性别、年龄、肿瘤部位、肿瘤直径、浸润深度、有无远处转移无关(P>0.05),而与肿瘤的分化程度、有无淋巴结转移及Dukes分期有关(P<0.05)。CyclinD1阳性表达与患者的性别、年龄、肿瘤部位、肿瘤直径、有无远处转移无关(P>0.05),与肿瘤的分化程度、有无淋巴结转移及Dukes分期、浸润深度有关(P<0.05)(见表3~5)。提示分化程度越低、分期越高和有淋巴结转移的结直肠腺癌患者的Wnt7a、β-catenin阳性率越高;浸润深度越深、分化程度越低、分期越高和有淋巴结转移的结直肠腺癌患者的CyclinD1阳性率越高。
2.5 Wnt7a、CyclinD1、β-catenin在结直肠腺癌组织中表达的相关性结直肠腺癌组织中Wnt7a与CyclinD1的相关系数为0.487,为中等程度相关;β-catenin与CyclinD1的相关系数为0.345,为弱相关;β-catenin与Wnt7a的相关系数为0.620,为强相关(P均<0.01)(见表6~8)。

表3 Wnt7a的表达与结直肠腺癌临床病理的关系Tab 3 Relationship between Wnt7a expression and clinicopathological features of colorectal adenocarcinoma

表4 CyclinD1的表达与结直肠腺癌临床病理的关系Tab 4 Relationship between expression of CyclinD1 and clinicopathological features of colorectal adenocarcinoma

续表4

表5 β-catenin的异常表达与结直肠腺癌临床病理的关系Tab 5 Relationship between β-catenin abnormal expression and clinicopathological features of colorectal adenocarcinoma

表6 Wnt7a与CyclinD1在结直肠腺癌组织中表达的相关性分析Tab 6 Correlation analysis of Wnt7a and CyclinD1 in colorectal adenocarcinoma tissues
2.6 结直肠腺癌中Wnt7a、CyclinD1、β-catenin同时表达与结直肠腺癌侵袭和转移的相关性随着结直肠腺癌分化程度的降低、淋巴结转移的增多、临床Dukes分期的升高,Wnt7a、CyclinD1、β-catenin同时阳性表达率也随之升高,并明显高于其相对应组,各组间差异有统计学意义(P<0.05,见表9)。

表7 β-catenin与CyclinD1在结直肠腺癌组织中表达的相关性分析Tab 7 Correlation analysis of β-catenin and CyclinD1 in colorectal adenocarcinoma tissues

表8 β-catenin与Wnt7a在结直肠腺癌组织中表达的相关性分析Tab 8 Correlation analysis of β-catenin and Wnt7a in colorectal adenocarcinoma tissues

表9 Wnt7a、CyclinD1、β-catenin同时表达与结直肠腺癌侵袭和转移相关性Tab 9 The co-expression of Wnt7a, CyclinD1, β-catenin associated with the invasion and metastasis of colorectal adenocarcinoma
3 讨论
CRC作为消化系统常见的恶性肿瘤,其发病率的增长速度每年提高3%~4%[9],已经成为我国第三大最常见癌症和第五大癌症死亡原因[10]。虽然在该病的早期诊断和治疗方面已经取得了相当大的进展,但CRC患者的长期生存率仍不令人满意。研究表明,50%~60%的CRC患者术后复发并发生远处转移,这些患者的5年生存率不足12%[11-12]。目前常用的临床检查手段并不能准确筛选出术后高复发转移的患者,因此,发现更多的生物学标志物将有助于为CRC提供新的治疗靶点,有利于CRC的精准治疗和预后预测。
目前许多研究表明,CRC中的Wnt/β-catenin信号通路发挥十分重要的作用,因此对该信号通路的研究将为肿瘤诊断、治疗及预后评估提供新的思路及希望。该通路结构复杂,含众多种类成员,且有三条途径发挥作用。目前研究比较清楚的是典型的Wnt/β-cantenin信号途径。该通路被异常激活或通路中任何细胞因子的过度表达均可导致肿瘤的发生和发展。Wnt7a、CyclinD1、β-catenin作为Wnt信号通路中的重要成员,它们均参与细胞周期的调控及调节细胞生长、增殖、分化。
Wnt7a与多种肿瘤存在密切关系。(1)Wnt7a发挥抑癌作用:在白血病中:Ochoa-Hernndez等[13]证明Wnt7a在正常外周血T淋巴细胞表达明显高于在白血病细胞株和白血肿瘤患者外周血细胞中表达,细胞的增殖受到了抑制。在肺癌中:Ohira等[14]研究发现Wnt7a可能在肺癌(尤其是非小细胞肺癌)中发挥抑癌作用。(2)Wnt7a发挥致癌作用:Yoshioka等[15]研究发现,敲除Wnt7a的卵巢癌SKOV3.ip1细胞组肿瘤病灶和细胞的侵袭均比较少。Carmon等[16]通过免疫共沉淀技术在子宫内膜癌细胞中发现,Wnt7a通过与Fzd5结合,激活了经典Wnt/β-catenin信号通路,最终导致细胞增殖。
Wnt7a在CRC中的研究:孙丹等[17]的研究发现,Wnt7a在大肠癌中的作用可能通过与受体Fzd5的结合激活Wnt信号通路从而促进CRC的发生及发展。本实验通过统计Wnt7a在正常结直肠黏膜、结直肠腺瘤及结直肠腺癌中阳性表达情况,发现Wnt7a在结直肠腺癌组织中的阳性表达率明显高于结直肠腺瘤及正常结直肠黏膜组织,差异有统计学意义,说明Wnt7a可能与CRC的发生、发展相关,抑制其生物活性,或许可起到防治CRC的作用。另外通过研究Wnt7a与CRC临床病理参数之间的关系,发现Wnt7a蛋白的阳性表达与患者性别、年龄、肿瘤部位、肿瘤直径、浸润深度、有无远处转移等参数无关,而与Dukes分期、肿瘤的分化程度、有无淋巴结转移相关;这或许可作为评估CRC恶性程度、转移情况的参考指标,为CRC的预后提供一定的参考意义。本实验结果与Wang等[18]研究结果相似,Wang等[18]利用免疫组织化学染色对CRC和癌旁正常组织中Wnt7a表达进行检测,发现肿瘤组织内Wnt7a阳性表达率明显高于癌旁正常组织;Wnt7a高表达与肿瘤大小、淋巴结受累、TNM分期显著相关;并利用Cox比例危险度模型进行多变量分析,证实Wnt7a蛋白表达、TNM分期作为CRC总生存时间(overall survival,OS)和无病生存时间(disease free survival,DFS)的独立预后因素。因此提出Wnt7a可能作为评估CRC疾病复发或死亡的高风险的预后因素。
β-catenin在Wnt信号通路过程中发挥关键作用,同时作用于通路下游蛋白,在信号传导过程中发挥重要正向调节效应。Wong等[19]研究发现,在CRC中发现上游基因β-catenin的异常表达占40%~50%。由此推断β-catenin作为Wnt信号通路的关键因子,在CRC形成、发展中发挥关键作用。本实验通过统计β-catenin在正常结直肠黏膜、结直肠腺瘤及结直肠腺癌中异常表达情况发现,β-catenin在结直肠腺癌组织中的异常表达率明显高于结直肠腺瘤组,差异均有统计学意义。另外通过研究β-catenin与CRC临床病理参数之间的关系,发现β-catenin蛋白的异常表达与患者性别、年龄、肿瘤部位、肿瘤直径、浸润深度、有无远处转移等参数无关,而与Dukes分期、肿瘤的分化程度、有无淋巴结转移相关;此结论与以下研究结果相似,朱健等[20]发现,β-catenin的异位表达从正常组织到腺瘤组织再到腺癌组织依次增加。林山等[21]研究表明,β-catenin表达与肿瘤的TNM分期、分化程度、浆膜浸润、淋巴结转移及术后复发均有关。李蓓蓓等[22]研究表明,β-catenin的异位表达率与肿瘤的分化程度、Dukes分期、淋巴结转移有关。本实验结果及其他研究结果共同表明β-catenin促进结直肠腺瘤向恶性肿瘤转变,并和肿瘤的浸润、转移密切相关,可能是CRC发生的一个重要分子事件[17],可作为评估CRC的预后指标。
CyclinD1蛋白是由295个氨基酸残基构成的蛋白质,是CyclinD家族的亚型之一,主要对细胞周期G1期起正向调控作用,促进G1期进入S期[23]。赵雪松等[24]研究显示,CyclinD1通过激活Wnt途径促进甲状腺肿瘤的发展和转移,CyclinD1过度表达与甲状腺微小癌有关,甲状腺癌的恶性程度及临床分期分别越高且伴随淋巴结转移,CyclinD1阳性率越高。本实验发现,由正常结直肠组织到良性结直肠腺瘤再到结直肠腺癌,CyclinD1阳性表达呈上升趋势,差异有统计学意义。说明CyclinD1可能与结直肠腺癌的发生、发展相关,抑制其生物活性,或许可起到防治CRC的作用。另外通过研究CyclinD1与结直肠腺癌临床病理参数之间的关系,发现CyclinD1蛋白的阳性表达与患者的性别、年龄、肿瘤部位、肿瘤直径、有无远处转移、浸润深度等参数无关,而与Dukes分期、分化程度、有无淋巴结转移相关;CyclinD1或许可作为评估CRC恶性程度、转移情况的参考指标,为临床预后及治疗提供有效的帮助。该研究与朱慧能等[25]研究结果一致,朱慧能等[25]的研究显示,CyclinD1蛋白在正常结直肠黏膜、结直肠腺瘤和结直肠腺癌组中的阳性率分别为0、46.7%、55.0%,结直肠腺癌组和结直肠腺瘤组阳性率均高于正常结直肠黏膜组。CyclinD1蛋白在CRC中的表达与组织学分级、淋巴结转移和TNM分期有显著相关性。陈爱军等[26]通过生存曲线分析指出,就5年生存率来说,CyclinD1阳性的患者明显低于CyclinD1阴性的患者,表明CyclinD1阳性表达不仅与CRC的发生密切相关,而且关系到患者的预后。
Wnt/β-catenin通路包含3部分:细胞外因子Wnt蛋白、胞膜上的卷曲蛋白及受体及胞质内β-catenin蛋白受体、细胞核内转录因子TCF4[27]。各种原因导致胞外因子Wnt被激活,通过一系列的作用激活胞内的β-catenin蛋白受体,致β-catenin无法被磷酸化从而在胞质内累积,进入细胞核与TCF4结合形成复合物,上调下游CyclinD1的表达[28],从而促进CRC的发生及发展。因此三者之间的关系为:异常途径激活Wnt信号通路,Wnt→Frz→Dsh→β-catenin的降解复合体解散→β-catenin积累→进入细胞核→TCF/LEF→CyclinD1转录增加,三者之间存在相关性。
本研究显示,Wnt7a阳性表达与β-catenin异位表达(R=0.620)、CyclinD1阳性表达(R=0.487)间存在强相关或中等程度相关,β-catenin异位表达与CyclinD1阳性表达呈弱相关(R=0.345)(P<0.05),以上结果提供了三者之间存在相互正相关证据。联合检测三者,发现随着CRC分化程度的降低、淋巴结转移的增多、临床Dukes分期的升高,Wnt7a、CyclinD1、β-catenin同时阳性表达率也随之升高,并明显高于其相对应组,各组间差异有显著统计学意义。由此得出三者相互影响、紧密联系,共同促进CRC发生、发展、浸润、转移。故临床中联合检测三者,可作为判定CRC演进、侵犯能力、转移能力的指标。
综上所述,Wnt7a、CyclinD1和β-catenin可能与CRC的发生、发展相关,抑制这三种蛋白的生物活性,或许可起到防治CRC的作用。另外通过研究三种蛋白与CRC患者病理参数之间的联系,得出Wnt7a、β-catenin和CyclinD1与CRR分化程度、淋巴结转移情况、Dukes分期密切相关,三者可作为评估CRC恶性程度、转移情况的参考指标,为CRC的预后提供一定的参考意义。并且联合检测这三种蛋白,对于更加准确地评估CRC的恶性程度、转移潜能及预后有重要意义。

