个体化膳食对化疗期间的老年结肠癌患者营养参数变化影响的相关性分析
武惠丽,田 涛,张苗苗,陈小芳
西安交通大学第一附属医院肿瘤内科,陕西 西安 710061
研究发现,癌症患者的体质量减轻与预后较差具有极大的相关性[1-2],因此,对癌症患者的营养状况评估在临床上具有重要的意义[3-4]。研究表明,在化疗期间针对胃癌患者营养不良提出膳食指导具有重要意义[5]。有研究针对成年癌症患者进行了营养干预随机对照试验,并评估化疗期间单独或组合使用营养建议和口服补充剂的效果,结果均显示了1年生存率和生活质量得到提高[6]。还有研究发现,营养干预治疗可改善营养不良风险患者的营养状况,降低放疗不良反应发生率,改善生存预后[7-8]。
然而,以往的研究对象多为成年人,较少有专门针对老年患者的分析研究。人口老龄化是恶性肿瘤发病率上升的主导因素,随着年龄的增长,机体免疫功能逐渐减弱,更有利于恶性肿瘤的发生和发展,因此,多数癌症发病患者是中老年人。本研究针对营养不良风险的老年结肠癌患者化疗期间进行个体膳食营养干预,并对患者化疗前后营养相关指数变化进行分析。
1 资料与方法
1.1 一般资料选择2017年3月至2019年3月在我院首次接受化疗的120例结肠癌患者为试验组。同期纳入无个体化膳食干预的Ⅰ~Ⅲ期结肠癌患者50例作为对照组。记录化疗开始前患者一般临床资料为基线数据,研究结束时间为化疗结束后的1周,对比分析两组化疗期间营养参数变化的趋势。所有患者及家属均签署知情同意书,并经相关伦理学会审批通过。
纳入标准:(1)年龄>60岁;(2)卡氏生活质量Karnofsky评分>50分;(3)肿瘤分期确诊为Ⅰ~Ⅲ期;(4)未发生淋巴结转移;(5)患者可接受Ⅰ~Ⅲ期的常规化疗;(6)PG-SGA评分为4~8分;(7)无糖尿病及心血管病疾病。排除标准:(1)脑转移瘤患者;(2)因为治疗或其他原因不能参加随访的;(3)蛋奶过敏;(4)病情危重的恶病质患者;(5)正在接受其他临床治疗;(6)拒绝个体化膳食干预或不配合研究的;(7)进行手术治疗。
1.2 方法
1.2.1 个体膳食干预措施:化疗的第1天起开始进行个体膳食营养干预。研究中的营养师不属于癌症治疗方案的工作人员,通过提供膳食结构建议旨在实现每日30 kcal/kg热量和1.2 g/kg蛋白的摄入[9]。建议是基于面对面访谈和膳食建议卡,由护理人员和家属、患者共同参与,并通过考虑实际膳食摄入量和老年病学常规应用的评估使得建议适应每例患者。
结肠癌患者膳食是要易于消化、容易吸收的小分子食物,因此我们对患者早中晚的食谱主要给出了调整和建议。早晨:豆浆/脱脂牛奶300 ml+100 g鸡蛋羹。中午:小米粥/营养米糊(大米+小白菜+食盐+胡萝卜丁)或泥鳅、黄鳝、白鳝、鲫鱼汤+主食为米饭或容易消化的细糯面条。晚上:以清淡为主,主要为营养粥。根据患者个人饮食喜好和口味可做出相应调整。额外增加营养补充剂比如:晒维康口嚼片等,搭配硒元素、维生素E、β胡萝卜素等微量元素,可短时间增强身体免疫,改善体质。对于个体化膳食建议效果不明显患者可采用补充剂处方输液的方式进行补充。各种食物成分和热卡/蛋白质根据中国食物成分表(2017年版)进行核算。对照组不做任何干预指导。
8张膳食建议卡解决如下问题:膳食平衡、食欲不振和精力充沛、腹泻和便秘、恶心和呕吐、味觉干扰、口腔疼痛和感觉干燥、吞咽障碍、糖尿病。化疗期间会进行6次面对面访谈并对化疗持续超过2周的患者进行间隔电话访问。每例患者化疗期间接受持续干预3~6个月。所有营养师均接受了专业培训。
1.2.2 膳食摄入评估:要求患者填写访问前1 d的膳食记录,交于营养师用于膳食建议,包括口服营养补充剂和人工营养等的摄入量全部考虑在内。最后由医护人员统计相关指标,并通过Nutrisoft Billnut软件(Tours,France)计算摄入量,给出达到能量或蛋白摄入量目标的患者比例。
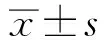
2 结果
2.1 化疗前两组基线资料分析试验组患者的年龄(68.21±4.82)岁,男61例(50.83%),PG-SGA评分为(6.81±0.42)分及Karnofsky评分为(53.12±3.47)分。两组患者的年龄、性别、癌症特征、体质量变化、营养指标、常规生化指标之间差异无统计学意义(P>0.05)(见表1)。
2.2 化疗后两组营养参数变化对化疗结束后两组营养指标的数据进行分析发现,试验组体质量、总淋巴细胞、总蛋白、肌酐指数、TSF、PG-SGA评分、BMI、氮平衡与对照组相比,差异均有统计学意义(P<0.001),ZPS评分1~2分差异也有统计学意义(P=0.029)。与化疗前基线数据相比,两组每个指标均呈下降趋势,但干预组下降趋势较小,对照组下降趋势较大,说明个体膳食干预措施在一定方面起到了改善作用(见表2)。
2.3 膳食结构和营养补充剂对患者能量达标率分析对两组膳食结构数据进行分析,发现试验组在蛋白总量、热量总量、维生素总量、脂肪总量、营养补充剂与对照组相比,差异有统计学意义(P<0.001),但膳食纤维总量差异无统计学意义(P>0.05)(见表3)。
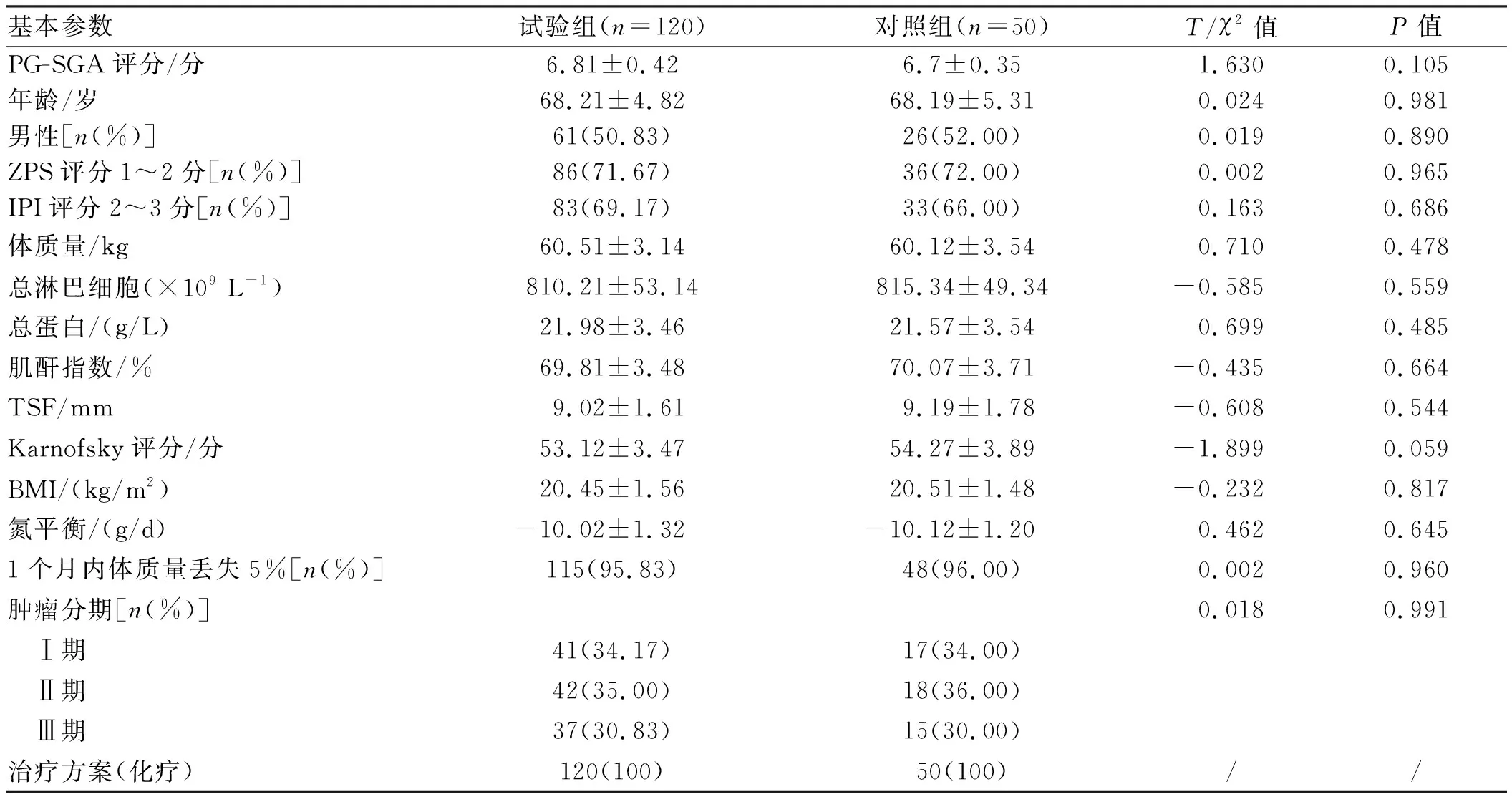
表1 化疗前两组一般资料比较 Tab 1 Comparison of general data between the two groups before chemotherapy

表2 化疗后两组营养参数比较 Tab 2 Comparison of nutritional parameter between the two groups after chemotherapy

表3 干预后两组营养成分摄入量比较 Tab 3 Comparison of nutrient intake between the two groups after intervention
2.4 PG-SGA评分与化疗后一般临床资料的相关性分析PG-SGA评分与各指标相关性分析结果见表4,总体研究对象PG-SGA评分与蛋白总量(r=0.562,P=0.002)、热量总量(r=0.412,P=0.029)、脂肪总量(r=0.354,P<0.001)、体质量(r=0.492,P=0.001)、总淋巴细胞(r=0.570,P=0.038)、总蛋白(r=0.588,P<0.001)及肌酐指数(r=0.397,P<0.001)呈正相关。对照组中,PG-SGA评分与蛋白总量(r=0.466,P=0.004)、热量总量(r=0.351,P=0.024)、脂肪总量(r=0.349,P=0.008)及总淋巴细胞(r=0.701,P<0.001)呈正相关(P<0.05)。研究组PG-SGA评分与蛋白总量(r=0.494,P<0.001)、热量总量(r=0.563,P<0.001)、维生素总量(r=0.209,P<0.001)、脂肪总量(r=0.412,P=0.018)、体质量(r=0.559,P=0.002)及总蛋白(r=0.615,P<0.001)呈正相关(P<0.05)。
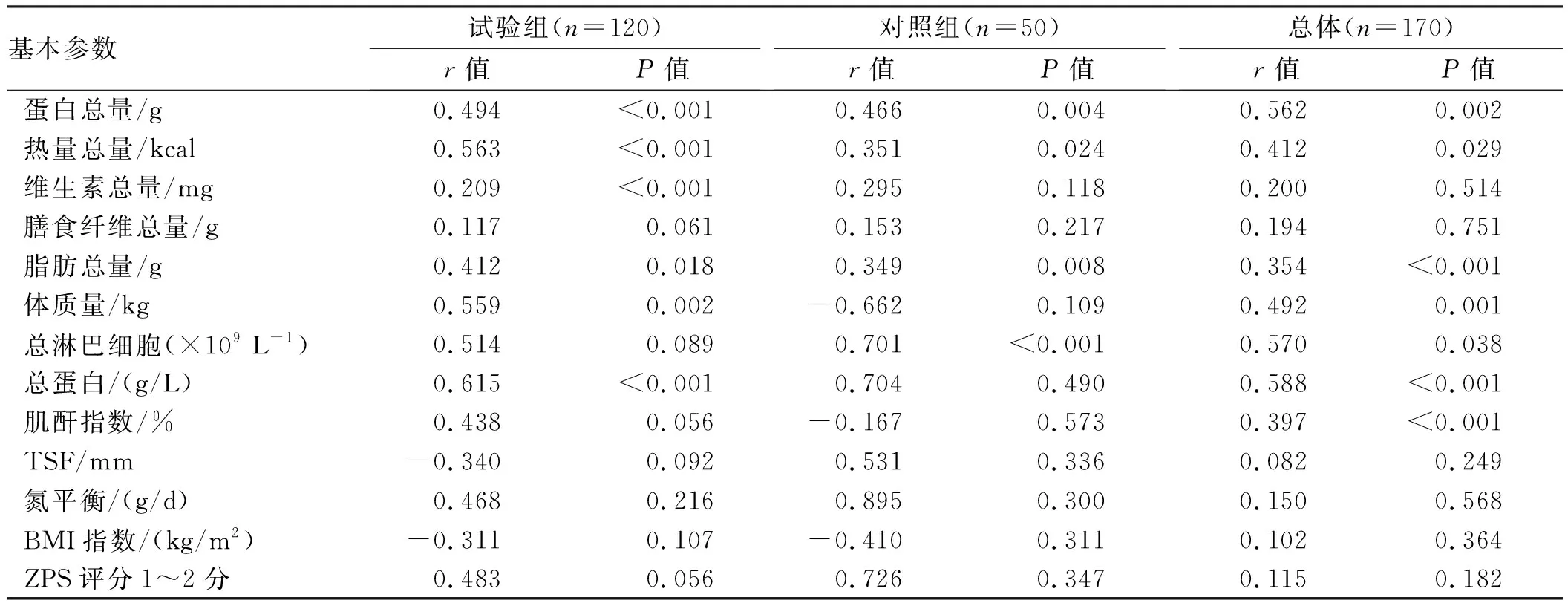
表4 PG-SGA评分与化疗后一般临床资料的相关性分析 Tab 4 Correlation analysis of PG-SGA score and general clinical data after chemotherapy
2.5 能量总摄入与PG-SGA评分线性回归以PG-SGA评分为因变量,分别纳入不同自变量构建不同预测模型见表5。以在包含性别、年龄、BMI及能量总摄入的多因素回归分析模型中(模型1):BMI及能量总摄入是PG-SGA的显著预测指标(P<0.05);在模型1的基础上,纳入肿瘤分期进行多元线性回归分析,BMI及能量总摄入是PG-SGA的显著预测指标(P<0.05)(模型2);当回归模型中添加IPI评分后,只有能量总摄入是PG-SGA的显著预测指标(P<0.05)的独立预测因子(模型3)。

表5 PG-SGA评分与能量总摄入多元线性回归分析 Tab 5 Multiple linear regression analysis of PG-SGA score and total energy intake
3 讨论
研究表明,成年肿瘤患者在化疗前体质量减轻增加了死亡风险以及直接造成了在化疗过程中化疗剂量的减少及其药理毒性的增加[10],但我们发现,随着个体膳食建议摄入量的同时,老年癌症患者的体质量也会存在组间差异,且其他指标如总淋巴细胞、总蛋白、肌酐指数、PG-SGA评分、BMI及氮平衡等均显示组间差异有显著统计学意义,这一发现与以往随机对照试验结论不太一致[11],他们的结论显示,膳食摄入量的增加对预防体质量减轻的效果不明显,并认为患者的体质量减轻可能主要是由于癌症进展造成系统性代谢障碍导致[12]。而本研究表明,增加能量摄入能显著改变患者体质量及其他生化指标,这可能与癌症恶病质期间合成代谢途径的变化相关,才能在干预测试中起到明显的改善作用。
在此之前,癌症患者化疗期间进行个体化膳食建议治疗试验较少,特别是较少有研究老年患者的。研究表明,科学的营养建议可根据老年患者症状及身体状况制定最有利的饮食方案,合理有效地摄入足量的能量,有效地预防了患者发生营养不良的可能[13]。另一项回顾性研究显示,结直肠癌患者经过膳食建议能有效改善他们的营养状况,并提高了生存率[14]。还有研究表明,就结直肠癌化疗患者膳食营养状况进行改善并提供生活指导,可有效提高患者生活质量[15]。本研究中,个体化膳食建议也能明显改善老年癌症患者在化疗期间的营养指标,为了进一步说明这些问题,研究对两组患者的膳食结构数据进行了比较分析,发现组间的蛋白总量、热量总量、维生素总量、脂肪总量、营养补充剂评分差异有统计学意义,同时,PG-SGA评分与各指标相关性分析也显示,PG-SGA评分也与以上的各项营养指标呈正相关,且差异有统计学意义,这说明个体化膳食建议与患者的营养状况改善具有相关性。最后,以PG-SGA评分作为因变量,分别纳入不同自变量构建不同预测模型也显示,BMI及能量总摄入可作为PG-SGA的显著预测指标。最近研究表明,结肠癌患者的膳食结构改变可以明显调节肠道菌群变化,并影响结肠肿瘤形成[16]。因此,改善化疗期间患者的营养状况,减少营养不良发生风险,并在很大程度有望会大幅度提高患者的生活质量,并提高患者在治疗期的耐受性,这将有利于临床治疗计划的顺利开展。
在接受化疗的患者中,在治疗前增加膳食摄入量也可能无益。有报道称,短期禁食可以保护正常细胞,但不能保护小鼠和细胞培养中化疗药物的癌细胞[17]。已有多项研究发现,癌症患者的膳食摄入量与生活质量和营养状况等的改善有相关性[18-19],但并未分析患者预后的死亡率。吞咽困难患者的营养支持可能是强制性的,不像患者由于癌症本身引起的厌食症,对食管癌吞咽困难的患者来说,肠内支持也会产生相同的预后且并不存在吞咽问题。癌症恶病质相关的厌食症和随后体质量减轻的预后价值问题也非常关键,一方面,克服厌食症非常困难;另一方面,厌食症的强度可能反映癌症的严重程度[20]。
本研究表明,对老年患者化疗期间营养不良风险的个人膳食建议能明显改变老年结肠癌患者营养参数,且研究发现BMI及能量总摄入量在一定程度上可作为PG-SGA评分的显著预测指标甚至是独立预测指标,这说明对于老年结肠癌患者来说,这两个指标在评估化疗期间营养不良风险具有重要的预测价值。总之,老年癌症患者在化疗期间必须注意患者营养状况改善,主要干预措施包括在化疗期间需提醒患者蛋白和能量的摄入,并避免脂肪的摄入量太多,同时要保证维生素及膳食纤维等摄入,这些均对能量代谢发挥了重要作用。

