模拟移动床分离D-果糖与D-阿洛酮糖的色谱模型参数及传质系数测定
周锦怡 武国庆 郭元亨 陈博 武丽达 李义 佟毅

摘 要:以固定化酶催化转化后的D-果糖及D-阿洛酮糖的混合糖浆为原料,采用阴阳离子树脂对反应后的混合糖浆进行脱盐预处理,脱盐后的电导率为(14.4±0.5)μs·cm-1。对D-果糖及D-阿洛酮糖在不同类型树脂上的保留行为及分离效果进行研究,确定了DOWEX 310Ca树脂为适宜的固定相。此外,在不同流速条件下测定了固定相DOWEX 310Ca树脂的色谱柱参数并计算得到两组分的传质系数。本研究获得的色谱模型参数及传质系数可以为后续D-阿洛酮糖产品分离实验、生产优化操作及工业化放大设计提供基础数据。
关键词:D-阿洛酮糖;D-果糖;传质系数;模拟移动床;色谱分离
Abstract:The mixed syrup of D-fructose and D- psicose that produced by immobilized enzyme catalysis process, were used as the raw material during the separation process. The mixed syrup subjected to desalination pretreatment with anion and cationic resin. The conductivity after desalination of (14.4 ± 0.5) μs·cm-1. The retention behavior and separation effect of D-fructose and D-psicose on different types of resin were studied, and DOWEX 310Ca resin was determined as a suitable stationary phase. The column parameters of the stationary phase DOWEX 310Ca resin were measured under different flow rates, and the mass transfer coefficients of the two components were calculated. This study provided basic data for subsequent D-psicose product separation experiments, production optimization operations, and industrial scale-up design.
Key words:D-Psicose; D-Fructose; Mass transfer; Simulated moving bed; Chromatographic separation
中图分类号:TS245.4
目前,世界范围内糖尿病、高血压和高脂血症等肥胖相关疾病的患病率和发病率显著增加[1],根据有关研究表明,全球2010年大约有2.8亿人患有糖尿病,预计到2030年患者将会增加至4.3亿,高脂肪、高热量食品是导致这种情况的主要原因。在这一背景下,国家越来越重视食品的安全性和对人体健康的影响。2017年,国务院办公厅发布的《中国防止慢性病中长期规划》(2017—2025年)指出,以健康促进和健康管理为手段,到2020年降低慢性病导致的过早死亡率较2015年降低10%。积极开展慢病防治是推动由疾病治疗向健康管理转变的重要手段,因此,饮食中糖分的“健康摄取”成为新的健康课题,其中,低热量甜味剂的开发和应用是最为有效的途径之一[2]。
D-阿洛酮糖作为一款新型甜味剂,其甜度约为蔗糖的70%,热量约为蔗糖0.3%。与其他天然甜味剂相比,D-阿洛酮糖的热值明显偏低,与蔗糖相比,D-阿洛酮糖可同等程度的满足消费者对甜味的味觉需求,其甜味温和,且甜度不随温度变化而变化,是一款蔗糖的完美替代品[3]。此外,研究表明,D-阿洛酮糖能明显抑制体重的增加和腹部脂肪的堆积,每天摄入超过6.7%总碳水化合物的D-阿洛酮糖,可以明显抑制餐后血糖水平[4]。因此,D-阿洛酮糖在控制肥胖和糖尿病治疗方面具有极大的潜力,可以作为糖尿病人食用的新型甜味剂,具有良好的应用前景[5]。
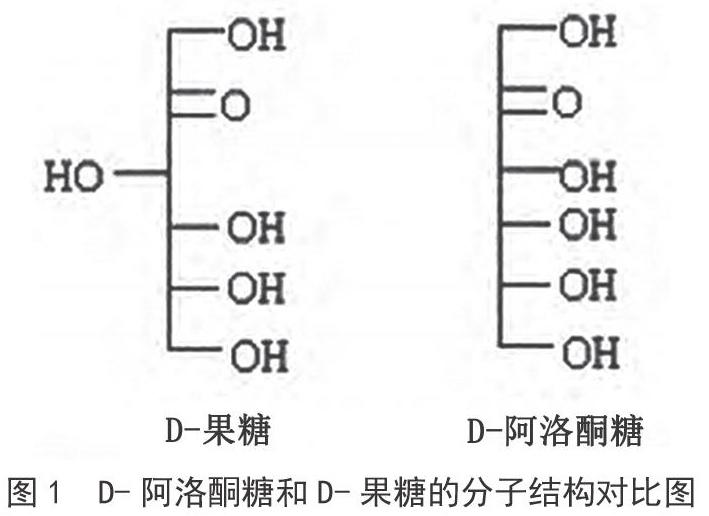
目前,D-阿洛酮糖主要通过生物合成制得[5]。生物合成法以果糖为底物,通过D-阿洛酮糖3-差向异构酶的催化生成阿洛酮糖[6-7]。经过异构酶催化转化得到的D-阿洛酮糖与未转化的D-果糖最终会同时存在于溶液体系中。从图1可以看出,果糖及阿洛酮糖结构十分相近[8],因此采用普通的方法很难实现将二者分离开来,目前多采用色谱分离法,主要包括离子交换色谱[9-10]和模拟移动床色谱[11-12]等。其中,模拟移动床(SMB)色谱技术具有节约流动相、自动化程度高、分离效率高、操作费用小等优势,近年来在食品行业中应用得到快速发展,尤其是在糖类工业中已得到大规模的应用[13]。其中,果糖與葡萄糖的分离是SMB在糖类成分制备中起步最早的,也是目前制糖工业分离中规模最大的[14]。20世纪80年代,美国UOP公司采用Sarex分离过程,以Ca型离子交换树脂或者分子筛作为填料,水作为洗脱机,首次实现葡萄糖与果糖的分离[15]。当前,SMB分离果葡糖浆已经在我国实现大规模生产。中粮生化能源(公主岭)有限公司、中粮上海(融氏)生物科技有限公司均建成了年产10万吨以上的F55生产线[12]。此外,SMB也用于木糖[16]、阿拉伯糖[17]、海藻糖[18]、甜叶菊甙[19]的分离,目前在国内企业均实现产业化应用。
中粮营养健康研究院在小试的基础上,采用SMB技术对混合糖浆中D-果糖及D-阿洛酮糖进行分离纯化,阿洛酮糖纯度可以到98%,收率达到70%。虽然目前采用SMB分离可以达到较好的效果,但是操作参数仍有很大的优化空间,通过优化工艺参数,可以进一步降低生产成本,提高工艺经济性。对于SMB分离过程而言,溶质的传质性质的研究不仅是色谱分离的基础,也是工业色谱放大及优化的重要前提[20]。因此,需要通过实验对D-果糖与D-阿洛酮糖的传质等动力学数据进行测定,为后续模拟和优化SMB提供基础数据。
1 模拟移动床色谱分离原理
1.1 D-果糖与D-阿洛酮糖分离原理
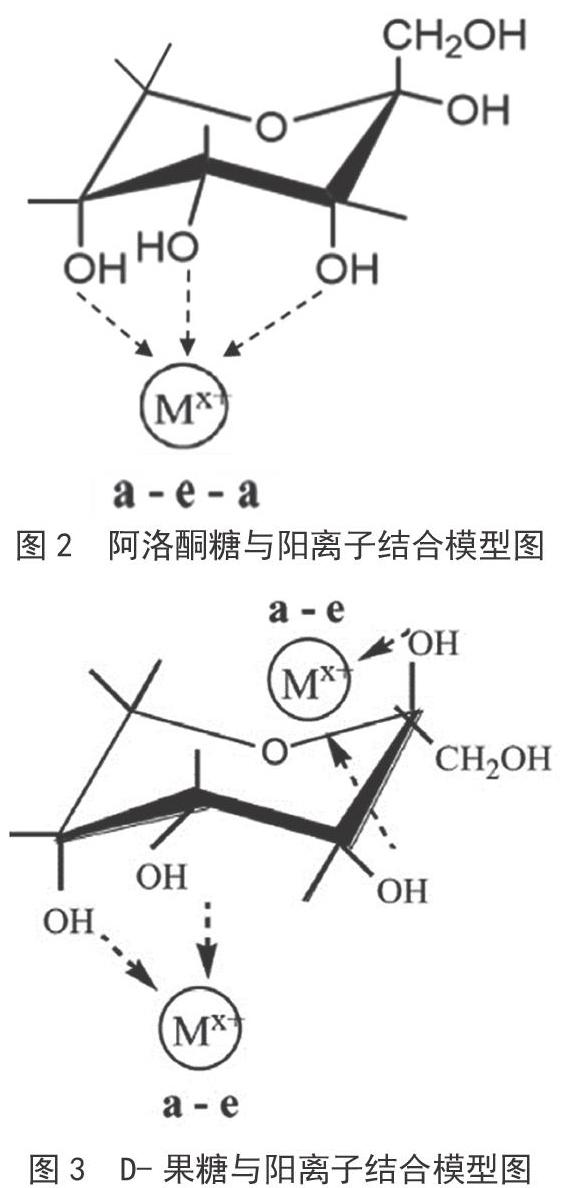
在SMB分离过程中,固定相直接影响吸附选择性、保留时间和载量,因此固定相的选择至关重要。最早用于果葡糖浆分离介质的是分子筛,固定K+的X型沸石对葡萄糖具有吸附作用,而固定有NH4+、Na+、Ca2+或Ba2+离子的沸石对果糖具有吸附选择作用。目前广泛应用的分离介质是离子交换树脂,其较沸石具有更好的稳定、均匀性及再生性能[21]。20世纪80年代,美国UOP公司将Ca2+离子交换树脂作为分离介质用于果糖与葡萄糖的分离,并实现大规模工业化生产。离子交换树脂是利用不同类型的糖与阳离子亲和力的差异实现分离的目的。理想的阳离子和糖的结合模型中,相邻的羟基具有2对轴向-平伏的排列(a-e),没有平伏-平伏的羟基排列(e-e),如图2所示。Goulding研究发现,相邻羟基的a-e排列与阳离子的结合能力远大于e-e排列,即a-e排列越多,结合越牢固,如β-D-吡喃果糖有两对不相邻的a-e排序,而β-D-吡喃D-葡萄糖没有a-e的排序[21-22]。分析D-阿洛酮糖的构型,其轴向-平伏键的排列最接近于理想模型(如图3所示),因此与阳离子的结合最为牢固。因此从理论上讲,阳离子交换树脂是有可能将D-果糖与D-阿洛酮糖相互分开的。
1.2 SMB分离原理
SMB色谱技术的分离原理与真实移动床(TMB)基本相同,是基于固定相对各组分的吸附能力的强弱差异进行分离。在TMB分离过程中,固定相由于重力作用,自上而下地移动,到达底部后,解吸完全的固定相被提升到顶部重复使用;流动相则由下而上移动。SMB的不同点是吸附颗粒被装填后不再移动,而是由原料进口和产品液流出口之间不断切换的方法,通过形成吸附颗粒和液流的相对逆流运动来模拟固定相的移动,典型的四带结构SMB如图4所示[23]。
1.3 单柱色谱模型
SMB模型由单柱色谱模型和各区带间的衔接条件构成。单柱色谱模型基于吸附床层微元内的物料守恒,是研究色谱分离过程的基础,也是过程进行设计及优化的前提[24]。目前,常见的色谱模块包括一般速率模型(GR模型)、理想模型、平衡扩散模型及集总动力学模型等。其中,平衡扩散模型和集总动力学模型是在理想模型的基础上发展而来。由于传质阻力不可忽略,因而采用集总动力学模型测定色谱模型参数,该模型的模型方程见式(1):
组分k在固定相中的传质平衡方程见式(2):
2 材料与方法
2.1 材料与仪器
D-果糖(VWR公司)、D-阿洛酮糖(上海立足生物科技有限公司),均为色谱纯;实验用水,均为Milli-Q水净化系统制备的超纯水(Millipore,Bedford,MA,USA)。
LX-160型阳离子交换树脂、D-354型阴离子交换树脂,西安蓝晓科技新材料股份有限公司生产;DOWEX 310 Ca特种凝胶型阳离子交换树脂,陶氏化学公司生产;Agilent 1260高效液相色谱分析系,美国Agilent公司生产;Centrifuge 5424恒温水浴锅,德国Eppendorf公司生产;RE-2002旋转蒸发器,北京神泰伟业仪器设备有限公司生产;PAL-1手持糖度仪,日本ATAGO(爱拓)公司生产;KQ-500DE数控超声波清洗器,昆山市超声仪器有限公司生产。
2.2 实验方法
2.2.1 高效液相色谱定量分析
配制20 g·L-1 D-果糖及D-阿洛酮糖标准液,依次稀释成1、2、5、7 g·L-1和10 g·L-1。采用Agilent 1260系列高效液相色谱(HPLC)系统测定混合糖浆中D-果糖及D-阿洛酮糖的含量,以标准品浓度为横坐标,峰面积为纵坐标分别绘制D-果糖及D-阿洛酮糖的标准曲线,根据标准曲线对分离前后的D-阿洛酮糖浓度进行定量分析。HPLC系统包括G1311C四元泵、G1316A柱温箱、G1329B自动进样系统和G1236A示差检测器,色谱柱为Waters sugar-PakI (10 μm,6.5 mm×300 mm);柱温为80 ℃,RID检测温度为55 ℃,流动相为水,流速为0.4 mL·min-1。所有样品进样前均使用0.45 μm的微滤膜过滤,样品进样量为20 μL。
2.2.2 样品溶液制备及预处理
前处理工艺流程如图5所示。以D-果糖为原料,通过树脂固定化酶进行异构化反应,反应结束后,通过抽滤实现混合糖浆与树脂固定化酶的分离,固定化酶回收利用进行下一次催化反应,混合糖浆进行脱盐处理,除去溶液中残留的离子。通过LX-160型阳离子交换树脂脱除金属阳离子,采用D-354型阴离子交换树脂脫除阴离子,使溶液的电导率为下降到50 μs·cm-1以下。脱盐后的反应液进行旋转蒸发,浓缩至干固含量为50%备用。
2.2.3 固定相的筛选
SMB分离技术中,固定相和流动相的选择至关重要。对于糖类的分离,流动相通常采用纯净水[21],因此固定相的选择尤为重要。色谱分离中,树脂的吸附选择性越高,分离效果越好。采用高效液相色谱(HPLC)对DOWEX 310Ca、DOWEX 310Na、DOWEX 310K及DOWEX 310H四种阳离子交换树脂分离效果进行评价。其中,流动相为去离子水,流速10 mL·min-1,色谱柱温度60 ℃,检测器采用示差折光检测器,所有样品进样前均使用0.45 μm的微滤膜过滤。
2.2.4 色谱柱孔隙率的测定
孔隙率是色谱柱重要参数之一[25]。对于凝胶型色谱柱,一般采用蓝葡聚糖作为示踪剂[27]。通过测定示踪剂在DOWEX 310Ca色谱柱上的保留时间,计算出色谱柱的孔隙率ε,如式(3)所示。
式(3)中,V0-系统死体积,VD-色谱柱孔隙体积;
V-色谱柱体积。
色谱实验条件为:柱温60 ℃,在流量10~14 mL·min-1条件下脉冲进样1 g·L-1的蓝葡聚糖示踪剂,设置紫外检测器记录蓝葡聚糖的流出曲线,紫外检测波长254 nm。
2.2.5 传质系数的测定
对于二元组分,色谱柱上微元段的物料衡算方程见式(4)[25]。
组分的理论板数N与脉冲实验流速u、传质扩散系数DL及总传质系数km有关[26],根据上述条件可推到出式(7)。
2.3 数据分析
本实验全部实验数据用WPS Office表格进行统计处理,数值以均值±标准差表示,采用软件Origin 9.1进行绘图。
3 结果与分析
3.1 高效液相色谱定量分析
D-果糖和D-阿洛酮糖的标准曲线如图6、图7所示,所得的回归方程如式(8)、式(9)所示。
3.2 固定相的筛选结果
通过单柱脉冲实验考察了不同类型的树脂对于D-阿洛酮糖与D-果糖的分离情况,结果如图8(a)~图8(d)所示。分离过程中两种糖类的保留行为(保留时间μ与σ2方差)结果如表1所示。
从上述结果可以分析得出,由于不同型号的树脂性能上的差别,导致相同分离条件下分离结果存在差异。树脂的离子型式对于保留行为和分离性能有较大影响,对于阿洛酮糖,Ca型树脂保留性能最强,K型和Na型树脂保留性能居中,H型树脂保留相对较弱,体现在峰展宽和保留时间的不同。综合分析,选择分离效果最好Ca型阳离子交换树脂作为SMB色谱分离的分离介质。
3.3 孔隙率及传质系数测定结果
根据式(3)中流动相流量Q与出峰时间t的可以测定色谱柱孔隙率V0,具体实验结果见表2。
除了树脂的选择以外,传质系数是色谱分离性能极为重要的判断依据[27]。在流速5~10 mL·min-1的实验范围内测定D-果糖及D-阿洛酮糖的流出曲线,实验结果见表3。
理论板数N与u·λ的关联结果见图9。
D-果糖与D-阿洛酮糖的拟合方程见式(10)及式(11):
从图7可以看出不同流速下u·λ与1/N均呈线性相关,根据图9的斜率和截距并结合式(7)可以得到D-果糖及D-阿洛酮糖的理论板数及传质系数:
4 结论
本文对混合糖浆中阿洛酮糖的分离过程进行研究。采用阳-阴离子树脂,对酶催化转化反应后的混合糖浆进行脱盐预处理,脱盐后的电导率为(14.4±0.5)μs·cm-1。对分离D-果糖及D-阿洛酮糖的固定相进行筛选,通过考察D-果糖及D-阿洛酮糖在不同类型树脂上的保留行为及分离效果,确定DOWEX 310Ca树脂为适宜的固定相。对D-果糖和D-阿洛酮糖的色谱模型参数及传质系数进行测定,在流速5~10 mL·min-1的范围内,D-果糖和D-阿洛酮糖的传质系数分别为4.84 min-1及24.2 min-1,色谱柱孔隙率为0.092,为后续进一步优化SMB分离过程提供基础参数。
参考文献:
[1]帅玉英,孙怡,吴晓花,等.低热量甜味剂D-阿洛酮糖的生产应用研究进展[J].中国食品添加剂,2014(9):159-163.
[2]郭元亨,吕哲,丁子元,等.乙醇体系中D-阿洛酮糖的结晶工艺优化[J].食品工业科技,2019(24):185-189,198.
[3]Matsuo T,Suzuki H,Hashiguchi M,et al.D-Psicose Is a Rare Sugar That Provides No Energy to Growing Rats[J].Journal of Nutritional Science & Vitaminology,2002,48(1):77-80.
[4]黄维来.D-阿洛酮糖对大鼠血糖调节以及脂代谢的影响[D].无锡:江南大学,2017.
[5]佟毅,沈雪梅,王靖,等.一种新型D-阿洛酮糖3-差向异构酶及其应用:201711458026.0[P].2017-12-28.
[6]沈雪梅,王靖,张媛,等.D-阿洛酮糖的功能及其生物合成研究进展[J].生物工程学报,2018,34(9):54-66.
[7]Men Y,Zhu P,Zhu Y M,et al.The development of low-calorie sugar and functional jujube food using biological transformation and fermentation coupling technology[J]. Food science & nutrition,2019,7(4):1302-1310.
[8]Ochiai M,Onishi K,Yamada T,et al.D-Psicose increases energy expenditure and decreases body fat accumulation in rats fed a high-sucrose diet[J]. International Journal of Food Sciences & Nutrition,2014,65(2):245-250.
[9]冯再平,沐万孟,江波,等.生物转化法产D-阿洛糖的分离纯化[J].食品工业科技,2014,35(22):304-307.
[10]张明站,干昭波,窦光鹏,等.一种高纯度D阿洛酮糖的制备方法:CN201611095914.6[P].2017-12-26.
[11]佟毅,李義,刘颖慰,等.一种用于分离糖类物质的模拟移动床和方法:CN201811412850.7[P].2019-04-19.
[12]郭元亨,刘颖慰,丁子元,等.模拟移动床在食品行业中的应用进展[J].现代食品,2019(21):3-11.
[13]方煜宇,万红贵.连续制备色谱及其在制糖工业中的应用[J].中国食品添加剂,2004,18(6):93-97.
[14]沈树宝,欧阳平凯.吸附分离果糖和葡萄糖的基础研究[J].南京化工学院学报,1990,12(2):25-30.
[15]韩一松.超临界流体色谱分离EPA-EE和DHA-EE的基础研究[D].杭州:浙江大学,2007.
[16]于伟,李良玉,李朝阳,等.顺序式模拟移动色谱分离木糖醇母液的前处理工艺研究[J].中国食品添加剂,2015(10):70-76.
[17]雷光鸿,姜毅,魏承厚,等.模拟移动床色谱分离蔗髓提取物制备L-阿拉伯糖和D-木糖的研究与应用[J].食品科技,2015,4(3):214-217.
[18]杨亚威,王瑞明,李丕武,等.模拟移动床色谱分离海藻糖和葡萄糖[J].食品工业科技,2013(14):251-253.
[19]李洪飞.模拟移动色谱法分离甜叶菊甙的工艺技术研究[D].大庆:黑龙江八一农垦大学,2012
[20]Cunha F C,Secchi A R,Souza M B,et al. Separation of praziquantel enantiomers using simulated moving bed chromatographic unit with performance designed for semipreparative applications[J].Chirality,2019,31(8):583-591.
[21]姜夏伟,王亚军,郑裕国.模拟移动床色谱技术分离果糖研究进展[J].发酵科技通讯,2015,44(4):55-60.
[22]Lin R,Tavlarides LL. Determination of diffusion coefficients by supercritical fluid chromatography: Effects of mobile phase mean velocity and column orientation[J].Journal of Chromatography A,2010,1217(26):4454-4462.
[23]Lee J W,Kienle A,SeidelMorgenstern A.On-line optimization of four-zone simulated moving bed chromatography using an Equilibrium-Dispersion Model:II. Experimental validation[J]. Chemical Engineering Science,2020,225(2):115808.
[24]林炳昌.模擬移动床色谱技术[M].北京:化学工业出版社,2008.
[25]陈永涛,刘颖慰,丁子元.色谱法测定葡萄糖果糖在制备柱上的传质和扩散系数[J].当代化工,46(1):190-192.
[26]Xu J,Zhu L,Xu G,et al. Determination of competitive adsorption isotherm of enantiomers on preparative chromatographic columns using inverse method[J]. Journal of Chromatography A, 2013, 1273(18):49-56.
[27]任其龙,苏宝根,熊任天,等.EPA和DHA在超临界流体色谱柱中的传质动力学[J].化工学报,2001,52(9):788-792.

