56例HIV抗体免疫印迹试验不确定结果的随访分析
秦 攀,李 青,杨晓亮,邢 燕,余泽波
重庆医科大学附属第一医院输血科,重庆 400016
目前,艾滋病仍是全世界面临的重要公共卫生问题。据2018年调查统计,全球约有3 790万人感染艾滋病,其中新发感染者约170万,全年约77万人死于与艾滋病相关的疾病[1]。在艾滋病防治工作中,从早期的感染诊断、疾病进程的判断,到之后的抗病毒疗效监测,实验室检测都是不可或缺的一部分,主要包括人类免疫缺陷病毒(HIV)抗体检测、HIV核酸检测、CD4+T淋巴细胞计数等。HIV抗体筛查检测的方法包括酶联免疫吸附试验(ELISA)、化学发光免疫分析(CIA)或免疫荧光试验(IFA)、快速检测(RT)及其他试验[2]。HIV抗体确证试验是HIV感染诊断的金标准[3],目前常用的有免疫印迹试验(WB)、条带/线性免疫试验(RIBA/LIA)。由于HIV检测力度的加大,出现HIV抗体检测不确定结果的数量也逐年增加,给临床手术和治疗带来一系列问题,重复检测会给患者和家属带来较大的心理压力,同时对人力及试剂也造成严重的浪费。本研究将2017-2018年本院HIV确证试验结果不确定的患者特征及转归情况进行汇总分析,旨在为HIV检测策略的制订提供依据,帮助不确定结果的解释及对阳性转归的预判,现报道如下。
1 资料与方法
1.1一般资料 将2017年1月至2018年12月本院门诊及住院患者中HIV抗体筛查试验有反应,经重庆市渝中区疾病预防控制中心确证实验室检测后报告“HIV抗体不确定”者纳入研究,共56例,其中男39例,女17例;年龄22~84岁;患者的科室分布见表1。
1.2方法
1.2.1筛查和确证试验 所有送检的患者标本均由两种及以上的试剂进行抗体筛查试验:ELISA采用北京科卫临床诊断试剂有限公司生产的HIV抗原抗体诊断试剂盒,CIA采用深圳迈瑞生物医疗电子股份有限公司生产的HIV测定试剂盒,两种试剂均为HIV抗原抗体筛查试剂;RT采用美艾利尔HIV1+2型抗体检测试剂盒,为HIV抗体筛查试剂。确证试验:WB采用MP生物医学亚太私人有限公司生产的HIV1+2型抗体检测试剂盒。以上所有试剂均经国家食品药品监督管理总局注册,在有效期内按照试剂说明书进行操作。使用的仪器包括Tecan sunrise酶标分析仪、汇松PW-960型洗板机、迈瑞全自动化学发光免疫分析仪CL-2000i型、迈瑞全自动化学发光免疫分析仪CL-6000i型、上海迅达XD-236型免疫蛋白印迹仪。
1.2.2WB结果的判定 HIV抗体确证试验结果根据条带并结合带型进行判定。HIV抗体不确定结果的判定标准是出现HIV-1抗体特异带(env 带:gp160/gp120、gp41,gag 带:p55、p24、p17,pol带:p66、p51、p31),但不足以判定阳性,随访期间如带型没有进展或呈阴性反应,则报告阴性;如出现阳性反应,则报告阳性;可视情况决定是否继续随访。无 HIV 抗体特异带出现,则判定为 HIV 抗体阴性,报告阴性;如符合HIV-1抗体阳性判定标准,则报告HIV-1抗体阳性。检测结果参照《全国艾滋病检测技术规范(2015年修订版)》[2]和试剂说明书判定。
1.2.3质量控制 根据《全国艾滋病检测技术规范》质量控制要求,进行室内质量控制和能力验证计划以保证检测质量。室内质控设置试剂盒内部对照,并用第三方商品化质控品以Levey-Jennings质控图和Westgard多规则控制程序监测检测质量。实验室每年通过国家卫生健康委员会临床检验中心和重庆市艾滋病确证中心实验室组织的能力验证计划。
1.3统计学处理 采用Excel2007软件进行数据记录。使用SPSS21.0软件进行统计分析,百分率的比较采用Fisher确切概率法,P<0.05为差异有统计学意义。
2 结 果
2.1患者随访情况 随访完成和转归情况见表1。完成随访的占58.93%(33/56),失访占41.07%(23/56,其中死亡4例,未复核检测19例)。完成随访者中,转阳性的占84.85%(28/33),转阴性的占15.15%(5/33);男性转阳性者占63.64%(21/33),女性转阳性者占21.21%(7/33),两者比较差异有统计学意义(P=0.03)。
2.2患者标本的筛查试验 采用ELISA、CIA、RT 3种方法中的两种进行筛查试验,见表2。两种筛查试验均有反应与仅一种筛查试验有反应的患者转阳率分别为92.59%(25/27)、50.00%(3/6),两者比较差异有统计学意义(P=0.031)。
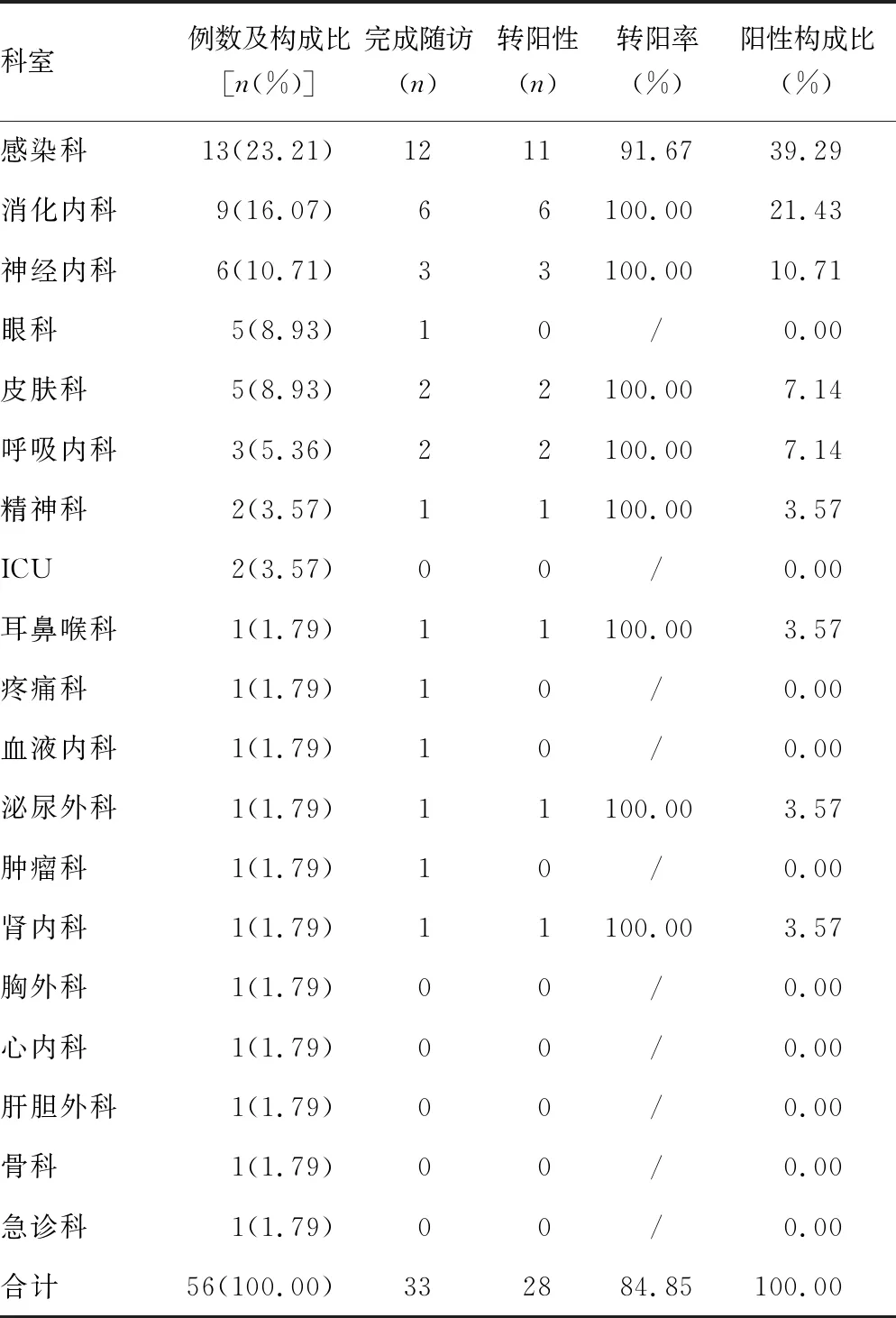
表1 患者科室分布及随访情况
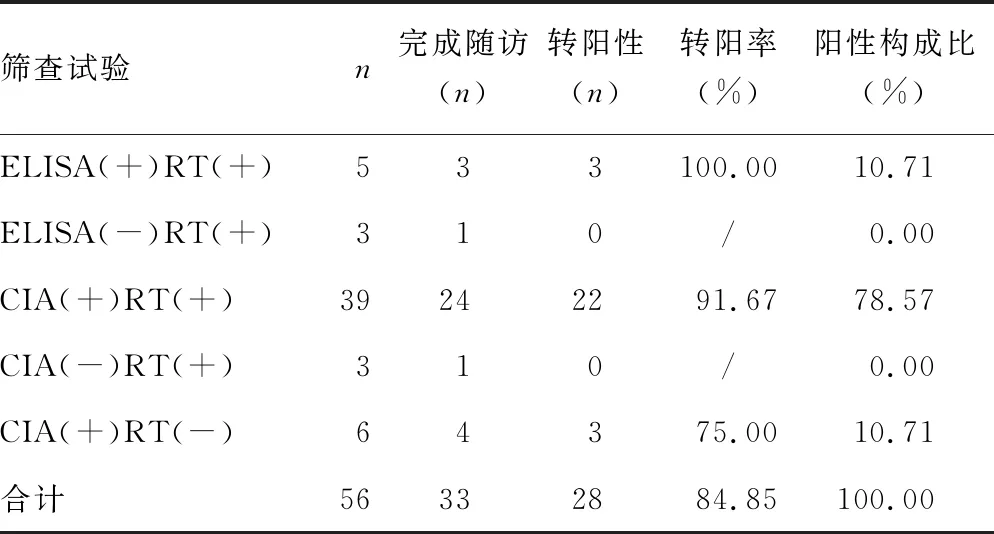
表2 患者标本的筛查试验
2.3WB带型分布及随访情况 共检出9种WB带型,gp160带型所占比例最高,见表3。完成随访的患者标本中检出了7种WB带型,同样是gp160带型所占比例最高;带型是1条带的患者转阳率为64.29%(9/14),2条带的患者转阳率为100.00%(8/8),3条带的患者转阳率100.00%(11/11),三者比较差异有统计学意义(P=0.018)。共检出6种条带,条带出现频次共105次,gp160所占比例最高,见表4。完成随访的患者标本中检出5种条带,gp160检出频次所占比例最高;条带间转阳率比较,差异无统计学意义(P=0.107)。

表3 检出带型的分布及随访情况
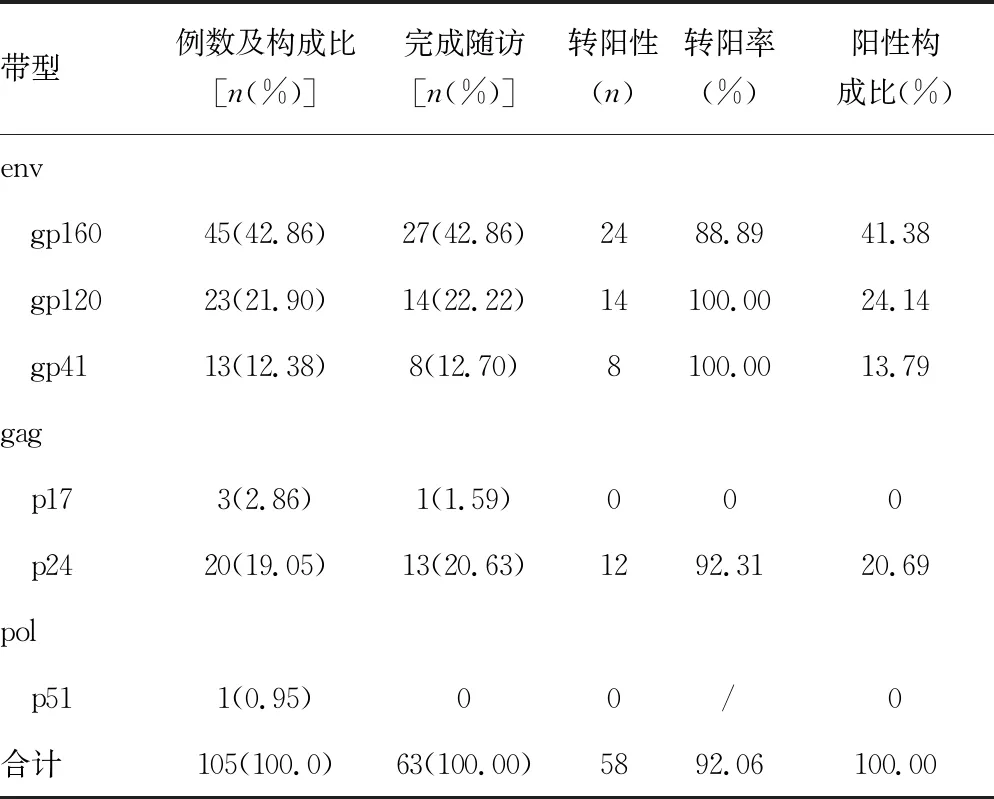
表4 条带检出频次的分布及随访情况
3 讨 论
引起HIV抗体检测不确定结果的因素较多,如HIV感染后的“窗口期”、抗体滴度低,常造成漏检或出现不确定结果;艾滋病终末期时,机体免疫系统被破坏,免疫力降低,抗体水平下降等因素也会导致抗体检测不确定结果的反复出现;其他非特异性反应,如其他病原微生物感染、自身免疫性疾病,某些恶性肿瘤等均可引起HIV抗体不确定结果出现[4-6]。根据《全国艾滋病检测技术规范》的相关规定,建议对“HIV抗体不确定”者进行HIV核酸检测或2~4周后随访。本科室按照规定进行了随访,但患者流动性大,区县及外地人口居多,由于随访检测需要一定周期,且本科室目前尚未开展HIV核酸检测,因此此类患者在初次报告“HIV抗体不确定”后大多转到当地疾控中心或艾滋病定点医院进行后续检测,随访依从性较差,跟踪监测数据获得难度较大,故失访率较高(41.07%),此为本次研究的不足之处。在未来的工作中,将会针对院内“HIV抗体不确定”患者设计更加合理有效的医学随访方案,缩短随访时间,优化检测策略,降低失访率,做到及时诊断,降低感染传播的风险。
本研究中的患者分布于19个科室,其中转阳患者例数居前三位的科室为感染科、消化内科、神经内科,另外皮肤科、呼吸科、眼科、耳鼻喉科、精神科等也均有分布,与HIV感染的临床表现多样性相符合[7]。潜在的HIV感染者可能会到不同的科室就诊,为减少对HIV感染者的漏诊,应加强医院各科室就诊者的主动检测。完成随访的33例患者中有5例转为阴性,条带均只有1条;其中3例的带型为gp160,分别来自于血液科、肿瘤科、疼痛科;1例带型为p24,来源于眼科;1例为p17,来源于感染科;考虑可能与患者基础疾病(血液肿瘤、细菌或病毒感染)引起的非特异性反应相关。在完成随访者中,男性转阳性者的比例高于女性,与相关报道一致[8-11],需加强规范男性患者寻找临时性伴侣行为。
随访结果显示,两种筛查方法均有反应的患者转阳率明显高于两种筛查方法中仅一种有反应的患者,且条带数量与患者转阳率呈正相关,2条带及以上的带型患者全部转阳性,提示应高度关注此类患者。本研究中的条带基因组以env、gag为主,且env转阳率较gag高,提示env在HIV感染中意义更大[12]。1条带的带型并不是全部转阳,1例p17带型的患者随访结果为阴性,包括gp160、p24带型的患者均有转阴的情况,此时应警惕干扰因素,结合患者临床资料、流行病学史,加做HIV核酸检测,综合判断[13-16]。
综上所述,引起HIV抗体检测不确定结果的因素较多,两种筛查方法均有反应,WB检测结果为2条带以上的情况均提示有极大感染风险,应高度重视,密切随访;只有一种筛查试验有反应或WB检测结果为1条带的情况也不容忽视,应结合患者的流行病学资料,积极借助其他的检测方法,缩短检测窗口期,尽早明确诊断。

