副溶血性弧菌质粒DNA参考物质的研制
林晓峰 努色热提·阿布都沙拉木 袁暮云 许龙岩★ 陈瑶★
副溶血性弧菌(Vibrio parahaemolyticus,VP)是一种革兰氏阴性嗜盐性细菌,由VP引起的食源性疾病已超过沙门氏菌,跃居于食源性致病菌的首位,成为当前世界上分布最广泛、最常见的疾病之一,是国内外极为重视的公共卫生安全问题之一[1]。一系列研究表明致病性VP的毒力因子主要有溶血性毒素、脂多糖、尿素酶等。其中,溶血素类毒力因子包括tdh、tlh、trh和能刺激tdh的溶血功能toxR[2-3]。在VP检测中同时检测特异性和毒力基因将有利于我们快速判断VP感染的危险性。具有序列和量值可溯源性的参考物质将极大提高检测能力和实验室之间结果的可参考性[4-6]。目前应用于副溶血弧菌检测的核酸参考品尚十分缺乏,主要为从副溶血弧菌培养物中提取的细菌基因组。基因组DNA 作为参考品,难以同时为多个靶标提供可溯源的定量参考,无法在多种检测试剂和方法之间提供可参比的参考性[6-7]。因此,本研究拟构建包含多个检测靶标的质粒核酸参考品,提高VP核酸检测结果的可比性,解决病原核酸检测能力快速发展与缺乏参考材料之间的矛盾。
1 材料与方法
1.1 质粒构建
副溶血性弧菌检测常用的目的基因序列tdh选取(LOCUS BA000032)、trh(GenBank:GU971654.1)、tlh(GenBank:EF640376.1)、toxR(847892-848770 LOCUS AB063113)。在选取基因的时候,尽量包含基因全长,以保证所制备的核酸参考物质可以模拟基因的完整的形态。以人工合成的方法将这四个基因串联在一起(以不相关的基因片段aagtcg 隔开),并克隆到pUC57 中以形成重组质粒(图1),大量培养重组大肠杆菌,经提取和纯化获得重组质粒DNA(pDNA)[8-9]。
1.2 纯度检验
采用紫外分光光度法对质粒DNA 的纯度进行鉴定,通过测出样品在260 nm、280 nm、230 nm波段的紫外光下的吸光度值(A260,A280,A230),确定样品纯度,排除RNA 和蛋白质污染。
1.3 均匀性研究
按照《JJG1006-1994 一级标准物质技术规范》[6]使用紫外法对所制备的质粒DNA 参考物质的均匀性进行检验。瓶间均匀度检验:随机选择10 管pDNA,并用UV 重复测量每管中提取的1 μL样品3 次,取平均值。瓶内均匀度检验,随机选择9 管pDNA,并从每管样品的上层,中层和下层提取1 μL 测试样品,紫外分光光度法用于定量样品DNA 含量。通过方差分析(F 检验法)分析测量结果并进行判断。根据公式①计算质粒DNA 的瓶间不均匀性引起的不确定度(uh):

其中:Q1为组间差方和,Q2为组内差方和,v1为组间自由度,v2为组内自由度,n 为组内测量次数。
1.4 稳定性研究
监测质粒DNA 在储存期间的长期稳定性,为期一年。每月对质粒DNA 参考物质随机抽取3瓶,每个样品的浓度重复测定3 次,综合整理数据,对质粒DNA 参考物质的长期稳定性和不确定度的进行评估。进一步根据公式②计算质粒DNA在12 个月内的长期稳定性引起的不确定度(us):

其中:β1是稳定性线性模型中的斜率,S(β1)是斜率的标准偏差,N 是稳定性评估的总时间,N=12 个月。
1.5 标准值的确定
质粒DNA 参考物质的浓度由8 家实验室用紫外方法协同测定,并通过统计检查确认每组数据没有异常值和显着差异后,将8 家实验室的测试结果平均值取作质粒DNA 参考物质的标准值。根据公式③计算质粒DNA 在定值过程引入的不确定度(uq):

其中:s 为总平均值的标准偏差,p 为实验室数目。
1.6 标准值的不确定度评估
质粒DNA 参考物质的不确定度主要来源于三部分,第一部分是由不均匀性带来的不确定度(uh),第二部分是长期保存稳定性引入的不确定度(us),第三部分即定值时由定值方法和仪器引入的不确定度(uq)。然后按照公式④计算参考物质的标准不确定度:

计算扩展不确定度时,应将标准不确定度乘以包含因子(k)。所以,扩展相对不确定度计按公式⑤计算:

1.7 qPCR 实验
通过紫外法分别对提取的质粒DNA 参考物质及从VP 标准菌株和分离菌株中提取的gDNA进行定量。根据公式⑥计算每微升质粒DNA 和基因组DNA(gDNA)的拷贝数。

660×(DNA size bp)(g/mol)
根据副溶血性弧菌基因组大小3.29 Mbp 估算gDNA 的拷贝数,并基于5 179 bp 估算重组质粒DNA 的拷贝数。制备10 倍稀释系列制备2×106、2×105、2×104、2×103、2×102和2×101copies/mL 稀释的样品。质粒DNA 和gDNA 均通过qPCR 建立标准曲线。PCR 方案如下:94℃变性10 min 后,在94℃下30 s,58℃下45 s 扩增40 个循环。见表1。

表1 tdh,trh,tlh 和toxR 基因的引物和扩增片段大小Table 1 Primer and amplicon for tdh,trh,tlh and toxR
1.8 标准曲线的建立
通过用质粒DNA 参考物质建立qPCR 的检测限(Limit of detection,LOD)和定量限(Limit of quantification,LOQ)来评估qPCR 的检测范围。并评估扩增效率(e)和斜率(K)。通过统计分析标准曲线的扩增效率(e)和斜率(K),以评估gDNA的可替换性。
1.9 统计学分析
使用SPSS 12.0 和Graphpad 5.0 软件进行统计分析。均匀性测试使用单因素方差分析。稳定性分析使用单向线性回归分析来判定pDNA 的长期稳定性。使用配对t检验分析pDNA 与gDNA 的适用性结果。以P<0.05 为差异有统计学意义。
2 结果
2.1 质粒序列的准确性验证
成功合成了含有副溶血性弧菌tdh、trh、tlh及toxR基因的DNA 片段,并将其插入克隆载体pUC57 中,形成重组质粒pDNA。pDNA 经提取纯化后,经核酸电泳和测序证实,重组质粒中插入片段的序列准确度为100%,符合预期。见图2。

图2 重组质粒DNA 的测序图Figure 2 Sequencing diagram of recombinant plasmid pDNA
2.2 纯度验证
通过紫外法测的pDNA 的A260/A280的比值为(1.897±0.236),比值在1.8~2.0 间,且A260/A230的比值大于2.0。
2.3 均匀性检验
分析结果表明,按照方差分析法(F-检验法)在95%置信水平下,可以判断质粒DNA 的特性值在瓶内均匀性上差异无统计学意义。在瓶间均匀性分析中,F>F0.05,通过比较物质的不均匀所引起的标准偏差(SH)和方法测量所造成的标准偏差(S2),由于两者相近,故瓶间不均匀性所产生的标准偏差最终需要合成到标准不确定度中。见表2。

表2 副溶血弧菌pDNA 均匀性检测的统计结果Table 2 Statistic results of homogenous test of pDNA VP
2.4 稳定性检验
通过线性回归模型作为经验模型对pDNAVP进行长期稳定性评价,通过12 个月采样分析pDNAVP的浓度建立单项线性回归方程Y=β1+β0,自由度为n-2 和P=0.95(95%置信水平)的学生分布t-因子等于0.183,结果提示|β1|<t0.95,n-2·S(β1)(n-2 是自由度,S(b1)是斜率的不确定性)。见表3。

表3 副溶血性弧菌pDNA 长期稳定性的统计结果Table 3 Statistic results of short-term stability of pDNA VP
2.5 标准值的确定
通过8 家实验室使用紫外分光光度法测定质粒DNA 的浓度,并通过统计学检验以所测定数据的总平均值χ2=29.62 μg/mL 为标准值。根据公式③计算质粒DNA 在定值过程引入的不确定度(uq):最终计算得出的定值过程引入的不确定度(uq)为0.296 μg/mL。
2.6 标准值的不确定度评估
质粒DNA 的不确定度包括来自于瓶间不均匀性引入的不确定度(uh)、长期保存稳定性引入的不确定度(us)、定值时引入的不确定度(uq)。根据公式④⑤计算质粒DNA 的标准不确定度和扩展不确定度。最终计算得到标准不确定度(Ucrm)为1.534 μg/mL,扩展不确定度(UCRM)为3.068 μg/mL(k=2)。
2.7 qPCR 标准曲线的建立
图3所示为使用所制备的质粒DNA 参考物质作为参照标准,建立qPCR 检测的标准曲线。各标准曲线的线性见表4。
2.8 质粒DNA 参考物质与副溶血性弧菌基因组DNA(gDNA)的可替代性研究
通过评估斜率和截距,在95%置信度下,可认为gDNA 建立的标准曲线与质粒DNA 参考物质建立的标准曲线之间没有显着差异(P<0.05)。见表5。
3 讨论
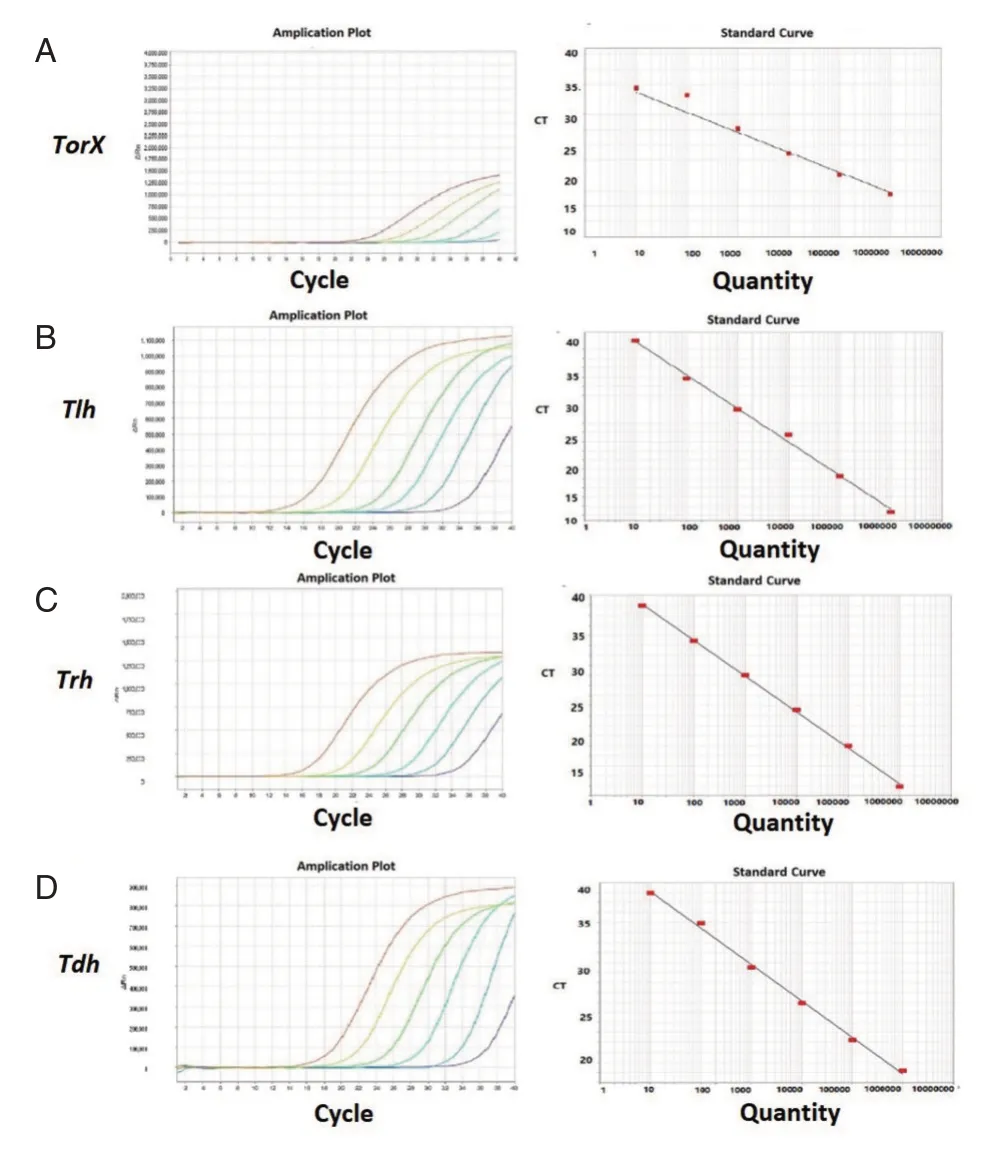
图3 副溶血弧菌pDNA 建立tdh,trh,tlh 和toxR 基因的标准曲线Figuer 3 Standard curve of tdh,trh,tlh and toxR established by pDNA VP

表4 副溶血弧菌pDNA 建立的标准曲线数据Table 4 Data for the standard curve established by pDNA VP
核酸技术的广泛使用,让核酸检测参考品的需求进一步提高。传统的基因组参考品存在以下问题:①单一菌株参考品难以覆盖所有的检测靶标。实际操作中需要使用多种基因组参考品,绘制多条标准曲线才能完成病原体的全面的检验。②序列和量值难以溯源,可以作为定性检测,但是无法对不同实验室之间的结果进行比较,也无法对实验室能力进行评定。③生物安全性问题。因此,亟待研发安全稳定,能够提供量值溯源能力的新型参考物质[10-11]。目前在双歧杆菌,H7 亚型禽流感病毒等多种病原体检测的过程中,质粒参考物质的使用已经得到了验证[12-13]。人工DNA 合成技术为核酸参考物质的制备提供了新思路,这项技术可以通过人工合成来获得完整的基因,并实现将多个检测靶标自由组合起来作为检测靶标,进而实现同时对多个检测目的基因的检测进行质量参考。

表5 副溶血弧菌pDNA 和gDNA 标准品代替性研究Table 5 Substitution of pDNA VP and genomic DNA reference material
在此次实践中,本文研制的检测质粒DNA 参考物质涵盖副溶血性弧菌多个检测目的基因(tdh、trh、tlh及toxR基因),序列正确,纯度高,均匀性好、可在-20℃条件下稳定保存一年以上,并通过联合定值的方式,使得标准品的量值可以溯源。相对于常用基因组参考品,质粒参考品弥补了现时检测中需要使用多种菌株基因组才能完成对副溶血弧菌特异性和毒力因子分析的短板。值得一提的是,使用基因组DNA 和质粒DNA 作为模板生成的标准曲线非常吻合,换而言之,本品可以代替副溶血性弧菌基因组DNA 用于副溶血性弧菌的核酸检测[13-14]。
因此,副溶血性弧菌tdh、trh、tlh及toxR基因检测质粒DNA 参考物质的研制,为副溶血性弧菌的相关核酸检测提供了量值溯源的参照标准,为副溶血性弧菌检测实验室的质量控制提供了有力保障。该质粒DNA 参考物质的推广应用,可进一步提高各实验室副溶血性弧菌相关检测项目的水平和效率,保障各实验室测量结果的可比性,准确性,提升各实验室间检测结果的认可度。
——一道江苏高考题的奥秘解读和拓展

