姜黄素对邻苯二甲酸二丁酯致昆明小鼠肾损伤的保护作用*
梁冯,晏彪
(1.湖北中医药大学检验学院,武汉 430065;2.湖北科技学院基础医学院,咸宁 437100)
姜黄素(curcumin,Cur)是一种具有抗氧化能力的自由基清除剂,可减轻肾脏肥大,减少系膜基质扩张;同时还对糖尿病肾病、肾缺血等急慢性肾脏疾病具有改善作用[1-2]。邻苯二甲酸二丁酯(dibutyl phthalate,DBP)作为主要塑化剂之一,能以不同的浓度浸入PVC医疗器械存储的溶液中,临床上某些人群包括透析患者和孕妇的血液或尿液,可能长期暴露于DBP[3]。流行病学研究显示[4],DBP及其代谢物与肾脏的一系列不良反应存在相关性,毒理学研究也证实DBP具有潜在的肾毒性[5]。本研究通过检测Cur 对DBP暴露后KM小鼠肾组织氧化应激水平、细胞凋亡相关蛋白的表达以及血清中肌酐(creatinine,Crea)和尿素氮(urea-nitrogen,Urea)含量的影响,探究Cur的潜在作用及其机制。
1 材料与方法
1.1动物 3周龄SPF级雄性昆明(KM)小鼠28只,体质量(17±1) g,购自湖北省实验动物研究中心[动物使用许可证号:SCXK(鄂)2015-0052]。小鼠饲养动物房温度20~25 ℃,相对湿度50%~70%,昼夜交替12 h,自由摄食、饮水。
1.2药品与试剂 Cur(Sigma公司,含量≥98.0%,批号:08511),DBP(Sigma公司,含量≥99.6%,批号:84742),小鼠血清Urea、Crea试剂盒(深圳市库贝尔生物科技有限公司,批号:11.01.0105),总抗氧化能力(T-AOC)试剂盒(南京建成生物工程研究所,批号:A015-2),半胱氨酸蛋白酶-3(caspase-3,Casp-3)试剂盒(BioVision公司,批号:K106-25)。Western blotting一抗:均为兔抗小鼠,β-actin(天德悦公司,批号TDY051,5%脱脂牛奶,1:10 000),细胞外调节蛋白激酶(ERK)(CST公司,批号:4695,5%BSA,1:2000),磷酸化ERK(p-ERK)(CST公司,批号4370,5%BSA,1:1000);二抗:辣根过氧化物酶(HRP)标记羊抗兔抗体(ASPEN公司,批号:AS1107,5%脱脂牛奶,1:10 000)。免疫组化一抗:兔抗Bcl-2(武汉博士德生物工程有限公司,批号:ba0412)、Bax(武汉博士德生物工程有限公司,批号:ba0315),二抗:羊抗兔IgG抗体、兔IgG过氧化物酶标记的生物素复合物(SABC-POD)及二氨基联苯胺(DAB)。
1.3仪器与设备 iMagic-M7全自动生化分析仪(深圳市库贝尔生物科技有限公司),ELx800酶标仪(美国Bio-Tek),蛋白电泳及转膜系统(美国Bio-Rad),凝胶成像及分析系统(英国Syngene),RM2245切片机(德国Leica),显微镜BX53 (日本Olympus)。
1.4动物分组及给药 28只KM小鼠随机分成4组:正常对照组、暴露组(50 mg·kg-1DBP,DBP组)、给药组(2.5 mg·kg-1Cur)、暴露+给药组(50 mg·kg-1DBP+2.5 mg·kg-1Cur,DBP+Cur),每组7只。DBP 的暴露剂量参照YAN等[6]设置为50 mg·kg-1,暴露途径为口腔灌胃;Cur的给药剂量参考ALCANTARA 等[7]选择为2.5 mg·kg-1,腹腔注射给药;DBP+Cur组中Cur先腹腔注射给药,2 h后再口腔灌胃DBP,实验鼠给药体积均为10 mL·kg-1,实验周期28 d。
1.5测量指标及方法 实验4周结束后,小鼠经心脏取血,采用小动物全自动生化分析仪测定各组小鼠的肾功能指标Urea、Crea。处死小鼠后,取约1.5 g的肾组织加预冷的PBS制成10%匀浆液,4 ℃,10 000×g离心10 min后取上清液,用于自由基(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)以及T-AOC水平的检测。二氯二氢荧光素-乙酰乙酸酯(DCFH-DA)荧光定量分析肾组织匀浆中ROS水平[8-9];硫代巴比妥酸法(TBARS)测定肾组织匀浆中MDA含量,蛋白质含量用Folin酚法测定,MDA含量(μmol·mg-1)=[6.45(A532-A600)-0.56×A600](μmol·L-1)×样本稀释倍数/待测匀浆蛋白浓度(mg·mL-1);用试剂盒测定肾组织匀浆中T-AOC水平,ELISA试剂盒测定Casp-3水平。Western blotting检测各组小鼠肾组织ERK1/2、p-ERK1/2蛋白表达情况,采集β-actin、ERK1/2及p-ERK1/2条带,以β-actin作内参,分别得到各样品ERK1/2、p-ERK1/2与β-actin的灰度比值。对各组小鼠肾组织切片进行免疫组化染色,应用Image Pro Plus 6.0版软件测定平均光密度值(以非染色区域为对照),分析Bcl-2、Bax蛋白的表达。

2 结果
2.1各组小鼠肾功能指标的变化 各组小鼠血清Urea、Crea含量的变化,见图1。DBP组Urea、Crea含量显著高于对照组(t=3.99,4.98,P<0.01);与DBP组相比,DBP+Cur组Urea含量显著降低(t=-4.19,P<0.01),Crea含量有一定程度地降低。
2.2各组小鼠肾组织氧化应激及Casp-3水平的变化 由图2可见,与正常对照组比较,DBP组小鼠肾组织ROS、MDA、Casp-3水平显著增加(t=12.60,P<0.01)(t=2.81,P<0.05)(t=8.84,P<0.01或P<0.05),T-AOC水平显著性降低(t=-2.66,P<0.05);与DBP组比较,DBP+Cur组小鼠肾组织ROS、Casp-3水平均有显著性降低(t=-5.08,-7.54,P<0.01),T-AOC水平显著上升(t= 2.75,P<0.05)。
2.3各组小鼠肾组织ERK1/2、p-ERK1/2蛋白的表达 与正常对照组比较,DBP组小鼠肾组织p-ERK蛋白表达水平显著上调(t=14.21,P<0.01);与DBP组比较,DBP+Cur组p-ERK蛋白表达水平有一定程度下调;各组小鼠肾组织ERK表达未见明显变化,见图3。
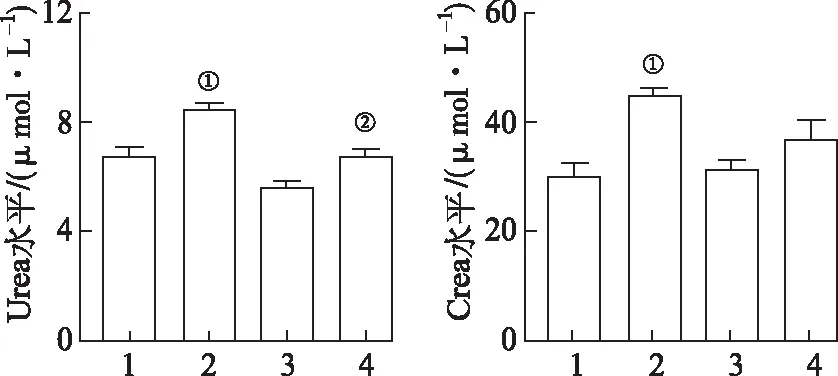
1.正常对照组;2.DBP组;3.Cur给药组;4.DBP+Cur组;①与正常对照组比较,P<0.01;②与DBP组比较,P<0.01。
2.4各组小鼠肾组织Bcl-2、Bax蛋白的表达 镜下观察,肾组织细胞核被染上了蓝色,细胞质则显示黄色(强阳性的地方呈现棕黄色),Bcl-2、Bax均在细胞质中表达,见图4A。DBP组小鼠肾组织中Bax的表达显著高于正常对照组(t=11.33,P<0.01);经Cur处理后,与DBP组比较,DBP+Cur组Bcl-2和Bax的比值显著上升(t=4.43,P<0.05),见图4B。
3 讨论
DBP是一种广泛使用的增塑剂,可通过消化道、皮肤及医疗器械接触等多种途径进入人体,有数据显示DBP及其代谢物在特殊人群尿液中的检出率已超过90%[3]。输血所用的PVC血袋释放的DBP可以在人体的多个器官中积聚,DBP的残留将可能严重影响输血者的生殖、发育、免疫等系统[8]。以往的研究指出,DBP是一种过氧化物酶体增殖激活受体(PPARs)诱导剂,DBP介导的PPARs激活被认为是DBP引起肝肾毒性的主要机制之一[9]。事实上,DBP造成人类出现肝肾毒性的途径可能不是由PPARs介导的;相反,PPARs的非依赖调节机制可能参与了这一过程[9]。本研究发现,DBP还可作为一种外源性氧化物,刺激机体产生氧化应激,活化ERK蛋白,甚至影响Bax、Bcl-2的比值以及Casp-3水平,从而导致肾功能出现障碍或异常。进一步发现,经Cur给药处理后,DBP暴露组小鼠肾组织的氧化应激水平及促凋亡相关蛋白的表达下降,血清中Crea、Urea水平趋于正常,以上结果提示,Cur对DBP所致的肾损伤有一定的保护作用。

1.正常对照组;2.DBP组;3.Cur给药组;4.DBP+Cur组;①与正常对照组比较,P<0.01;②与正常对照组比较,P<0.05;③与DBP组比较,P<0.01,④与DBP组比较,P<0.05。

1.正常对照组;2.DBP组;3.Cur给药组;4.DBP+Cur组;①与正常对照组比较,P<0.01。

1.正常对照组;2.DBP组;3.Cur给药组;4.DBP+Cur组;①与正常对照组比较,P<0.01;②与DBP组比较,P<0.05。
1.normal control group;2.DBP group;3.Cur group;4.DBP+Cur group;①compared with normal control group,P<0.01;②compared with DBP group,P<0.05.
Fig.4 Immunohistochemical staining (A) and mean optical density analysis (B) on renal tissue of four groups of mice(×200)
Crea、Urea是反映肾功能的两个重要指标,血清Crea的显著升高则提示肾小球滤过功能障碍,正常情况下,血清Crea水平能准确反映肾实质损害,血清Crea值偏高,大多意味着肾脏受损。肾实质损伤时肾小球重吸收减少,血清Urea水平也会相应升高[10]。尿素是哺乳动物蛋白质代谢的主要终产物,血清中尿素浓度主要受肾功能的影响。尿素排泄能力越强,肾功能状态越好;反之,如果尿素排泄能力不足,这可能表明肾功能受损。结果表明,DBP组小鼠血清Crea和Urea水平明显升高,提示DBP对小鼠肾细胞有严重的损伤作用,但给予Cur处理后,Crea和Urea水平明显下降。
本研究进一步证实了DBP可以显著提高肾组织ROS的水平,而ROS的积聚会改变细胞膜的稳态使MDA含量增加,同时降低抗氧化能力,最终导致更严重的组织损伤。此外,在氧化应激过程中产生的ROS作为上游信号分子参与了信号转导途径,并可诱导细胞凋亡或坏死,最终导致病理改变和器官功能障碍[11]。Cur具有抗氧化活性,经处理Cur后,DBP暴露后小鼠肾组织ROS、MDA水平下调,以及抗氧化能力得到提高。结果表明,氧化应激参与了DBP所致的肾功能障碍或异常,Cur可通过阻断ROS的过量产生而发挥保护作用。
文献[12]表明ERK及其磷酸化在肾相关疾病中可能发挥重要的作用。一些研究也指出,ERK的过度激活参与了糖尿病肾病的发生发展[13]。ERK是真核生物中丝裂原活化蛋白激酶(MAPK)家族成员之一,ERK信号途径也是细胞氧化应激反应中的关键通路。LEE等[14]发现氧化应激诱导的细胞凋亡可由ERK1/2磷酸化介导,ERK1/2通路被刺激信号激活,磷酸化激活的ERK1/2从细胞质转移到细胞核,介导下游转录因子NF-κB和AP-1的激活,进而调节细胞增殖、分化、凋亡和其他生物学功能。已有研究表明[15],DBP的同系物邻苯二甲酸二异癸酯(DIDP)作为细胞外信号可以激活p38MAPK引起相应的转录后生物学效应。因此,DBP引起的肾功能障碍可能与ERK通路的激活有关。结果表明,DBP组小鼠肾组织磷酸化ERK的总体水平高于对照组;相反,给予Cur处理后,DBP+Cur组ERK水平趋于降低,以保护肾组织的损伤。
目前Bcl-2是凋亡分子机制研究的主要靶分子,Caps-3是凋亡过程中的执行分子[16]。Bax、Bcl-2共属于Bcl-2基因家族,Bcl-2是细胞凋亡抑制基因,Bax不仅拮抗Bcl-2的抑制凋亡作用,而且具有促进细胞凋亡的功能。Bcl-2可与促凋亡Bax形成二聚体,如果Bax相对量高于Bcl-2,则Bax同二聚体的数量增多,从而促进细胞死亡;而如果Bcl-2相对量高于Bax,则促进形成Bcl-2/Bax异二聚体,并使Bcl-2同二聚体的量增多,从而抑制细胞凋亡。本研究发现,DBP组小鼠肾组织中Bax、Bcl-2水平均有升高,但Bax相对量更高,提示有促凋亡的趋势,这与沈华等[17]报道DBP孕期暴露导致子代大鼠睾丸细胞凋亡的观察结果一致。给予Cur处理后,DBP+Cur组Bcl-2水平的升高和Bax的降低表明细胞对凋亡的抵抗性增强,提示Cur具有抑制凋亡的作用。
综上所述,姜黄素对DBP所致小鼠肾损伤的保护作用,或与其可阻断DBP诱导的自由基形成有关,另一方面,Cur的保护作用还可能与抑制细胞凋亡途径的p-ERK、Bax以及Casp-3高表达相关。鉴于Cur药理作用的复杂性,对DBP引起的肾损伤的保护机制尚待进一步研究。

