黄芪甲苷干预高糖诱导人脐静脉内皮细胞损伤的实验研究
程 飞,陈景福,李诗成,刘 静,陈丽珍,郭灼林
糖尿病作为一种全身慢性多发性疾病,随着病情的加重,病人会出现多种慢性并发症,其中糖尿病血管病变、糖尿病性肾病和糖尿病视网膜病变是常见的严重并发症,对病人的预后和生活质量产生巨大的影响。糖尿病血管病变是心血管疾病发生的诱导因素,有相关研究指出血管内皮细胞在糖尿病血管病变过程中起着重要作用。有研究表明,高糖诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)出现损伤,伴随细胞凋亡与糖尿病足和糖尿病视网膜病变密切相关[1]。黄芪作为一种传统的中药材,具有利水消肿、固表补气的作用,同时黄芪中包含丰富的有效单体成分,如黄酮类、皂苷类和多糖类,其中黄芪甲苷在功效方面已有较多研究,研究显示,黄芪对肾病病人尿蛋白有很好的改善作用,从而发挥保护肾功能的作用[2]。另外,黄芪甲苷具有改善脑缺血、心肌缺血和抗氧化的作用,同时还对糖尿病肾病等多种疾病具有改善作用。黄芪甲苷具有抗炎、减少氧化物产生、对抗细胞凋亡的作用[3-4]。ClC-3氯离子通道作为影响细胞容积和细胞电位的通道,对细胞的增殖、分化和凋亡等有直接的作用[5]。因此,本实验探讨ClC-3氯离子通道在高糖诱导HUVECs损伤中的分子作用以及黄芪甲苷的对抗作用及其机制。
1 材料与方法
1.1 仪器和试剂 细胞培养箱为HERA Cell 150,胎牛血清和低糖DMEM均购自BI公司;二甲基亚砜、MTT试剂盒、乳酸脱氢酶(LDH)检测试剂盒、一氧化氮(NO)检测试剂盒、Caspase-3检测试剂盒、Annexin-Ⅴ凋亡检测试剂盒均购自碧云天生物技术有限公司;内皮型一氧化氮合酶(eNOS)酶联免疫吸附测定(ELISA)试剂盒购自南京建成生物工程研究所;HUVECs株来源于美国模式培养物保藏所;黄芪甲苷购自中国药品生物制定鉴定所,其纯度高于97%。
1.2 方法
1.2.1 分组及干预方法 首先构建高糖诱导HUVECs损伤模型,采用含有10%的胎牛血清DMEM培养基对细胞进行培养,分为空白对照组、高糖组、黄芪甲苷低剂量组、黄芪甲苷中剂量组和黄芪甲苷高剂量组,其中高糖组、黄芪甲苷低剂量组、黄芪甲苷中剂量组和黄芪甲苷高剂量组均采用33mmol/L的葡萄糖培养细胞[6],黄芪甲苷低剂量组、黄芪甲苷中剂量组和黄芪甲苷高剂量组分别给予黄芪甲苷10 μmol/L、50 μmol/L、100 μmol/L[7]。黄芪甲苷低剂量组、黄芪甲苷中剂量组和黄芪甲苷高剂量组先将HUEVCs预培养18 h后再在高糖环境下培养48 h。
1.2.2 MTT细胞活性检测 采用MTT法检测细胞活力,先将细胞铺板接种于96孔板中,然后按照药物和葡萄糖处理方式将细胞进行培养后弃掉培养液,每孔加入MTT溶液20 μL与细胞培养基180 μL混合后孵育4 h,将上清液弃掉后加入二甲基亚砜,摇床振荡10 min后采用酶联免疫检测仪检测其吸光度值,波长为490 nm。
1.2.3 细胞裂解和相应检测样本处理 将HUEVCs接种于六孔板中,让细胞密度保持在每孔1×105个,然后培养24 h后进行药物处理和造模,在处理完成后收集细胞上清液,测定细胞释放的LDH和NO。然后收集细胞内的相关因子,采用磷酸缓冲盐溶液(PBS)清洗3次后,采用细胞RIPA裂解液(上海碧云天生物技术有限公司)将细胞从孔板上提取下来后,在12 000 g下离心15 min后将细胞碎片去除,应用蛋白定量方法(BCA)对蛋白浓度进行测定。
1.2.4 LDH测定 采用LDH试剂盒检测,对细胞进行不同组处理后收集细胞上清液,根据试剂盒说明书进行操作后在酶标仪下进行440 nm波长下的吸光度测定,并计算LDH浓度。
1.2.5 NO和eNOS活力测定 NO采用试剂盒进行测定,对细胞分组处理后收集细胞上清液,按照说明书操作在酶标仪550 nm下进行吸光度测定。eNOS则应用ELISA试剂盒进行测定,收集细胞样本并按照说明书操作,在酶标仪下进行450 nm的吸光度测定。
1.2.6 细胞凋亡检测 结合Caspase-3蛋白表达量对细胞凋亡情况进行检测,采用细胞裂解法收集细胞裂解液,并且按照说明书进行检测,在405 nm下进行吸光度测定。
1.2.7 细胞内氯离子浓度检测 采用氯离子荧光探针(MQAE)检测细胞内氯离子浓度,采用HEPES缓冲液将MQAE浓度调节至10 mmol/L,将细胞培养液换成MQAE后细胞正常孵育1 h,然后将其放置于荧光显微镜下进行检测,并应用软件分析平均荧光强度。
1.2.8 细胞内ClC-3氯离子通道的mRNA和蛋白水平检测 不同组样本处理后对细胞进行蛋白裂解后提取,结合聚丙烯酰胺凝胶电泳法(SDS-page)电泳分离,采用抗体孵育后检测ClC-3氯离子通道的蛋白表达量,抗体购自上海碧云天生物技术有限公司,一抗浓度为1∶200[8]。mRNA检测采用TRIZOL法提取总RNA后经逆转录和聚合酶链式反应(PCR)扩增检测相对表达量。实时荧光定量PCR(qPCR)中ClC-3氯离子通道的上游引物为5′-ATGACAAATGGAGGCAGCAT-3′,下游引物为5′-TTTCCCAAGTAACCTCTGATGC-3′,内参ACTIN引物上游引物为5′-GCCAACCGTGAGAAGATGAC-3′,下游引物为5′-GTGGTGGTGAAGCTGTAGC-3′。

2 结 果
2.1 黄芪甲苷对高糖诱导的HUVECs活力的影响 高糖成功诱导HUVECs损伤模型,MTT和细胞凋亡检测显示高糖成功导致细胞损伤,细胞活力在高糖处理后其活性下降至70.31%,不同浓度黄芪甲苷能够增加细胞活力,降低细胞损伤。详见表1。

表1 各组HUVECs活力比较(±s)单位:%
2.2 黄芪甲苷对高糖诱导的HUVECs相关指标的影响 高糖环境处理HUVECs后,细胞分泌的NO明显减少,LDH明显增加,同时细胞内eNOS明显减少,Caspase-3明显增加,而黄芪甲苷处理细胞后,NO、eNOS较高糖组明显增加,LDH、Caspase-3较高糖组明显降低,这与HUVECs活力提高结果相一致。详见表2。

表2 各组HUVECs相关指标比较(±s)
2.3 黄芪甲苷处理高糖环境的HUVECs后细胞内氯离子浓度 对损伤细胞应用黄芪甲苷后细胞内氯离子浓度检测发现,细胞损伤后细胞内氯离子有明显降低,同时黄芪甲苷能够抑制细胞损伤导致的氯离子外流。详见图1。
2.4 ClC-3氯离子通道情况 对各组ClC-3氯离子通道蛋白和mRNA检测发现,在高糖环境下,ClC-3氯离子通道蛋白和mRNA水平明显降低,而不同浓度黄芪甲苷组mRNA和蛋白水平较高糖组有所增加。详见图2。
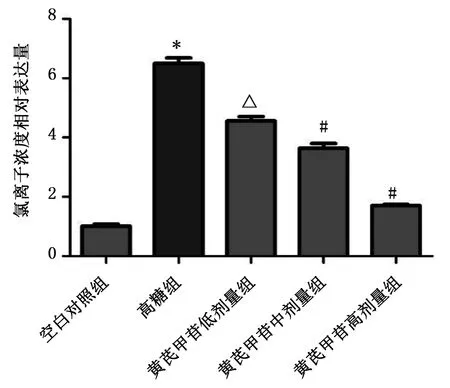
与空白对照组比较,*P<0.01;与高糖组比较,△ P<0.05,# P<0.01。图1 各组细胞内氯离子浓度相对表达量比较

与空白对照组比较,*P<0.01;与高糖组比较,△ P<0.05,# P<0.01。图2 各组ClC-3氯离子通道蛋白和mRNA水平比较
3 讨 论
高血糖是糖尿病血管性病变的重要并发症,高糖诱导内皮细胞损伤导致发病,且多项研究表明,高糖环境会导致内皮细胞凋亡数量明显增加。本研究结果显示,高糖处理后其细胞活力降低,凋亡细胞增多。目前,糖尿病血管性病变的临床治疗方式有采用具有抗细胞凋亡的药物,本研究结果显示,黄芪甲苷预处理能够有效抑制高糖导致的细胞损伤和细胞凋亡。同时在细胞损伤后产生的LDH均明显增加,而应用黄芪甲苷后相应指标的释放量都减少,表明对细胞损伤起着保护作用。对细胞凋亡因子Caspase-3进行检测发现,细胞在高糖诱导下凋亡细胞增多,而应用黄芪甲苷处理后,Caspase-3降低。
在高糖环境下,细胞多种活力因子和炎性因子发生明显改变,同时伴随多种机制和信号通路的改变[9]。已有研究显示,高糖环境下,伴随细胞稳态、酸碱平衡的紊乱,在细胞受到损伤过程中,细胞出现皱缩,电生理数据改变[10-11],钾、氯离子通道负载的离子出现外流现象。本研究结果显示,对高糖处理后细胞内氯离子浓度明显降低,表明氯离子流失,而应用黄芪甲苷后,氯离子流失减轻,表明黄芪甲苷可能通过氯离子通道减少氯离子流失[12],减少HUVECs凋亡。
综上所述,黄芪甲苷能够通过ClC-3氯离子通道降低高糖诱导的HUVECs损伤;高糖诱导的HUVECs损伤过程中有胞内氯离子的外流,而黄芪甲苷能够增加ClC-3氯离子通道的表达,并增加胞内氯离子浓度,黄芪甲苷通过ClC-3氯离子通道降低高糖诱导的HUVECs损伤,揭示黄芪甲苷降低高糖诱导HUVECs损伤的分子机制。

