双重抗血小板治疗急性缺血性脑卒中合并脑微出血的临床研究
张青松,檀国祥
急性缺血性脑卒中(acute ischemic stroke,AIS)是神经内科常见的一种脑血管疾病,老年人群发病率高于中青年[1],具有高致残率、高病死率的临床特点,也是临床最易出现脑微出血症状的血管性疾病。脑微出血作为脑小血管病的一种临床发病特征,目前认为是脑小微血管病变导致血管破裂,微量血液成分外渗所致,主要特征是以微小出血及巨噬细胞吞噬含铁血黄素后形成的微小病灶引起脑实质亚临床病变。AIS病人中脑微出血发生率为35%~71%。健康人群脑微出血发生率为5%,远低于AIS病人[2-3]。导致脑微出血发生的相关危险因素尚不明确,认为脑微出血是颅内血管系统在危险有害环境中长久暴露的结果,可作为脑小微血管损害的生物学标记物和可测量的累积损害负担,与缺血性脑卒中发展及预后有关,脑微出血数量越多提示发生脑卒中风险越高[4]。AIS病人出现脑微出血是发生出血性转化的危险信号之一,可增加病人脑卒中复发风险,加重神经功能缺失症状,导致病情加重提示病人预后不良[5]。通过不同途径抑制血小板聚集是目前国内外公认的治疗AIS主要手段,也是二级预防的基础,合并脑微出血的AIS病人经过抗血小板治疗后是否出现出血性转化这一情况存在争议,AIS病人经抗血小板治疗后可有效降低复发风险,病人颅内脑微出血数量较多时抗血小板治疗可能增加脑出血性转化。阿司匹林联合氯吡格雷双重抗血小板治疗不仅是临床针对缺血性脑血管疾病治疗的首选方案,而且具有重要的积极意义[6-7]。超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)在脑组织发生缺血、缺氧、急性损伤时可快速升高,可用于评价病人治疗过程中神经功能改善情况[8]。本研究通过双重抗血小板治疗AIS合并脑微出血,观察并比较病人治疗前后脑微出血、脑出血性转化和hs-CRP水平变化,为防治AIS提供客观依据。
1 资料与方法
1.1 一般资料 选取2016年1月—2018年12月亳州市人民医院神经内科收治的95例AIS合并脑微出血病人,所有病人均符合《中国急性缺血性脑卒中诊治指南2014》[9]制定的相关诊断标准,脑微出血通过磁敏感加权成像(susceptibility weighted imaging,SWI)进行确诊。将病人随机分为试验组(45例)和对照组(50例)。病人或家属对本研究内容充分了解并签署知情同意书备案,并经医院伦理委员会同意。
1.2 纳入与排除标准
1.2.1 纳入标准 首次发生AIS;年龄18~85岁;发病时间<72 h;病人能配合进行量表评定;近1个月内未服用影响血小板和白细胞活化药物[9-11]。
1.2.2 排除标准 存在严重心、肺、肝、肾疾病及重症糖尿病等危重病情;不能耐受SWI检查;存在严重视力、听力、躯体严重功能障碍;既往有心脏手术史、颅脑手术史;有脑外伤、脑肿瘤、脑血管疾病、中枢神经系统感染;病人病情需进行抗凝或溶栓治疗[9]。
1.3 治疗方法 对照组给予阿司匹林(拜阿司匹林,德国拜耳公司生产,规格:每片100 mg)每日100 mg,睡前1 h内口服。试验组口服阿司匹林同时给予硫酸氢氯吡格雷片(泰嘉,深圳信立泰药业有限公司生产,规格:每片25 mg)每日75 mg,早餐后1 h内口服。两组持续服用30 d,同时给予改善血管侧支循环及强化他汀调脂等基本治疗。
1.4 观察指标
1.4.1 临床资料 包括人口学资料(年龄、性别)、不良嗜好(吸烟史、饮酒史)、缺血性心脏病史、高血压史、糖尿病史及高脂血症病史等。
1.4.2 血清hs-CRP测定 治疗前后抽取清晨所有病人空腹静脉血,离心取血清后,采用酶联免疫吸附法测定hs-CRP,严格按照试剂盒使用说明进行操作。
1.4.3 不良反应 ①恶心呕吐、腹痛腹泻等胃肠道不良反应;②脑出血、消化道出血、皮肤黏膜出血等凝血异常症状;③过敏性皮疹、变态反应、痛风性关节炎、骨髓抑制等症状。
1.5 疗效判定
1.5.1 临床疗效评定 采用美国国立卫生研究院卒中量表(NIHSS)[10-11]评定,基本治愈:NIHSS评分下降>90%;显著进步:NIHSS评分下降46%~89%;进步:NIHSS评分下降18%~45%;无变化:NIHSS评分下降<18%;恶化:NIHSS评分增加>18%。
1.5.2 脑微出血判定标准 分别于病人入院后次日及抗血小板治疗15 d后,采用德国西门子3.0T磁共振扫描仪对病人进行SWI检查,分别记录每例病人脑微出血数量、微出血部位及出血性转化等临床资料。脑微出血在SWI序列上表现为无局部水肿占位效应的点状、圆形或卵圆形伴晕染的低信号灶,直径2~5 mm且边界清晰;排除钙化点、血管流空、骨伪影、外伤性弥漫性轴索损伤及其他原因导致的铁质沉积产生低信号图像。根据脑微出血数量及严重程度分为轻度(1~4个)、中度(5~9个)和重度(≥10个)。
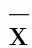
2 结 果
2.1 两组临床资料比较(见表1)
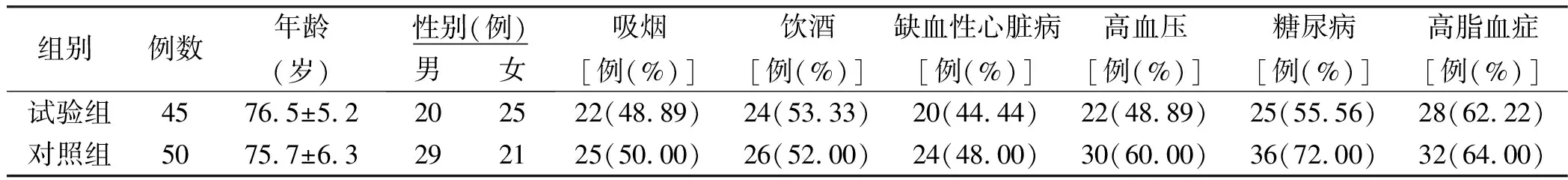
表1 两组临床资料比较
2.2 两组临床疗效比较 治疗后,试验组临床总有效率为73.33%,对照组为50.00%,两组比较差异有统计学意义(χ2=4.260,P=0.039)。详见表2。

表2 两组临床疗效比较 单位:例(%)
2.3 两组脑微出血情况比较 病人脑微出血主要分布于皮质及皮质下、基底节及丘脑、脑干和小脑。治疗前,试验组脑微出血轻度20例,中度15例,重度10例;对照组脑微出血轻度23例,中度18例,重度9例,两组比较差异无统计学意义(χ2=0.272,P=0.873)。治疗后,两组脑微出血严重程度无变化,且无出血性转化发生。
2.4 两组不良反应发生率比较 试验组不良反应发生率为28.89%,对照组为32.00%,两组比较差异无统计学意义(χ2=0.108,P=0.742)。详见表3。

表3 两组不良反应比较 单位:例(%)
2.5 两组治疗前后hs-CRP水平比较 治疗前,两组hs-CRP水平比较,差异无统计学意义(P>0.05);治疗后,两组hs-CRP水平均低于治疗前,且治疗后试验组低于对照组(P<0.05)。详见表4。
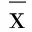
表4 两组治疗前后hs-CRP水平比较(±s) 单位:mg/L
3 讨 论
脑微出血是脑内微小血管在高压力等因素作用下出现病变,某种程度上证实了血管的易损性,血管内微量血液通过病变血管由血管内渗透到血管外脑组织中,并分解为不稳定铁蛋白聚合体沉积于脑组织,早期临床症状不明显,其本质核心是这些渗漏血液分解代谢物在脑部磁共振影像检查的一种特殊表现,磁共振影像表现为微小信号丢失,而SWI显示脑微出血敏感度优于常规梯度回波序列,通过SWI序列检查发现脑微出血灵敏度高达87%[12],是目前诊断脑微出血的最佳手段。本研究通过SWI序列检查结果显示,所有病人发现脑微出血轻度43例,中度33例,重度19例,主要分布于小血管供血部位脑组织,如皮层灰质及皮层下白质、基底节核团区及丘脑底核、脑干及小脑等相关区域,是脑小血管病变的标志,与刘长华等[13]研究结果一致。
AIS发病主要原因是由于病人血管内膜损伤、血小板聚集等形成动脉粥样硬化斑块或心源性栓子脱落导致颅内动脉血管形成栓塞。双重抗血小板是治疗AIS的有效方式,而阿司匹林和氯吡格雷是常用的抗血小板药物。阿司匹林抗血小板治疗的作用机制是抑制环氧化酶活性,减少血小板中血栓素的生成,最终抑制血小板聚集[14-15]。新型抗血小板药物氯吡格雷抑制血小板聚集的机制是选择性地使二磷酸腺苷和血小板受体结合,降低血小板自然寿命,通过减少血小板数量达到抑制血小板聚集的目的[16-17]。阿司匹林与氯吡格雷联合使用可增强抗血小板聚集效应并产生协同作用,二者联合可用于预防和治疗心脑血管疾病及血管内介入等[18-19]。
本研究对入选病人采用不同方式抗血小板聚集治疗,均达到一定的临床治疗效果,试验组总有效率为73.33%,高于对照组的50.00%,差异有统计学意义(P<0.05)。两组脑微出血数量及不良反应发生率比较,差异均无统计学意义(P>0.05);两组病人均未发生出血性转化不良症状。说明AIS合并脑微出血病人联合使用阿司匹林及氯吡格雷进行双重抗血小板治疗,不仅可提高临床总有效率,同时未增加脑微出血发生风险和出血性转化风险。
hs-CRP参与动脉粥样硬化斑块形成的进程,hs-CRP与脂蛋白结合产生反应并激活补体系统引起一系列炎症反应,产生终末蛋白和攻击复合物,hs-CRP、泡沫细胞及补体免疫复合物等沉积于血管壁,造成血管内膜损伤,重者引起血管痉挛导致内膜不稳定斑块脱落。hs-CRP水平不仅是反映抗血小板疗效的一项指标,同时可作为判断缺血性脑卒中发展进程的一项指标[20]。本研究结果表明,治疗前,两组hs-CRP水平比较,差异无统计学意义(P>0.05);治疗后,两组hs-CRP水平均明显低于治疗前,且试验组低于对照组(P<0.05),与韩利军[21]研究结果一致,证实阿司匹林联合氯吡格雷双重抗血小板治疗不仅降低病人血清炎症反应,并且减少或避免缺血性事件发生,对治疗AIS具有重要的临床意义。
本研究由于病例来源局限、治疗方法单一,且病例数量有限、治疗时间短,数据可能存在偏倚,为明确治疗效果及安全性,有待今后进一步进行大样本、长期复查随访研究加以证实。

