外源GDF11对人主动脉内皮细胞钙化的影响
盛 瑛,张宸铭,陈 亮,徐佰达,靳天慧,刘叶红,叶 挺,宗刚军,
血管钙化是糖尿病、动脉粥样硬化等疾病在血管方面的特征性病理改变。一旦血管钙化发生,将导致血压波动、斑块破裂、血栓形成等严重后果[1-2]。研究[3]表明,血管钙化与平滑肌细胞或内皮细胞的成骨转分化、炎症、凋亡或外泌体的释放均紧密相关。钙化发生时主要表现为成骨转录因子Runx2、Osterix及其下游成骨相关蛋白,如骨形态发生蛋白(bone morphogenetic protein,BMP)2、BMP4、碱性磷酸酶(alkaline phosphatase,ALP)等的表达增加[4]。目前,有关转录生长因子-β(transform growth factor-β,TGF-β)家族的BMP2、BMP4、BMP6促进血管钙化的研究较多,但尚未见同家族的生长分化因子11(growth differentiation factor 11,GDF11)在钙化方面的报道。有研究[5-6]表明,补充外源性GDF11可逆转高龄小鼠因老化导致的心脏、骨骼肌、脑血管疾病。还有研究发现,GDF11可以促进破骨、抑制成骨分化过程[7]。该研究拟用β-甘油磷酸、地塞米松、L-抗坏血酸诱导人主动脉内皮细胞(human aortic endothelial cell,HAEC)钙化,探究外源GDF11对钙化及其过程中成骨分化的影响。
1 材料与方法
1.1 主要材料HAEC购自上海子实生物科技公司,以该细胞为研究对象,通过伦理委员会批准。内皮细胞基础培养基(endothelial cell medium,ECM)、内皮细胞生长因子(endothelial cell growth supplement,ECGs)、胎牛血清均购自美国Sciencell公司;胰蛋白酶、细胞裂解液购自北京碧云天公司;人源外源重组GDF11因子购自美国Peprotech公司;一抗BMP2、BMP4、GDF11均购自美国Abcam公司;内参蛋白β-actin购自美国ABSCI公司;二抗兔、FITC标记荧光二抗兔均购自杭州联科生物技术公司;HRP标记二抗鼠购自美国CST公司;引物Runx2、Osterix、GAPDH、GDF11购自上海吉玛生物科技公司;基因检测荧光染料SYBR、逆转录酶购自南京Vazyme公司。
1.2 细胞培养使用内皮细胞完全培养基(ECM+ECGs+5%胎牛血清),于5% CO2的37 ℃恒温孵箱中培养,每2 d更换培养液,细胞长至培养表面70%~80%时,进行消化传代,取3~5代细胞进行实验,以1×105/ml的细胞数密度种植于六孔板。
1.3 方法
1.3.1建立HAEC钙化模型 以β-甘油磷酸为研究变量,进行分组实验,分为空白对照组、低浓度组、高浓度组。空白对照组常规培养10 d;低浓度组予10 mmol/L β-甘油磷酸+100 nmol/L地塞米松+50 μg/ml L-抗坏血酸培养10 d;高浓度组予30 mmol/L β-甘油磷酸+100 nmol/L地塞米松+50 μg/ml L-抗坏血酸培养10 d。
1.3.2实验分组 以GDF11为变量,探讨外源重组GDF11干预HAEC钙化的有效浓度及时间:① GDF11预处理48 h,按浓度梯度分为5组:空白组、钙化组、30 ng/ml组(30 ng/ml GDF11)、50 ng/ml组(50 ng/ml GDF11)、100 ng/ml组(100 ng/ml GDF11);② 以100 ng/ml GDF11干预,按时间梯度分5组: 空白组、钙化组、8 h组、24 h组、48 h组;③ 筛选出GDF11有效干预浓度与时间后,HAEC分4组进行后续实验:空白组(常规培养12 d)、GDF11组(予100 ng/ml GDF11预处理48 h、再常规培养10 d)、钙化组(常规培养2 d后,予钙化诱导10 d)、GDF11+钙化组(予100 ng/ml GDF11预处理48 h,再钙化诱导10 d)。
1.3.3Western blot 检测BMP2(1 ∶1 000)、BMP4(1 ∶1 000)、GDF11(1 ∶2 000)、内参蛋白β-actin(1 ∶3 000)。收集样本,提取总蛋白,于 80 V恒压电泳40 min左右,待marker分开后,调至120 V恒压电泳至上样缓冲液脱落, 350 mA恒流转膜80 min,5%BSA封闭1 h,孵育一抗(4 ℃过夜),TBST洗膜5 min 5次,二抗(1 ∶5 000)室温孵育1 h,洗膜5 min 5次,滴加ECL曝光液进行显影,采用ImageJ软件分析条带灰度值,以目的蛋白与β-actin的比值表示目的蛋白相对表达水平。
1.3.4RT-PCR 检测Runx2、Osterix、GDF11、GAPDH基因表达水平。钙化诱导10 d后,收集细胞提取RNA,测RNA浓度,按Vazyme逆转录和定量试剂盒说明书进行逆转录和定量检测。引物序列见表1。
1.3.5茜素红S染色 4%多聚甲醛中室温固定细胞30 min,用PBS洗5 min 3次,pH 4.2的2%茜素红S浸染爬片10 min,立即用PBS快速冲洗,直至洗液不变红,用封片剂封片,于镜下观察。
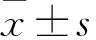

表1 RT-PCR引物序列
2 结果
2.1 HAEC钙化模型的建立及钙化后内源GDF11表达的影响Western blot结果显示(图1),高浓度组的BMP2、BMP4、GDF11蛋白相对表达水平均高于空白对照组(P<0.05);RT-PCR结果显示(图2),高浓度组Runx2、Osterix、GDF11的相对基因表达水平均高于空白对照组(P<0.05);茜素红S染色结果显示(图3),高浓度组的钙化沉着高于空白对照组及低浓度组;细胞免疫荧光结果显示(图4),高浓度组的GDF11荧光强度高于空白对照组及低浓度组。后续实验中钙化组即高浓度组的诱导方案。
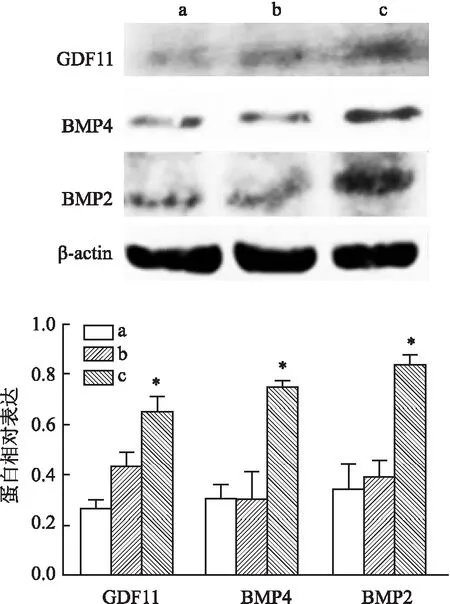
图1 Western blot 检测各组HAEC内GDF11、BMP4、BMP2蛋白表达水平
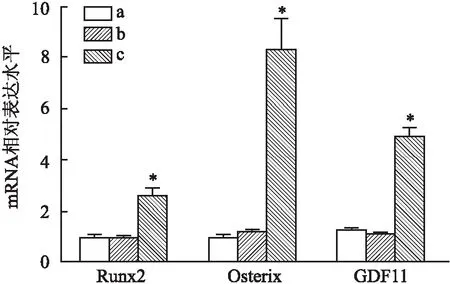
图2 RT-PCR检测各组HAEC内Runx2、Osterix、GDF11基因表达水平
2.2 外源GDF11对HAEC钙化有效作用浓度和时间Western blot结果显示(图5),100 ng/ml组BMP2 、BMP4蛋白低于钙化组(P<0.05),24 h组BMP2 、BMP4蛋白低于钙化组(P<0.05),24 h组与48 h组比较差异无统计学意义,后续GDF11+钙化组均以100 ng/ml GDF11预处理48 h作为GDF11有效干预浓度和时间。
2.3 外源GDF11对钙化相关蛋白及钙化沉积的影响Western blot结果显示(图6),GDF11+钙化组BMP2、BMP4相对蛋白表达水平均低于钙化组(P<0.05),但GDF11组BMP2、BMP4蛋白表达水平与空白组比较差异无统计学意义;茜素红S染色显示(图7),GDF11+钙化组钙化沉积较钙化组减少。
2.4 外源GDF11对钙化的HAEC核内成骨转录因子Runx2、Osterix的影响RT-PCR结果显示(图8),与钙化组比较,GDF11+钙化组Runx2、Osterix基因表达水平均下降(P<0.05),GDF11组Runx2、Osterix基因表达水平与空白组比较差异无统计学意义。
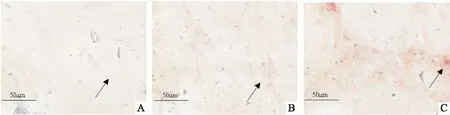
图3 各组HAEC钙化沉着的茜素红染色结果 ×400A:空白对照组;B:低浓度组;C:高浓度组; 箭头指示粉红色附着处为钙化沉积
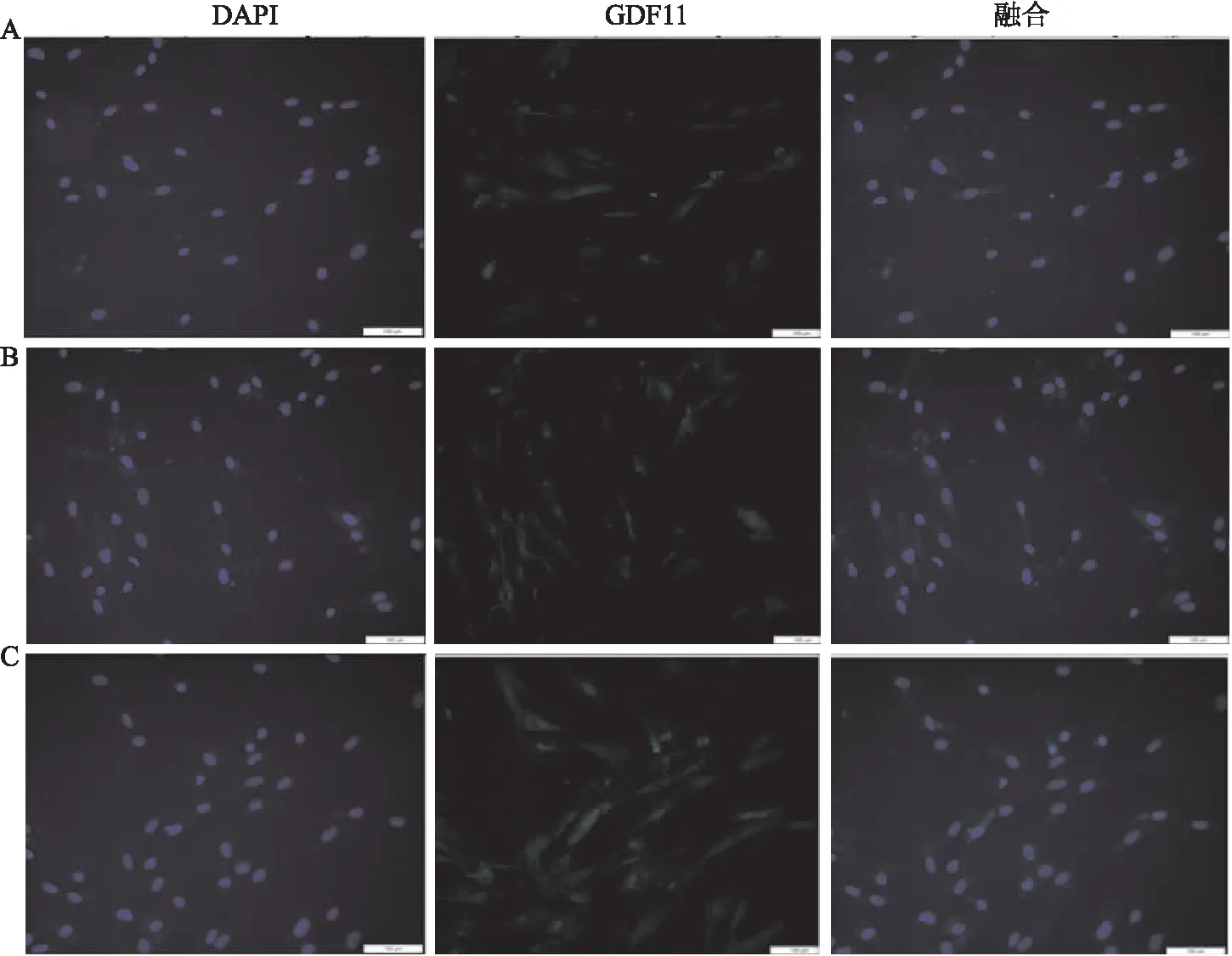
图4 各组HAEC细胞免疫荧光染色结果 ×200
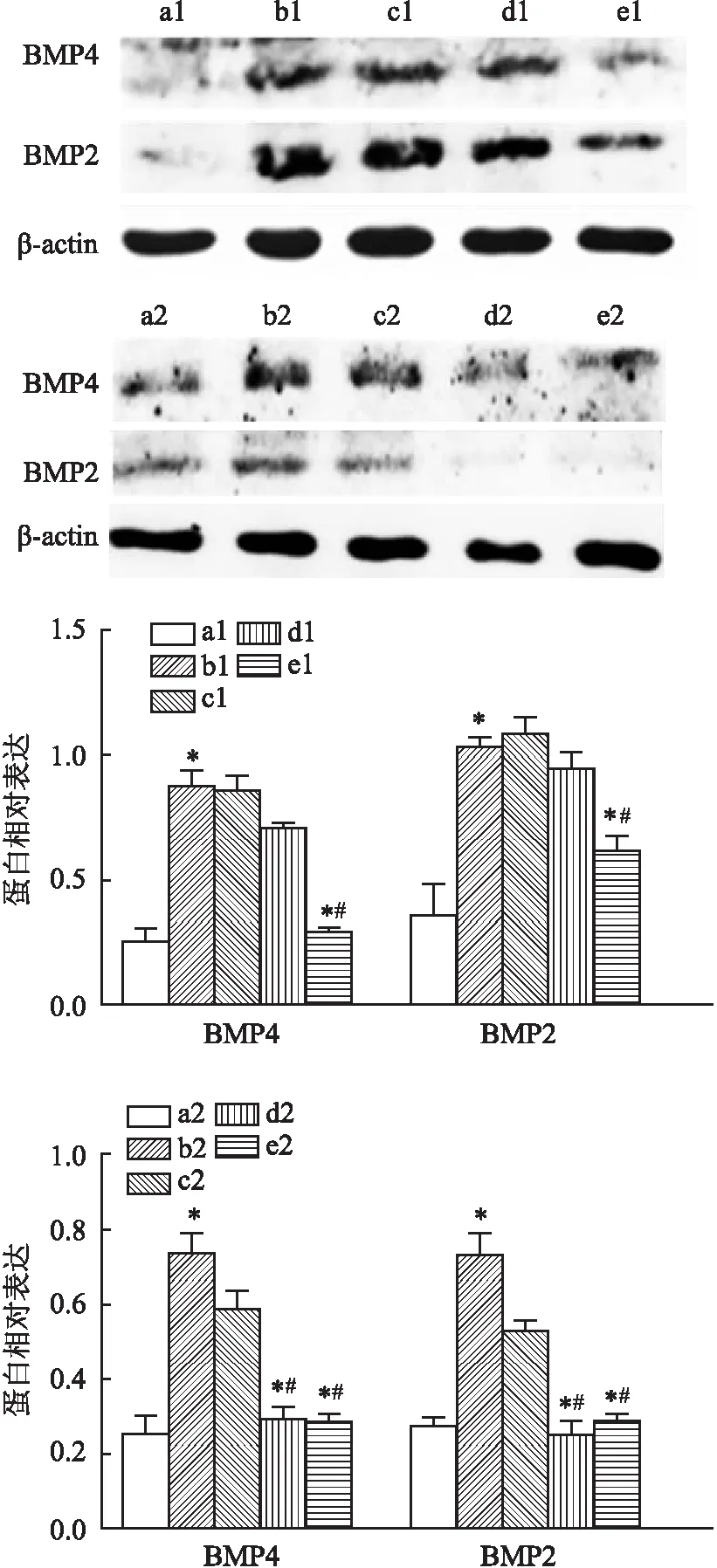
图5 Western blot检测各组HAEC经不同浓度、时间外源GDF11预处理后BMP2、BMP4蛋白表达水平
3 讨论
血管钙化是由内皮细胞、间质细胞、免疫细胞等相互作用,机械损伤、炎症、新陈代谢、信号转导等所支配的骨质矿化的复杂过程[8]。血管内皮细胞作为血管的最内层结构,最易受血流冲击引起机械损伤及炎症反应。其次内皮细胞与血液直接接触,是多种分子的靶细胞,最易受到各种分子的作用。有研究[9-10]指出主动脉瓣膜内皮细胞可分泌一氧化氮和C型尿钠肽,从而调控瓣膜间质细胞生长分化,抑制间质细胞钙化。血管平滑肌细胞是血管间质成分的一种,亦受内皮细胞分泌物质的调控。因此,研究动脉内膜的钙化具有更显著的现实意义。有研究表明高磷或高糖环境促进HAEC成骨分化是血管钙化机制之一[11-12],所以抑制内皮细胞向成骨分化的过程是抑制内膜钙化的重要机制之一,选取HAEC为研究对象,并对其钙化进程中所发生的成骨分化展开研究,具有重要的临床意义。
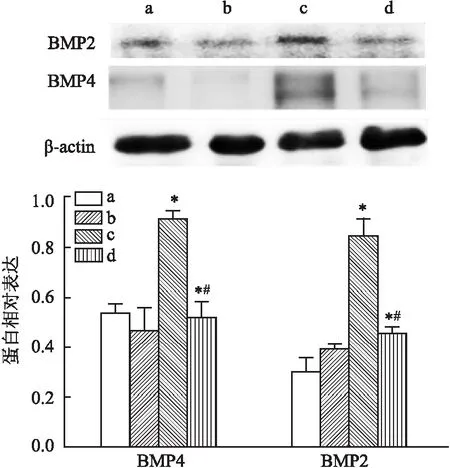
图6 Western blot检测各组HAEC内BMP2、BMP4蛋白表达水平
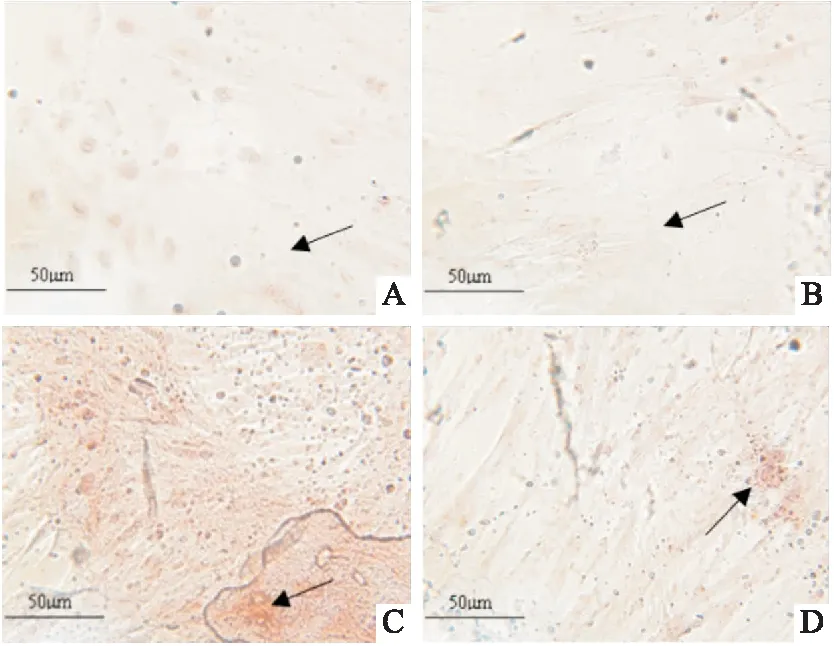
图7 茜素红S染色检测各组HAEC钙化沉积 ×400
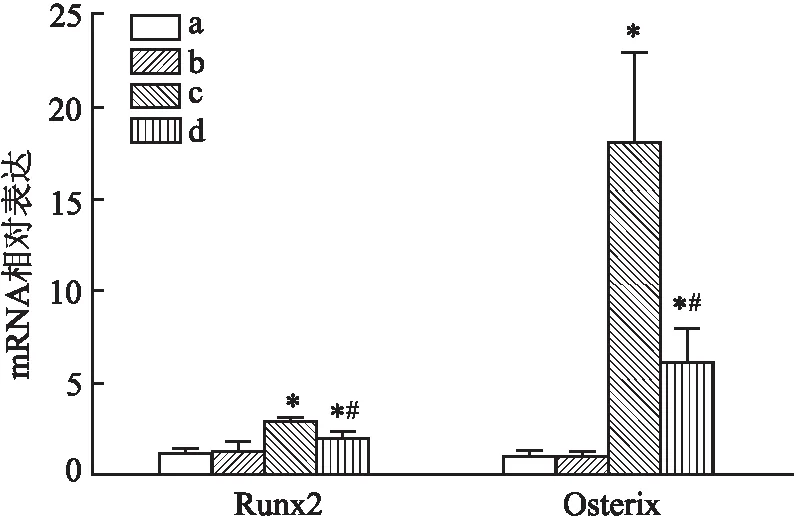
图8 RT-PCR检测各组HAEC内Runx2、Osterix相对基因表达(n=3)
本研究中钙化模型不同于以往已报道的是,既往常用10 mmol/L β-甘油磷酸诱导血管平滑肌细胞钙化[13],而HAEC需用更高浓度β-甘油磷酸(30 mmol/L)才能发生显著钙化。诱导HAEC钙化后,BMP2、BMP4蛋白表达上调,其上游的成骨转录因子Runx2、Osterix表达也上调,说明该钙化诱导方案可能经Runx2/Osterix途径[14]。在该钙化模型中,GDF11的蛋白和基因表达同时上调。而目前研究[15-16]内源GDF11表达者多聚焦于临床范畴,且尚无统一结论,可能与不同细胞系、不同疾病、年龄、GDF11的检测方法等混杂因素有关[17-18]。但钙化诱导后所表现的GDF11升高是负反馈性上调抑制钙化还是仅作为一种促钙化标记物正反馈性上调不得而知。本研究便在钙化诱导之前补充外源GDF11因子,发现BMP2、BMP4均下调;另外,外源GDF11也下调钙化过程中的Runx2、Osterix基因表达水平。茜素红染色提示GDF11从大体层面抑制了钙化的发生,以上结果表明GDF11可能通过Runx2/Osterix途径来抑制钙化。钙化组的GDF11表达虽上调,但钙化相关蛋白并未下调,说明高甘油磷酸诱导钙化所致内源GDF11的上调并不能抑制钙化的发生,在补充一定浓度的外源GDF11后可见钙化相关蛋白下调,钙化沉积也减少。可能因为内源GDF11的浓度不足以抑制钙化或外源GDF11通过反馈性抑制内源GDF11的表达来抑制钙化。
研究表明高浓度β-甘油磷酸、地塞米松、L-抗坏血酸可诱导HAEC钙化,可能通过成骨转录因子Runx2/Osterix正性调节下游钙化蛋白的表达,为后续研究奠定了基础。并发现外源GDF11可能通过Runx2/Osterix途径抑制HAEC钙化,本研究证实GDF11在体外可抑制HAEC钙化的进展,为血管内膜钙化的治疗提供了干预的靶点,但具体机制尚待进一步研究。

