威海地区新生儿耳聋基因检测的结果分析①
孙诗雨,张春晓,蓝信强
(青岛大学附属威海市立第二医院(威海市妇幼保健院)医学遗传科,山东 威海 264200)
遗传性耳聋是一种典型且高发的遗传性疾病,我国新生儿发病率约为0.1%~0.3%[1]。据WHO2012年估计,全球约有3.2亿听力残疾患者,占世界总人口的5%。我国是世界上听力障碍人数最多的国家,据2006年我国第二次残疾人抽样调查结果显示,听力残疾人口高达2780万,约占总残疾人群的27%,是仅次于肢体残疾的第二大残疾群体。然而,听力损失并不一定出生时就会出现,因此,新生儿听力筛查会对迟发性耳聋和药物性耳聋发生漏检现象。随着基因筛查技术的不断发展,新生儿听力筛查与基因筛查的逐步推广[2],从分子水平上,对新生儿进行精准耳聋基因分子诊断,已成为新生儿听力诊治的重要手段。本研究中,通过对威海地区2017-06~2020-02出生的1720名新生儿进行听力与耳聋基因联合筛查,进一步研究威海地区耳聋易感基因的携带情况,为降低耳聋患者的出生率具有重要意义。
1 对象与方法
1.1 对象
2017-06~2020-02威海市妇幼保健院出生的1720例新生儿,男婴912例,女婴808例,均为汉族,受检新生儿均由监护人签署知情同意书。
1.2 方法
采集新生儿足跟血于采血卡,2~8℃晾干后及时送检。利用飞行时间质谱仪检测4个易感基因的20个位点,包括GJB2基因c. 235delC、c. 299-300delAT、c. 167delT、 c. 35delG和c. 176del16位点,GJB3基因c. 538C>T和c. 547G>A位点,SLC26A4基因c. 281C>T、c. 589G>A、c. 1174A>T、c. 1226G>A、c. 1229C>T、IVS15+5G>A、c. 1975G>C、c. 2027T>A位点2例、c. 2162C>T、 c. 2168A>G和c. IVS7-2A>G位点,以及线粒体12S rRNA基因m. 1555A>G和m. 1494C>T位点。
2 结果
2.1 耳聋基因筛查结果
1720名新生儿耳聋基因筛查中,野生型1640例,检出率95.34%。GJB2基因杂合突变32例,其中c. 235delC位点21例(1.22%),c. 299-300delAT位点11例(0.64%)。SLC26A4基因杂合突变37例,其中主要突变为c. IVS7-2A>G位点20例(1.16%)和c. 2168A>G位点6例(0.35%),c. 589G>A位点2例、IVS15+5G>A位点1例、c. 1226G>A位点1例、c. 1229C>T位点2例、c. 2027T>A位点3例、c. 1975G>C位点3例和c. 1174A>T位点1例。GJB3基因杂合突变7例,其中c. 538C>T位点6例(0.35%),c. 547G>A位点1例(0.06%)。此外,线粒体12S rRNA m. 1555A>G基因携带者2例(0.12%),见表1。
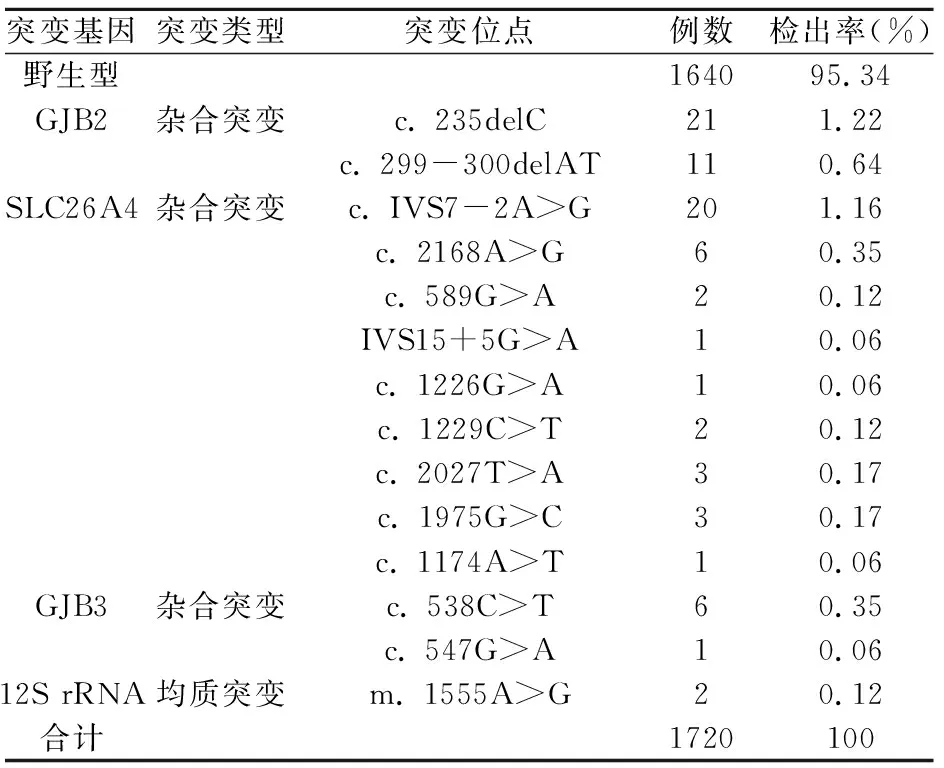
表1 1720例新生儿耳聋基因检测
2.2 听力与耳聋基因联合筛查结果
1720例新生儿出生2~3d进行听力筛查,听力筛查与基因筛查均通过1531例,听力筛查未通过但基因筛查通过189例,听力筛查通过但基因筛查杂合突变68例,听力筛查未通过且基因筛查杂合突变12例。新生儿听力筛查未通过,将进行后续复筛和确诊检测。
3 讨论
我国是世界上听力障碍人数最多的国家,这种疾病的主要致病因素是遗传性因素[1]。随着基因诊断技术在临床中的广泛应用,已经发现100种基因,超过200个突变位点会导致耳聋疾病的发生(http://heretidaryhearingloss.org/)。然而一些基因突变不会在新生儿出生伴随着听力缺失,例如Pendred综合征、线粒体12S rRNA m. 1555A>G和m. 1494C>T、前庭导水管扩大等[2]。本研究中,通过对新生儿进行听力筛查与耳聋基因筛查联合检测,进一步提高了新生儿耳聋疾病的检出率。耳聋基因筛查对听力筛查未通过的新生儿耳聋疾病的早发现、早干预具有重要意义。
在全国范围内,非综合征型耳聋患者中GJB2基因突变是主要的基因致病因素,尤其是GJB2 c. 235delC突变位点是中国耳聋患者中主要的突变位点,其突变率13.64%~21.50%[3]。GJB2基因位于常染色体13q12.11区域,含有两个外显子,然而只有第二外显子为GJB2基因的蛋白编码区,编码允许离子和小分子代谢物通过的缝隙连接蛋白(Connexin26蛋白)[4]。本研究中,我们发现GJB2基因是新生儿携带的主要易感基因,1720名新生儿中32例GJB2基因杂合突变,携带率1.86%(32/1720),其中c. 235delC位点21例(1.22%),c. 299-300delAT位点11例(0.64%)。此外,在1720名新生儿耳聋基因检测中,我们未检测出c. 167delT、 c. 35delG和c. 176del16位点,这说明新生儿携带耳聋的常见基因的位点在不同地区遗传性存在差异。
SLC26A4基因位于常染色体7q31,基因全长4.93kb,包含21个外显子,该基因编码一种阴离子跨膜蛋白Pendred蛋白,该蛋白在内淋巴稳态的调节具有重要作用[5]。SLC26A4基因突变会破坏耳蜗的离子稳态,从而引起大前庭水管耳聋综合征疾病[3,4]。本研究中,1720名新生儿中SLC26A4基因杂合突变39例。其中c. IVS7-2A>G位点20例(1.16%),c. 2168A>G位点6例(0.35%),c. 2027T>A和c. 1975G>C位点各3例,c. 589G>A和c. 1229C>T位点各2例,IVS15+5G>A、c. 1226G>A和c. 1174A>T位点各1例。在Tsukamoto等[6]团队研究发现,亚洲一些地区SLC26A4基因的热点突变位点为c. 2168A>G。然而,在威海地区SLC26A4基因的主要突变位点为c. IVS7-2A>G,其突变频率远高于c. 2168A>G位点。此外,SLC26A4基因的其他位点c. 589G>A、c. 1174A>T、c. 1226G>A、c. 1229C>T、IVS15+5G>A、c. 1975G>C和c. 2027T>A虽然突变频率较低,但在威海地区均有分布。然而,在威海地区1720名新生儿的基因检测中未发现c. 281C>T和c. 2162C>T位点。SLC26A4基因是一种感应神经性语前聋或语后聋的隐性遗传基因[7],可引起渐行性听力下降,因此对于SLC26A4基因纯合突变的新生儿要注意及时观察,以防新生儿伴随年龄的增长而逐渐听力损失。
GJB3基因位于常染色体1p33-p35,包含两个外显子和一个由813碱基对组成的开放阅读框,GJB3基因表达主要位于表皮上分化层中的颗粒层,其次表达在末梢神经和耳蜗中[8]。本研究中,7例新生儿存在GJB3基因突变,其中c. 538C>T位点6例,c. 547G>A位点1例。GJB3基因是我国克隆的第一个致聋基因突变,有研究表明GJB3基因热点突变c. 538C>T是显性遗传,也有研究表明,GJB3基因突变主要表型是语后进行性高频听力感应神经性耳聋。因此,对于GJB3基因突变但听力筛查通过的新生儿需要注意临床指导和观察,从而降低耳聋的发生。
首次发现第一个线粒体12S rRNA m. 1555A>G突变与非综合征型耳聋相关,并确定了线粒体12S rRNA基因的遗传方式为X-连锁的母系遗传是从三个中国家系和一个阿拉伯-以色列家庭中发现的,其基因突变与氨基糖苷类药物引起的药物性致聋有关[9]。流行病学调查显示,约4.4%的耳聋患者携带线粒体基因突变,其主要突变为m.1555A>G。本研究中,2例新生儿耳聋基因12S rRNA突变位点为m.1555A>G。此外,研究人员在2例中国非综合征型耳聋患者中发现12S rRNA基因m. 1494C>T突变,同样是具有母系遗传性,并且与氨基糖苷类药物诱导相关[10],然而在本研究中,未发现m. 1494C>T突变,进一步说明了不同地区耳聋基因分布存在差异。对于12S rRNA m.1555A>G突变的2名新生儿来说,应该注意其安全用药,以防由于药物的使用导致耳聋疾病的发生。
综上所述,威海地区1720名新生儿耳聋基因筛查得到主要携带基因为GJB2 c. 235delC(21例)和SLC26A4 c. IVS7-2A>G(20例)。此外,后天高频感音神经性耳聋GJB3基因携带者7例,其中c. 538C>T位点突变6例,还有2例药物敏感性耳聋12S rRNA m.1555A>G突变。耳聋基因筛查与新生儿听力筛查联合使用具有重要的意义,尤其是耳聋基因筛查可以检测出药物敏感性耳聋基因携带者和迟发性耳聋基因携带者,对这两种基因携带者具有警示作用。对于药物敏感性耳聋基因携带的新生儿需要提供安全用药指导,对于迟发性耳聋基因携带者要注意耳部保健和提早干预。耳聋基因筛查是从分子角度对新生儿进行听力检测,为耳聋基因携带者提供指导,有助于减少后代耳聋疾病的发生,对家庭和社会具有重要意义。

