OGD/R星形胶质细胞DNMT3a、tPA表达与凋亡变化及腺苷甲硫氨酸的干预作用
张晓璐
江苏省苏北人民医院,江苏扬州225001
围产期缺氧是导致新生儿脑损伤最普遍的原因。新生儿缺血缺氧性脑病(NHIE)主要造成急性死亡和慢性神经系统功能障碍[1]。目前,对于NHIE的治疗,除低体温疗法用于治疗轻度新生儿窒息所致脑病以外,尚无普遍公认的治疗手段。最近研究表明,在早期脑缺氧缺血过程中,表观遗传学改变起到关键作用[2]。当神经细胞暴露在短暂的缺氧条件下,多种影响中枢神经系统发育和功能的基因启动子区域发生去甲基化,从而上调相关基因的表达。组织型纤溶酶原激活物(tPA)是一种丝氨酸蛋白酶,在脑内主要由胶质细胞表达,在细胞凋亡、神经可塑性等方面都起着重要作用[3]。2017年1月~2020年6月,本研究体外培养大鼠皮质星形胶质细胞,通过糖氧剥夺/复氧复糖(OGD/R)细胞模型模拟新生儿NHIE,同时使用DNA甲基转移酶(DNMT)激活剂S-腺苷甲硫氨酸(SAM)进行干预,观察DNMT3a、tPA和凋亡相关因子水平变化。现报告如下。
1 材料与方法
1.1 实验动物与主要材料 健康清洁级新生24 h内SD大鼠乳鼠,雌雄不限,体质量4~6 g,购于扬州大学比较医学中心。动物生长环境:温度18~24 ℃,湿度50%~60%,12 h昼夜交替,自由摄食、饮水。高糖DMEM培养基、无糖DMEM培养基购自美国Gibco公司。SAM、多聚赖氨酸购自美国Sigma公司。MTT购自Solarbio公司。RIPA细胞裂解液购自Applygen公司。TRIzol试剂、荧光标记二抗Alexa Fluor 594山羊抗鼠IgG购自美国Invitrogen公司。核蛋白提取试剂盒购自KeyGen Biotech公司。DNA Methyltransferase活性检测试剂盒购自美国Epigentek公司。RevertAid First Strand cDNA试剂盒、DAPI购自美国Thermofisher Scientific公司。AceQ qPCR SYBR Green Master Mix PCR试剂盒购自Vazyme公司。兔多克隆抗DNMT3a抗体、兔多克隆抗tPA抗体、小鼠单克隆抗GFAP抗体购自英国Abcam公司。鼠单克隆抗Bcl-2抗体、兔多克隆抗Bax抗体购自美国Santa Cruz公司。兔多克隆抗Cleaved Caspase-3抗体、兔抗多克隆GAPDH抗体、HRP羊抗兔二抗购自美国Cell signaling公司。HRP羊抗鼠二抗购自美国BD Biosciences公司。抗荧光淬灭封片剂购自Beyotime公司。本研究通过扬州大学动物伦理委员会批准。
1.2 大鼠皮质星形胶质细胞分离、培养与鉴定 取新生1~2 d的SD大鼠乳鼠,70%乙醇消毒头颈部,用锋利剪刀剪下头部,无菌条件下取出乳鼠大脑皮质,用无菌过滤纸移除脑膜和血管,组织剪碎后用0.25%胰酶37 ℃消化10 min,加入配制的培养基(高糖DMEM+10%胎牛血清+100 U/mL青-链霉素),反复洗涤3次,用100 μm滤网过滤后离心(200 r/min,10 min),加入上述配制的培养基重悬,将细胞接种在多聚赖氨酸包被的75 cm2培养瓶中。放置于37 ℃、5% CO2培养箱中培养10 d后,应用星形胶质细胞特异性蛋白GFAP免疫荧光细胞染色和DAPI细胞核染色进行细胞纯度鉴定。选择纯度>95%的星形胶质细胞用于后续实验。
1.3 OGD/R细胞模型建立与分组处理 取培养10 d的星形胶质细胞进行传代,当细胞生长达到80%密度时,洗涤2次,将正常培养基替换成无糖培养基(去血清无糖DMEM+青-链霉素),细胞培养皿置于缺氧小室内,持续通入含有95%N2和5%CO2的混合气体;通气10 min夹闭缺氧小室进出口,继续培养3、6、12 h后取出缺氧小室,换回正常培养基,放回培养箱中继续培养24 h;采用MTT法检测细胞存活力,以细胞存活率90%为标准,确定缺糖缺氧3 h后再复氧复糖24 h作为细胞模型制作条件[4]。将细胞分为对照组、OGD/R组、OGD/R+SAM组。对照组常规培养。OGD/R组、OGD/R+SAM组参照前述方法,以缺糖缺氧3 h后再复氧复糖24 h建立OGD/R细胞模型[4]。OGD/R+SAM组在OGD/R过程中细胞培养基始终保持有50 μmol/L的SAM。造模完成后进行后续检测。
1.4 DNMT活性测定 使用核蛋白提取试剂盒提取各组细胞核蛋白并做蛋白定量。取10 μg核蛋白,使用Epigentek DNMT活性检测试剂盒,根据说明书检测DNMT活性。
1.5 DNMT3a、tPA mRNA及蛋白检测 ①DNMT3a、tPA mRNA检测:使用TRIzol试剂提取总RNA,检测RNA浓度;使用ReverAid First Strand cDNA合成试剂盒将RNA逆转录为cDNA;使用AceQ qPCR SYBR试剂盒,取20 μL的cDNA进行PCR扩增;DNMT3a mRNA上游引物序列为5′-AGGAAGCCCATCCGGGTGCTA-3′、下游引物序列为5′-AGCGGTCCACTTGGATGCCC-3′,tPA mRNA上游引物序列为5′-AGCAAGGCACGGGACACGGA-3′、下游引物序列为5′-GGTCAGGCAACGTGAACGCC-3′,内参GAPDH上游引物序列为5′-CATGGCCTTCCGTGTTCCTA-3′、下游引物序列为5′-ACTTGGCAGGTTTCTCCAGG-3′;以2-ΔΔCt表示目的基因的相对表达量。②DNMT3a、tPA蛋白检测:使用RIPA裂解缓冲液提取各组细胞总蛋白并进行蛋白定量;蛋白提取物加载到聚丙烯酰胺凝胶电泳上进行蛋白分离并转至PVDF膜;转膜后用5%脱脂奶粉封闭,洗膜3次,分别加入DNMT3a(1∶1 000)、tPA(1∶500)和GAPDH(1∶1 000)抗体,4 ℃孵育过夜;洗膜后加入辣根过氧化物酶标记的羊抗兔或羊抗鼠二抗室温孵育2 h;使用ECL试剂盒显影,Image J软件分析蛋白条带灰度值,用目的蛋白灰度值除GAPDH蛋白灰度值,以对照组均数进行标准化,计算目的蛋白相对表达量。
1.6 凋亡相关蛋白检测 采用Western blotting法检测各组细胞中的Bcl-2、Bax、Cleaved Caspase-3。使用RIPA裂解缓冲液提取细胞总蛋白并进行蛋白定量;蛋白提取物加载到聚丙烯酰胺凝胶电泳上进行蛋白分离并转至PVDF膜;转膜后用5%脱脂奶粉封闭,洗膜3次,分别加入Bcl-2(1∶500)、Bax(1∶500)、Cleaved Caspase-3(1∶500)及GAPDH(1∶1 000)抗体,4 ℃孵育过夜;洗膜后加入辣根过氧化物酶标记的羊抗兔或羊抗鼠二抗室温孵育2 h;使用ECL试剂盒显影,Image J软件分析灰度值并计算蛋白相对表达量。

2 结果
2.1 各组DNMT活性比较 对照组、OGD/R组、OGD/R+SAM组DNMT活性分别为4.376±0.255、3.471±0.146、4.145±0.135。OGD/R组DNMT活性低于对照组(P<0.01),OGD/R+SAM组DNMT活性高于OGD/R组(P<0.05)。
2.2 各组细胞中DNMT3a、tPA mRNA及蛋白表达比较 OGD/R组DNMT3a mRNA和蛋白表达低于对照组,tPA mRNA和蛋白表达高于对照组(P均<0.05);OGD/R+SAM组DNMT3a mRNA表达高于OGD/R组,tPA mRNA和蛋白表达低于OGD/R组(P均<0.05)。详见表1。
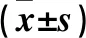
表1 各组细胞中DNMT3a、tPA mRNA及蛋白表达比较
2.3 各组细胞中凋亡相关蛋白表达比较 OGD/R组Bcl-2蛋白表达及Bcl-2/Bax低于对照组,Bax、Cleaved Caspase-3蛋白表达高于对照组(P均<0.01);OGD/R+SAM组Bcl-2蛋白表达及Bcl-2/Bax高于OGD/R组,Bax、Cleaved Caspase-3蛋白表达低于OGD/R组(P均<0.05)。详见表2。
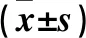
表2 各组细胞中凋亡蛋白表达比较
3 讨论
NHIE引起一系列细胞凋亡、氧化应激及炎症反应等,目前可用的治疗策略非常有限[5]。在NHIE发病过程中,星形胶质细胞的功能障碍发挥着非常重要的作用[6]。近年来,NHIE发病过程中DNA甲基化水平与相关基因表达成为研究热点。研究发现,哺乳动物DNA甲基化在不同细胞种类中均由DNMTs(DNMT1/DNMT3a/DNMT3b)催化。在DNA甲基化的过程中,甲基化的CpG二核苷酸能被甲基化CpG结合域蛋白家族识别并黏附,造成染色质重塑和基因沉默[7]。妊娠期缺氧可能导致胎儿大脑持续的全脑低甲基化,从而引起大脑对缺氧诱导的损伤敏感,造成神经行为学功能紊乱[8]。SAM作为甲基供体,是一种参与甲基转移反应的辅酶,在脑缺血过程中可升高DNA甲基化水平,可作为DNA甲基化激活剂,防止海马区神经元退行性变[9]。本研究结果显示,OGD/R可降低细胞DNMT活性,同时在基因和蛋白水平上,使DNMT3a表达明显下降;而SAM可逆转由OGD/R诱导的DNMT活性以及DNMT3a表达的下降,表明SAM可逆转OGD/R引起的DNA甲基化水平降低。
中枢神经系统中tPA的诱导表达是新生大脑缺氧缺血后的特异性反应,而在成人大脑缺血缺氧损伤后,tPA表达下降[10]。tPA在中枢神经系统中具有复杂的功能:一方面,tPA可预防和治疗由大脑缺氧缺血诱导血管内血栓形成而引起的一系列大脑损伤;另一方面,tPA对未成熟大脑实质具有多种有害影响,主要包括组织蛋白水解、继发性脑水肿破坏血脑屏障、小胶质细胞活化、谷氨酰胺兴奋毒性损伤神经元和少突胶质细胞等,也可通过tPA下游调节因子调节多种有害反应[11]。本研究中,OGD/R状态下星形胶质细胞中tPA的表达明显升高,而应用DNA甲基化激活剂SAM可逆转OGD/R诱导的tPA表达升高。有前期研究发现,应用DNMT抑制剂5-氮杂-2′-脱氧胞嘧啶干预星形胶质细胞,可显著上调tPA的表达[12]。以上研究提示,OGD/R诱导的tPA表达升高可能与DNA甲基化水平降低有关,这需要进一步论证。检测tPA启动子区域的DNA甲基化水平变化可作为二者关系的证据,这将是我们下一步研究的重点。
大量研究表明,未成熟大脑的发育过程及脑缺氧、创伤等损伤过程中,细胞凋亡程度与新生鼠缺血缺氧性脑损伤密切相关。此外,在急慢性神经退行性变的发病过程中,星形胶质细胞凋亡能进一步影响神经元的存活[13]。细胞凋亡涉及多种因素,其中抗凋亡蛋白Bcl-2和促凋亡蛋白Bax的比例对细胞存活起到重要作用[14]。Caspase-3在各种凋亡途径中发挥促凋亡功能。在凋亡开始后,Caspase-3被裂解并激活成为Cleaved Caspase-3,传递凋亡信号给下游的靶基因发挥作用[15]。本研究发现,OGD/R可使星形胶质细胞中Bcl-2/Bax下降、Cleaved Caspase-3表达上调,给予SAM可逆转上述影响。但有研究显示,阻断DNMT可抑制由氧化应激引起的小脑皮质神经元的凋亡[16]。本研究所得结果与其相反,这可能与细胞类型、损伤模型制作等实验条件不同相关。
结合上述研究结果,我们认为,OGD/R的星形胶质细胞DNA甲基化水平降低,tPA表达上调,促进细胞凋亡;而SAM干预可逆转OGD/R导致的上述改变。DNA甲基化水平升高可抑制OGD/R诱导的细胞凋亡过程,部分是通过降低tPA的表达来完成。这些结果为DNA甲基化激活剂在NHIE治疗中的应用提供了理论依据。

