川崎病急性期患儿血清对人脐静脉血管内皮细胞氧化应激、增殖及凋亡的影响
胡景伟,牛红艳,萨初然贵,高崇华,杨淑兰
内蒙古医科大学赤峰临床医学院,内蒙古赤峰024000
川崎病(KD)又称为皮肤黏膜淋巴结综合征,是一种以全身中、小动脉炎性病变为主要病理变化的急性热性发疹性疾病,冠状动脉病变(CAL)是KD最严重的并发症[1]。研究发现,KD患者存在不同程度的血管内皮细胞损伤[2],表现为细胞剥脱、裸露、间裂隙增大、穿孔等,这些损伤与CAL并发症密切相关,即使在静脉应用丙种球蛋白(IVIG)治疗后仍可持续存在[3]。近年来,氧化应激(OS)在血管性疾病病理过程中发挥的作用日益受到重视。目前常用的OS相关指标主要包括丙二醛(MDA)和超氧化物歧化酶(SOD),前者反映细胞受自由基攻击的损伤程度,后者是一种强抗氧化剂。有研究显示,外周血淋巴细胞凋亡异常与KD发病有关,但关于血管内皮细胞凋亡与KD关系的研究尚不多见。2017年1月~2019年10月,本研究观察了KD急性期患儿血清对人脐静脉血管内皮细胞(HUVEC)氧化应激、增殖和凋亡影响,现报告如下。
1 材料与方法
1.1 血清、细胞与主要材料 选择2017年1月~2018年1月于我院住院治疗的KD急性期患儿12例,男7例、女5例,年龄1岁5个月~6岁11个月,均符合2004年美国儿科学会和心脏病学会制订的诊断标准,病程均在1周以内,未经过IVIG治疗。选取同期在本院儿科门诊体检的健康儿童10例作对照,男6例、女4例,年龄2岁1个月~6岁10个月。检查证实肝肾心功能正常,无基础心血管疾病,无感染性及免疫性疾病。在经医院医学伦理委员会批准、研究对象监护人知情同意的情况下,抽取KD患儿及健康儿童外周静脉血2 mL,EDTA抗凝,1 500 r/min离心5 min,收集上清液,-80 ℃冰箱保存。HUVEC(上海中乔新舟生物科技有限公司),RPMI-1640培养基(美国Hyclone公司),CCK-8溶液(中国BioSharp公司),MDA、SOD ELISA试剂盒(武汉百仟度生物科技有限公司),FACSCalibur流式细胞仪(美国BD公司),DCFH-DA粉剂(美国Sigma公司),RNA提取液(美国Invitrogen公司),RevertAid First Strand cDNA Synthesis Kit(美国Thermo公司),FastStart Universal SYBR Green Master(美国Roche公司),荧光定量PCR仪(美国ABI公司),引物由武汉百仟度生物科技有限公司合成(引物序列见表1),兔抗人Bcl-2一抗(美国CST公司),兔抗人Caspase-3一抗(英国Abcam公司),兔抗人Bax一抗(英国Abcam公司),山羊抗兔HRP标记二抗(美国KPL公司)。

表1 Bax、Caspase-3、Bcl-2基因引物序列
1.2 HUVEC培养和分组 HUVEC培养于RPMI-1640培养基中,将培养皿置于含5%CO2的37 ℃恒温培养箱。根据处理条件的不同将HUVEC细胞分为正常组和KD组,分别加入15%健康儿童血清和15% KD患者血清培养24 h。
1.3 OS相关指标检测
1.3.1 MDA、SOD含量检测 收集两组HUVEC悬液置于试管中,采用ELISA法检测MDA和SOD。
1.3.2 活性氧(ROS)阳性细胞百分比测算 将处于对数生长期的HUVEC接种于6孔板内,置于5%CO2、37 ℃条件培养箱中培养24 h。按“1.2”方法分组处理细胞,培养24 h后加入终浓度为10 μmol/L的DCFH-DA,37 ℃下避光孵育30 min,每隔3~5 min混匀,使探针和细胞充分作用,离心去上清,洗涤并重悬细胞后上流式细胞仪测算ROS阳性细胞百分比(激发光488 nm,发射光525 nm)。每组设3个样本。重复3次。
1.4 细胞增殖能力观察 采用CCK-8法。将对数生长期的HUVEC用胰蛋白酶消化,按1×104/孔接种于96孔板,每孔加100 μL,置于5%CO2、37 ℃条件培养箱培养24 h。按“1.2”方法分组处理细胞,培养24 h后每孔补加10 μL的CCK-8试剂,孵育2 h,用酶标仪测定在450 nm处的光密度(OD)值,表示细胞增殖能力。每组样本设3个空孔,重复3次。
1.5 细胞凋亡相关基因及蛋白检测
1.5.1 凋亡相关基因检测 按试剂盒说明提取两组HUVEC的总RNA,按逆转录合成试剂盒说明书合成cDNA,将合成的cDNA与引物序列等配制成反应体系,采用RT-PCR法检测Bax、Caspase-3、Bcl-2 mRNA,以GAPDH作为内参。以2-ΔΔCt表示目的基因相对表达量。
1.5.2 凋亡相关蛋白检测 采用Western blotting法。以β-actin为内参,Image J软件分析蛋白条带灰度值作为目的蛋白相对表达量。

2 结果
2.1 两组OS相关指标比较 KD组MDA水平、ROS阳性细胞百分比高于正常组,MDA水平低于正常组(P均<0.05)。见表2。
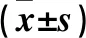
表2 两组OS相关指标比较
2.2 两组细胞增殖能力比较 KD组、正常组细胞增殖能力分别为0.54±0.01、0.84±0.03,KD组细胞增殖能力低于正常组,两组差异有统计学意义(P<0.01)。
2.3 两组凋亡相关基因及蛋白表达比较 KD组Bax、Caspase-3 mRNA和蛋白相对表达量高于正常组,Bcl-2 mRNA和蛋白相对表达量低于正常组(P均<0.05)。详见表3。
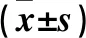
表3 两组凋亡相关基因及蛋白表达比较
3 讨论
KD是一种主要累及中小动脉的全身血管炎性疾病,本病是否发生CAL是决定患者长期预后的关键因素。研究发现,CAL与血管内皮细胞功能障碍有关[4],因此,研究KD患者血管内皮细胞损伤的发生机制具有重要意义。造成KD血管内皮损伤的机制有很多,本研究从OS、细胞增殖和凋亡的角度,通过体外实验研究探讨KD患儿血管内皮细胞损伤的机制。
OS是指机体在遭受有害刺激时,体内ROS产生过多,氧化程度超过氧化物的清除速度,导致组织损伤。研究显示,OS通过细胞信号转导、蛋白质变性、脂质过氧化反应等途径引起细胞损伤及坏死,促进淋巴细胞和单核巨噬细胞迁移,从而导致血管内皮细胞的通透性增加、引起细胞的坏死和凋亡[5]。Kaneko等[6]发现,KD急性期患者ROS水平明显高于发热患者,而KD患者在应用IVIG后与应用IVIG之前比较,ROS明显降低,提示OS参与KD的发生。还有研究发现,KD急性期患者血清8-异构前列腺素、MDA和H2O2明显升高[7,8],尤其是在伴有CAL的患者,这种改变更加明显[9]。8-异构前列腺素是DNA氧化应激损伤的产物之一,MDA是膜脂过氧化产物,两项指标改变均提示OS参与了KD患者CAL的发生。有学者发现,KD患者血清OS相关指标明显高于健康儿童,经过IVIG治疗后OS指标明显下调,但是仍然高于健康儿童[10],提示OS持续存在,这可能是部分KD患者即使应用IVIG治疗仍然发生CAL的原因[11]。Xu等[12]发现,小檗碱可通过抑制OS保护KD患者冠状动脉内皮细胞,减轻损伤。本研究结果显示,KD急性期患儿血清作用于HUVEC后导致参与OS的ROS和OS产物MDA水平明显升高,抗氧化应激反应的SOD水平明显降低,与前述结果一致。这提示KD患者存在氧化/抗氧化系统失衡,而且血管内皮细胞是OS的作用靶细胞,相关具体机制尚需进一步研究,可能与抑制Nrf2和PI3K/AKT信号通路有关[13]。
研究发现,KD患者外周血单个核细胞诱导分化的内皮组细胞与正常儿童组比较,其增殖能力、迁移能力和贴壁能力均显著下降[14]。有学者将HUVEC经正常血清、发热患儿血清、无CAL和合并CAL的KD患者血清处理后,应用MTT法检测细胞增殖情况,结果显示,经KD血清干预后的细胞活性低于正常组和发热组,且合并CAL组低于无CAL组,提示KD血清能够抑制HUVEC增殖[15]。本研究采用CCK-8法检测细胞增殖能力,结果发现KD组细胞增殖能力明显低于正常组。这提示KD急性期血清对HUVEC增殖具有抑制作用,与前述研究结果相一致,具体机制可能与TNF-α有关。有学者发现TNF-α可以通过PI3K/AKT/eNOS信号途径损伤内皮祖细胞,而在KD患者血清内TNF-α明显升高[16]。还有研究认为,KD患儿血清对HUVEC增殖的抑制作用可能与miR-27b通过影响转化生长因子-β的活性实现的[17]。
刘丽莎等[15]发现,经KD患儿血清作用后,HUVEC的凋亡率增加,与对照组相比差异有统计学意义,且CALs组凋亡率高于非CALs组。本研究检测了两组细胞中凋亡相关基因和蛋白(Bcl-2、Bax、Caspase-3)表达,发现KD组促进凋亡的Bax、Caspase-3 mRNA和蛋白相对表达量高于正常组,而抑制凋亡的Bcl-2 mRNA和蛋白表达低于正常组,提示KD患儿血清可导致HUVEC凋亡增加,其具体机制需进一步研究。研究显示,KD患者血中Caspase-4基因表达与健康对照组相比显著升高,NF-κB信号通路相关因子表达也发生变化,且两者存在线性关系,提示婴幼儿在受到环境因素和遗传因素影响后,NF-κB信号通路激活后被释放进入细胞核内,引起Caspase-4基因表达变化,进而导致KD的发生[18]。Wu等[19]的研究表明,KD血清可以导致HUVEC凋亡,这一过程与miR-186升高导致MAPK信号通路激活有关。还有研究发现,经KD血清处理过的单核巨噬细胞可以激活HMGB1/RAGE/组织蛋白酶B信号途径,导致NLRP3炎症小体活化,进而引起HUVEC坏死[20]。
综上所述,HUVEC经KD急性期患儿血清处理后,细胞氧化应激损伤增强,细胞增殖抑制而凋亡增加,这些异常变化可能与KD的发生密切相关。但是,KD患者血清中何种成分导致上述变化及其相应机制尚需进一步研究。

