高粱SbJAZ1基因克隆与表达分析
蒋君梅 陈美晴 宁 娜 方远鹏 郭继元 罗丽婷 任明见,2 谢 鑫,2,*
(1 贵州大学农学院,贵州 贵阳 550025;2 国家小麦改良中心贵州分中心,贵州 贵阳 550025;3茅台学院资源环境系,贵州 遵义 564507)
高粱[Sorghumbicolor(L.) Moench]别称蜀黍、芦粟等,是一种耐旱能力强,且产量较高的农作物。自古以来,高粱就有“五谷之精、百谷之长”的盛誉。高粱已成为我国重要的粮食作物之一,但由于病害和虫害的发生,每年都会造成大面积的减产减收,对高粱的产量和质量造成重大影响[1],成为高粱生产面临的主要问题之一。
茉莉酸(jasmonic acid, JA)普遍存在于各种植物中,具有生理调节功能,是目前公认的植物内源生长调节物质之一[2]。JA作为一种激发子(elicitor),是植物受病原和创伤诱导的防卫基因表达信号分子[3-6]。已有大量遗传学和分子生物学证据表明,JA参与植物对病原菌和植食性昆虫的防御过程[7-8]。当植物受到昆虫或病原菌攻击时,会诱发其体内产生并积累JA,增加的JA信号分子会“拉响警报”,使周围的组织立即进入“警备状态”,做好抗击昆虫和病原菌入侵的准备[9]。例如,当拟南芥(Arabidopsisthaliana)JA识别受体受到突变或合成途径受阻时,其面对病原菌丁香假单胞菌(Pseudomonassyringae)侵染时表现为感病;而JA受体超表达的拟南芥植株对病原菌的抗性则明显增强[10-12]。植物在受到植食性昆虫伤害时,体内JA和脱落酸(abscisic acid,ABA)含量会短时间内增加[13-14]。研究报道,JA能诱导烟草(Nicotianatabacum)、拟南芥、陆地棉(Gossypiumhirsutum)和丹参(Salviamiltiorrhiza)等植物防卫基因表达,提高植物的抗病性[15-18]。这些研究说明JA在诱导植物抗性过程中可能起着十分重要的作用。
JAZ(jasmonate ZIM-domain)蛋白是JA信号途径中重要的负调控因子,是植物中特有的锌指蛋白,属于TIFY蛋白家族,其主要包含Jas和ZIM(zinc-finger protein expressed in inflorescence meristem)2个保守结构域。ZIM结构域存在于N端,又称为TIFY结构域,Jas则存在于C端,又称为CCT_2结构域[19]。JAZ蛋白在JA途径中可协同其他激素控制植物生长代谢,也是植物响应逆境胁迫的关键调控因子。有研究表明过表达JAZ7可提高拟南芥的耐旱性,JAZ基因也参与光合速率等过程[20]。在大豆中,GsJAZ基因的超表达,可增强大豆的耐碱性和耐盐性[21]。烟草NtJAZ1和棉花GhJAZ2基因的表达削弱了其对JA的敏感性,从而导致其对烟草黑胫病和棉花黄萎病的敏感性增加[15, 22]。然而在高粱中鲜见关于JAZ基因的相关报道。
本研究克隆了1个高粱JAZ基因SbJAZ1,并对其进行生物信息学、基因表达分析,构建其原核表达载体PET-28a-SbJAZ1;对重组蛋白进行诱导表达,研究其可溶性表达的最佳条件,旨在为SbJAZ1基因的功能学研究提供基础。
1 材料与方法
1.1 试验材料
1.1.1 供试材料与处理 将高粱BTx623种子(中国科学院植物研究所景海春老师馈赠)表面消毒后,播种于灭菌营养土中,置于光照培养箱25℃培养。待高粱幼苗长出3片真叶时,选取生长状况良好的幼苗喷施JA、吲哚乙酸(indole-3-acetic acid,IAA)、聚乙二醇(polythy lene slycol, PEG-6000),其处理浓度分别为100 μmol·L-1、10 μmol·L-1和0.2 g·mL-1,分别在处理0、0.5、1、3、6、9、12和24 h时取样,每个时间点设置3个生物学重复,每个生物学重复取5株幼苗,样品放入液氮速冻后,于-80℃冰箱保存备用。
1.1.2 菌株和质粒 大肠杆菌菌株BL21(DE3)、Rosetta(DE3)、BL21(DE3)pLysS和Tuner(DE3)和pET-28a质粒均为贵州大学农学院植物病理教研室保存。
1.1.3 酶、试剂和抗体 限制性内切酶(EcoRⅠ,HindⅢ)、DNA连接酶购自宝生物工程(大连)有限公司,茉莉酸甲酯及聚丙烯凝胶电泳相关试剂均购自北京酷来博生物公司,Western blot 所用抗体购自北京聚合美生物公司。
1.2 试验方法
1.2.1 高粱总RNA提取及cDNA反转录 取保存的高粱处理材料,液氮研磨后,利用RNA提取试剂盒[普洛麦格(北京)生物技术有限公司]提取总RNA,并利用Gene star反转录试剂盒(北京康润诚业生物科技有限公司)反转录获得cDNA第一链。
1.2.2SbJAZ1基因克隆 以cDNA为模板,设计引物扩增SbJAZ1基因,引物序列如下:上游引物:SbJAZ1-F:G CGAATTCATGGCCGCCGAGCA(下划线为EcoRⅠ酶切位点);下游引物:SbJAZ1-R:CGAAGCTTGCTGAGGCTGAGCGCG(下划线为HindⅢ酶切位点)。PCR 扩增条件:95℃预变性2 min;95℃变性30 s,58℃退火20 s,72℃延伸1 min, 35个循环;72℃终延伸5 min。
1.2.3SbJAZ1基因的生物信息学分析 用DNAMAN软件中的Homology Tree构建JAZ1的系统进化树,并进行JAZ1基因的同源性比对;利用NCBI在线工具预测蛋白保守结构域;分别采用Prot-Param(https://web.expasy.org/protparam/)和ProtScale(https://web.expasy.org/protscale/)工具预测蛋白的等电点、分子量等理化性质和亲疏水性;使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/)预测蛋白的二、三级结构。
1.2.4SbJAZ1基因表达分析 利用实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)检测SbJAZ1基因的表达,其反应体系为cDNA 4.5 μL, SYBR Premix 7.5 μL,SbJAZ1基因上下游引物(表1)各0.3 μL,去离子水2.4 μL。反应程序:95℃预变性10 min;95℃变性15 s,55℃退火15 s,72℃延伸20 s,40个循环;95℃ 10 s,65℃ 10 s,1个循环,数据分析采用 2-ΔΔCt法进行。
表1 引物序列Table 1 Primer sequences
1.2.5 pET-28a-SbJAZ1重组载体构建 将测序正确的SbJAZ1基因与pET-28a载体分别用EcoRⅠ和HindⅢ进行双酶切,产物经电泳检测鉴定后,用DNA 连接酶连接,构建pET-28a-SbJAZ1重组质粒。
1.2.6 SbJAZ1蛋白可溶性诱导表达 将测序成功的重组质粒pET-28a-SbJAZ1分别转化到BL21(DE3)、Rosetta(DE3)、BL21(DE3)pLysS和Tuner(DE3)菌株中,加入0.8 mmol·L-1异丙基硫代半乳糖苷(isopropylβ-D-thiogalactoside,IPTG),25℃诱导10 h,筛选SbJAZ1蛋白表达最佳菌株;将筛选到的菌株分别在16、20、25、30和37℃诱导表达5~16 h,筛选出最佳诱导温度;设置IPTG浓度为0.2、0.4、0.6、0.8、1.0和1.2 mmol·L-1,确定最佳诱导浓度。
细菌蛋白提取:诱导表达的细菌菌液用12 000 r·min-1离心收集,加入磷酸缓冲液(phosphate buffered solution, PBS),用VCX BOPB超声破碎仪(美国Sonics公司)进行细胞破碎,离心10 min,分别取上清和沉淀,加入5×Loading Buffer,沸水浴10 min。将处理好的蛋白样品用12% SDS-PAGE凝胶电泳进行蛋白电泳检测。
1.2.7 SbJAZ1重组蛋白Western blot检测 以空载体为对照,将重组蛋白SbJAZ1用12% SDS-PAGE凝胶电泳进行分离,然后将蛋白转印到PVDF膜上(冰水浴,300 mA转膜75 min),牛奶封闭后分别加入一抗(Anti His)和二抗(Goat Anti-Mouse)进行孵育。最后,在PVDF膜上加入辣根过氧化物酶(horse rodish peroxidase, HRP)化学发光液显色,检测蛋白表达情况。
2 结果与分析
2.1 SbJAZ1基因克隆及载体构建
取1.1.1保存的高粱处理材料,提取其总RNA,反转录获得cDNA作为模板,通过水稻OsJAZ1基因的蛋白序列(基因号为LOC_Os10g0392400),在高粱基因组数据库Phytozome中获得高粱同源基因SbJAZ1,并以此基因的序列作参考,采用Primer Premier 5.0设计的SbJAZ1-F/SbJAZ1-R引物进行PCR扩增SbJAZ1基因,用1%琼脂糖凝胶电泳检测PCR产物,得到一条约600 bp的条带(图1-A)。进一步将PCR扩增得到的SbJAZ1基因与原核表达载体pET-28a分别用EcoRⅠ和HindⅢ进行酶切,回收酶切产物进行连接,连接产物转化大肠杆菌感受态细胞,筛选、鉴定,如图1-B所示,pET-28a-SbJAZ1重组载体经EcoRⅠ/HindⅢ双酶切后,得到一条约600 bp的条带,随后送重组质粒进行测序验证,发现该基因全长606 bp,编码201个氨基酸,且得到的目的条带序列与高粱基因组数据库中的一致。
2.2 生物信息学分析
2.2.1SbJAZ1基因系统进化及同源性分析 利用DNAMAN中的Homology Tree对JAZ1基因构建系统进化树,如图2所示。SbJAZ1与单子叶植物玉米属同一分支,其亲缘关系最近,达到92%,与双子叶植物拟南芥、烟草、草莓和棉花的亲缘关系较远。
2.2.2 SbJAZ1蛋白保守结构域分析 利用NCBI在线网站对SbJAZ1蛋白保守结构域进行预测,结果表明, 此蛋白在89~123、145~169氨基酸处分别存在TIFY和CCT_2 2个保守结构域(图3)。由于JAZ蛋白属于TIFY转录因子超家族成员之一,且SbJAZ1具有TIFY和CCT_2 保守结构域,推测SbJAZ1属于JAZ基因家族成员[15]。
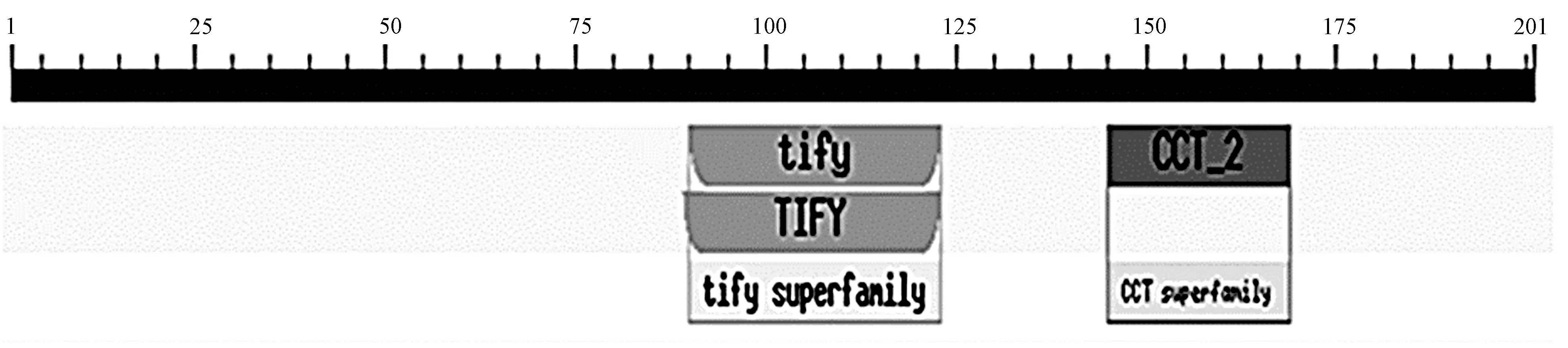
图3 SbJAZ1蛋白保守结构域Fig.3 Conserved protein domain of SbJAZ1
2.2.3 SbJAZ1蛋白的理化性质和亲疏水性分析 用Prot-Param对SbJAZ1蛋白的理化性质进行分析,由表2可知,SbJAZ1蛋白的分子式为C919H1488N264O289S9,分子量为21 148.06,氨基酸数为201,蛋白质等电点为7.70,带正电荷的残基总数(Arg + Lys)为24,带负电荷的残基总数(Asp + Glu)为23,根据此蛋白的酸、碱性氨基酸组成和等电点显示该蛋白呈中性。不稳定系数为64.37,脂肪指数为 69.25,表明此蛋白有较好的脂溶性。EXPASy的Prot-Param tool预测得知SbJAZ1蛋白的亲水性的平均值(grand average of hydropathy, GRAVY)为-0.372,这与ExPASy-ProtScale预测结果一致,说明该蛋白为亲水性蛋白(图4)。

表2 SbJAZ1蛋白的基本理化性质Table 2 Basic physical and chemical parameters of SbJAZ1protein
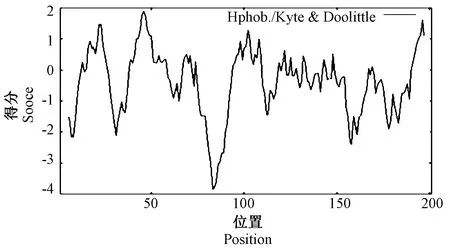
图4 SbJAZ1蛋白亲疏水性分析Fig.4 Hydrophilic analysis of SbJAZ1 protein
2.2.4 SbJAZ1蛋白的二、三级结构预测 利用SOPMA对SbJAZ1的蛋白进行蛋白质二级结构预测,如图5-A所示,SbJAZ1蛋白的二级结构中α螺旋占25.37%、延伸链占9.95%、 β转角占4.98%,无规则卷曲占59.70%;利用SWISS-MODEL(https://swissmodel.expasy.org/)进行同源建模(图5-B), 其结果显示SbJAZ1蛋白与模板5t0q.1.B(拟南芥的JAZ10 Jas结构域)的三级结构一致度达到62.96%,三级结构与SbJAZ1蛋白的二级结构预测结果一致。
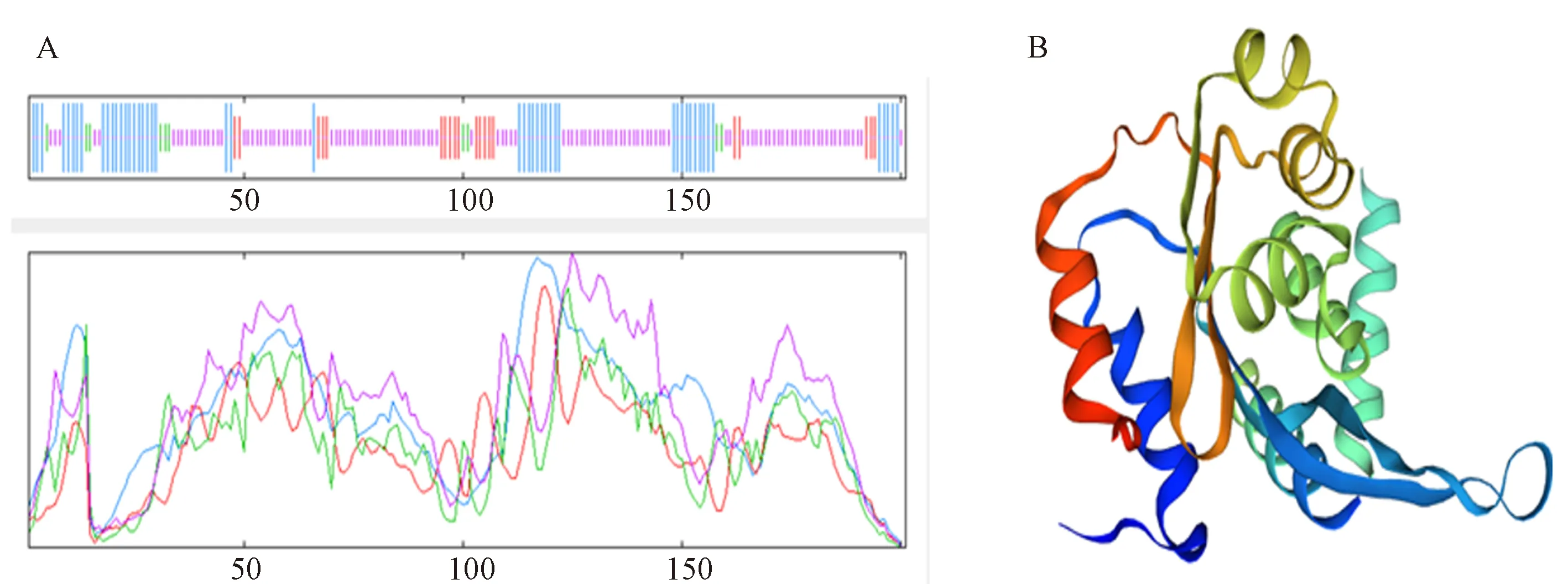
图5 SbJAZ1 蛋白二级、三级结构预测Fig.5 Secondary and tertiary structure prediction of SbJAZ1 protein
2.3 SbJAZ1基因表达分析
2.3.1SbJAZ1的组织表达模式 采用qRT-PCR对SbJAZ1在高粱不同组织中的表达模式进行分析,结果表明,SbJAZ1在根、茎、叶和芽组织中均有表达,但具有组织特异性,在茎中表达量最高,在根中较少(图6)。
2.3.2SbJAZ1响应JA的表达模式 为了进一步研究SbJAZ1基因对JA的响应,对JA处理过的高粱茎进行qRT-PCR分析,检测高粱茎中SbJAZ1基因的相对表达量。结果表明,JA处理1 h后,茎中SbJAZ1的表达量最高,且随着处理时间的延长表达量呈下降趋势(图7)。
2.3.3SbJAZ1响应其他胁迫的表达模式 为研究SbJAZ1基因对胁迫的响应,利用qRT-PCR 分析高粱经IAA、PEG-6000处理后SbJAZ1基因的相对表达量。结果表明,SbJAZ1在IAA处理1 h后表达量最高,随后逐渐降低,在处理9 h时表达量再次上调,随后降低(图8-A);PEG-6000处理时,SbJAZ1表达量呈先升后降的趋势,在处理3 h时表达量最高(图8-B)。

注:内参基因:SbEIF4a;不同小写字母表示各处理之间差异显著(P<0.05)。下同。Note: Internal reference gene: SbEIF4a. Different lowercase letters represent the significance of variance analysis between each treatment at 0.05 level. The same as following.图6 SbJAZ1的组织特异性表达Fig.6 Tissue specific expression of SbJAZ1

图7 SbJAZ1响应JA处理表达分析Fig.7 Expression analysis of SbJAZ1 after JA treatment
2.4 SbJAZ1原核表达分析
2.4.1 SbJAZ1蛋白表达菌株、诱导温度、IPTG浓度的筛选 由图9-A可知,SbJAZ1在BL21(DE3)pLysS、BL21(DE3)和Rosetta(DE3)菌株中均可溶性表达(泳道1、3、4),条带大小约为26 kDa。但在Tuner(DE3)菌株中未见明显表达条带(泳道2),说明该蛋白在Tuner(DE3)菌株不表达。对比SDS-PAGE结果,发现SbJAZ1在Rosetta(DE3)菌株中表达条带最亮(泳道4),说明该菌株为最佳表达菌株。
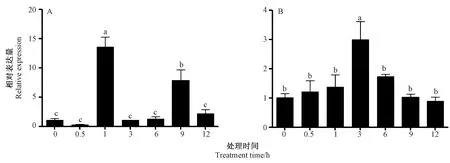
注:A:IAA处理;B:PEG-6000处理。Note: A:IAA treatment. B:PEG-6000 treatment.图8 SbJAZ1响应其他胁迫表达分析Fig.8 Expression analysis of SbJAZ1 under other stresses treatments
SDS-PAGE结果显示,SbJAZ1在16、20、25、30和37℃条件下均可表达(图9-B),对比电泳结果发现,SbJAZ1在30℃条件下表达条带最亮(泳道4),因此30℃为最佳诱导温度。
由图9-C可知,随着IPTG浓度的增加,SbJAZ1蛋白表达量逐渐增加,在IPTG浓度为0.8 mmol·L-1时目标条带亮度最明显,可溶性蛋白表达量最多(泳道5),说明该浓度为最佳诱导浓度。
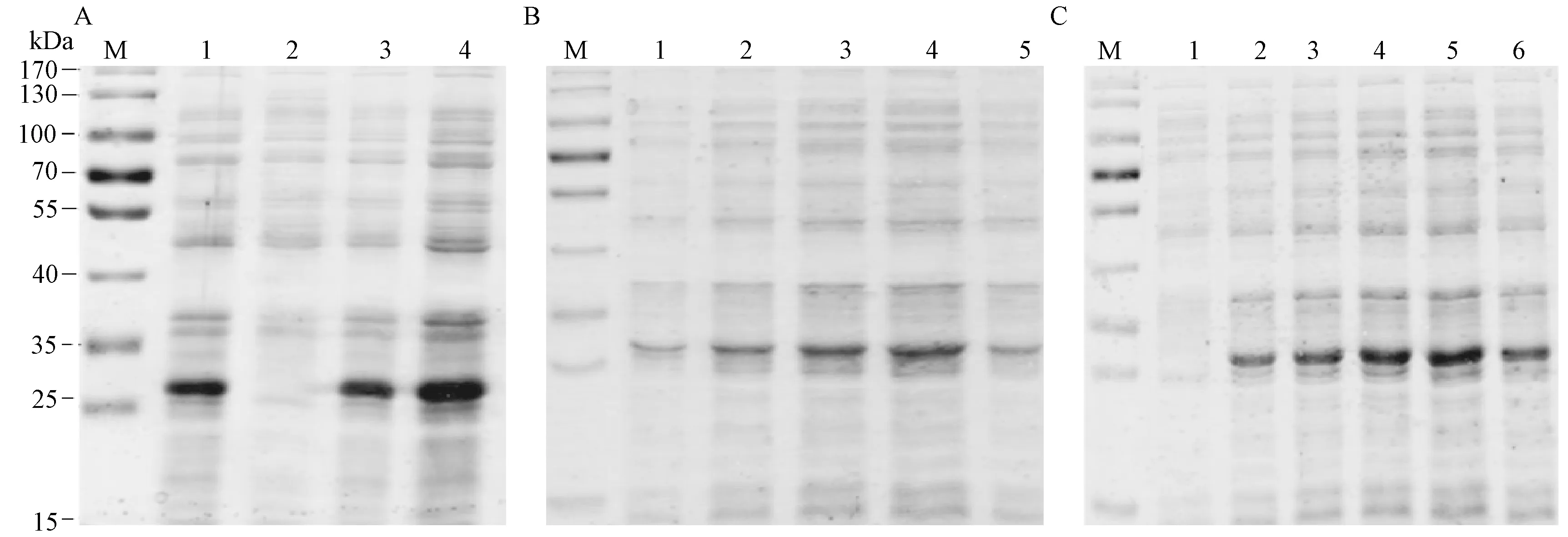
注A:M:Marker;1:BL21(DE3)pLysS裂解上清;2:Tuner(DE3)裂解上清;3:BL21(DE3)裂解上清;4:Rosetta(DE3)裂解上清;B:M:Marker;1~5:分别为SbJAZ1在16、20、25、30、37℃条件下诱导表达的细胞上清;C:M:Marker;1: 空载体细胞上清;2~6:分别为SbJAZ1在0.2、0.4、0.6、0.8、1.0 mmol·L-1 IPTG条件下诱导表达的细胞。Note: A: M: Marker. 1: BL21(DE3)pLysS pyrolysis supernatant. 2: Tuner (DE3) pyrolysis supernatant. 3: BL21 (DE3) pyrolysis supernatant. 4: Rosetta (DE3) pyrolysis supernatant. B: M: Marker. 1~5: Cell supernatants induced by SbJAZ1 at 16, 20, 25, 30 and 37℃, respectively. C: M: Marker. 1: Cell supernatants of empty vector. 2~6: Cell supernatants induced by IPTG at 0.2, 0.4, 0.6, 0.8, 1.0 mmol·L-1, respectively.图9 SbJAZ1蛋白在不同菌株、诱导温度及IPTG浓度下的表达分析Fig.9 Expression analysis of SbJAZ1 protein in different strains, induction temperature and IPTG concentration
2.4.2 SbJZA1重组蛋白的Western blot检测 为进一步确定SbJAZ1蛋白是否表达成功,采用Western blot对SbJAZ1重组蛋白进行检测。在PVDF膜上可观察到一条大小约为26 kDa的蛋白条带,且目标条带单一,同时在空载体中并未发现条带(图10),说明SbJAZ1蛋白诱导表达成功。

注:M:Marker;1:SbJAZ1重组蛋白经诱导表达的细胞沉淀;2:SbJAZ1重组蛋白经诱导表达的细胞上清;3:空载体诱导表达的细胞上清。Note: M: Marker. 1: The lysate precipitation of SbJAZ1 recombinant bacteria after induction. 2: Cell supernatants of SbJAZ1 recombinant bacteria after induction. 3: Supernatant of empty vector after induction.图10 SbJAZ1重组蛋白Western blot检测Fig.10 Detection of SbJAZ1 recombinant protein by Western blot
3 讨论
JA是一种重要的植物激素,在植物应对生物和非生物胁迫中扮演着重要的角色[23]。当植物受到生物(昆虫侵食、植食性动物伤害及死体型病原菌侵染)和非生物逆境(干旱、盐碱、低温、紫外等)胁迫时,会促使受激部位产生大量JA,诱导产生广谱而又持续的系统抗性[23-27]。另外,JA对植物抵御活体营养型病原菌也具有重要作用[28]。除了调控由病原菌引起的系统获得性抗性外,非病原菌(如根际促生细菌pseudomonasfluorescens)定殖植物根系会引发植物地上部分对病原菌的抗性[29]。有研究报道,JA在促进马铃薯、山药和菊芋块茎,红薯块根形成,洋葱和大蒜鳞茎形成,以及葫芦卷须的盘绕等形态建成中起重要作用[2,30-33]。施用外源JA能促使高粱、水稻、小麦等禾本科植物颖花提前开放[34]。
JAZ基因家族是JA信号途径中重要的抑制因子,不仅调控JA响应基因的表达,而且还能将JA的信号与其他信号相连接,对JAZ的研究有利于更进一步了解植物内部激素的调控防御机制[35-39]。目前,对JAZ1的研究已经在棉花、水稻、烟草等多种植物中报道,结果显示,JAZ1的功能在不同植物中有差异[40-41],在水稻中OsJAZ1通过调节JA和ABA信号来减弱抗旱性[42]。酵母单杂交和ChIP-qPCR分析证明GhWRKY22通过直接结合其启动子调节花药/花粉发育来调节JAZ基因的表达[43]。有研究表明DELLA蛋白与JAZ1发生物理相互作用,并动态调节赤霉素(gibberellin, GA)和JA信号通路的相互作用[44]。
苹果MdJAZ1基因编码蛋白的大小为 40.536 kDa,系统发育分析显示,其与拟南芥JAZ家族AtJAZ3、AtJAZ4亲缘关系最近[45];烟草NtJAZ1蛋白含有TIFY和CCT-2(Jas结构域)2个保守结构域,进化分析表明,NtJAZ1和番茄SlJAZ1同属一个分支,亲缘关系较近[15]。研究报道,白木香(Aguilariasinensis)JAZ1基因可在大肠杆菌BL21(DE3)和Rosetta(DE3)中可溶性表达[46]。本研究显示,高粱SbJAZ1与玉米ZmJAZ1亲缘关系最近,可在BL21(DE3)和Rosetta(DE3)中可溶性表达,在Rosetta(DE3)菌株中表达量最高。由此发现,JAZ1在不同的植物中的蛋白大小、亲缘关系、重组蛋白原核表达条件等都有所不同。
本研究发现SbJAZ1基因在茎中的表达量高于其他组织(图6),这与水曲柳(Fraxinusmandshurica)FmJAZ1基因在茎中表达量最高的结果一致[45],但在其他植物中如青蒿(Artemisiaannua)AaJAZ5和AaJAZ6基因分别在叶和根中表达量最高,在茎中表达量最低[47],苹果MdJAZ1基因在根中表达量最高[48],这表明SbJAZ1基因的表达具有组织特异性,且不同的JAZ家族成员表达的组织部位不同。有研究报道,白木香(Aguilariasinensis)AsJAZ1基因表达受到茉莉酸甲酯(methyl JA, MeJA)的诱导[46],玉米ZmJAZ14基因的表达受PEG、JA等胁迫的诱导[49],这与本研究中SbJAZ1受到JA和PEG-6000诱导相似。此外,IAA可诱导SbJAZ1基因的表达,这与IAA处理后FmJAZ1基因的表达趋势一致[45]。
4 结论
本研究从高粱中克隆出1个JAZ家族基因SbJAZ1,该基因全长606 bp,编码201个氨基酸;生物信息学分析发现其与玉米ZmJAZ1同源性最高,该基因编码的蛋白质分子量为21.15 kDa,等电点为7.70,具有亲水性;基因表达分析表明,SbJAZ1基因表达具有组织特异性,主要在茎中表达;且SbJAZ1基因表达受到JA、IAA和PEG-6000的诱导;原核表达结果显示,SbJAZ1蛋白可溶性表达的最佳菌株为Rosetta(DE3)、最佳诱导温度和IPTG浓度分别为30℃和0.8 mmol·L-1。

