胚源性IL-1β与人类胚胎发育及种植的关系
朱序理,赵志明,曹金凤,杜元杰,周 亮,王 跃
(河北医科大学第二医院生殖医学科,河北 石家庄 050000)
白细胞介素1β(interleukin-1β,IL-1β)细胞因子,具有多种细胞效应,包括促进生长、抑制生长和参与细胞分化及炎症的发生。早在1996年,一些学者通过免疫组织化学方法证明了胚胎中存在IL-1系统[1],在小鼠体内,用IL-1受体拮抗剂(IL-1 receptor antagonist,IL-1ra)阻断IL-1 I型受体(IL-1 receptor type I, IL-1RtI),可阻断胚胎着床[2],且IL-1β可触发子宫内膜产生IL-8,从而促进内膜造血细胞的增殖和存活[3]。本研究通过检测卵裂期移植胚胎培养液中IL-1β水平,探讨其是否能反映胚胎的生长发育及植入情况,并与胚胎形态学累积评分进行相关性研究,以提供更客观和准确的分子标记物辅助形态学选择胚胎进行移植。
1 资 料 与 方 法
1.1一般资料 选取2017年10—12月在河北医科大学第二医院生殖医学科行卵胞浆内单精子显微注射-胚胎移植(intracytoplasmic sperm injection-embryo transfer,ICSI-ET)手术的新鲜周期不孕患者80例,女方年龄均≤35岁,全部为首次移植,采用单液滴单胚胎培养,取卵受精后第3天移植,首选形态学评估最优质的胚胎移植,且同时移植2枚胚胎,卵裂期培养液为同一批号。
1.2分组 胚胎移植4周后,确认临床妊娠,然后将根据每周期胚胎种植率分为A组43例、B组27例和C组10例,3组种植率分别为0%、50%和100%。
1.3仪器与耗材 培养箱为日本SANYO或美国Thermo CO2培养箱,胚胎培养体系为瑞典Vitrolife公司生产的G5系列培养液,人类IL-1β检测试剂盒(Multisciences,中国杭州联科生物公司生产),胚胎培养皿为美国B.D公司生产。
1.4实验方法
1.4.1标本收集 常规授精(17±1)h后,将受精卵洗涤后分别转移至新配制的卵裂期培养液(vitrolife,G1)培养皿中(培养皿制作,每微滴定量为30 μL,覆盖矿物油,平衡>8 h),观察同时记录受精情况后,在37 ℃,6%CO2单气培养箱内进行培养。受精后第3天,即胚胎在G1培养液中培养(51±1) h后采用倒置显微镜观察,根据胚胎实验室常规形态学标准,即按细胞数、均一度、碎片等挑选2枚形态学观察较好的胚胎进行移植。可利用胚胎转移后及时把培养皿放置常温操作台上,用巴斯德吸管去除液滴周围矿物油后,液滴表面矿物油自由脱落,然后及时吸取移植胚胎的G1培养液滴,装入0.2 mL EP管后混匀,离心(2 500 r/min,5 min)后取上清,编号,置于-80 ℃冷冻保存待测。空白对照组为在相同条件下未放置胚胎的G1培养液。
1.4.2临床妊娠情况确认 在胚胎移植手术后14 d,检测血清人绒毛膜促性腺激素(β-human chorionic gonadotropin,β-HCG)水平,呈阳性的患者可考虑成功植入,移植后4周通过超声见到心血管搏动,确认为临床妊娠,并根据妊娠孕囊数等确认种植数。种植率=种植数/移植胚胎数×100%。
1.4.3检测方法 采用酶联免疫吸附测定法检测IL-1β在胚胎培养液中的水平。首先在酶标微孔板中加入倍比稀释的标准品及IL-1β待测样品,然后,将生物素标记抗体加入每孔中,室温孵育;洗涤后,加入标记亲和素工作液进行孵育;每孔加显色底物避光孵育,后进行终止反应,用酶标仪进行双波长测定,测定各孔在450 nm最大吸收波长下的OD值。最后根据标准品浓度和相应OD值绘制线性回归曲线,通过曲线方程计算试样浓度。
1.4.4记录临床相关参数 详细记录夫妇双方年龄(岁)、不孕年限(年)、体重指数、促性腺激素(gonadotropin,Gn)时间(d)、Gn总量(U)、HCG日血雌二醇(estradiol,E2)水平(ng/L)、内膜厚度(mm)及临床妊娠结局等资料。
1.4.5记录胚胎实验室相关资料 详细记录获卵数、卵胞浆内单精子显微注射(intracytoplasmic sperm injection,ICSI)卵数、双原核(2 pro nucleus,2PN)数、2PN卵裂数、冷冻胚胎数、移植胚胎形态学评分等。
1.4.6移植前胚胎形态学评分标准[4]评分规则:①胚胎细胞数为基础分值,大于8记8分;②碎片分Ⅰ、Ⅱ、Ⅲ、Ⅳ四级,Ⅰ级(0%~5%的碎片)减1分,Ⅱ级(6%~20%的碎片)减2分,Ⅲ级(21%~50%的碎片)减3分,Ⅳ级(>50%的碎片)减4分;③细胞大小相对均匀加0.4分;④胚胎细胞形状正常加0.4分;⑤半融合或融合胚胎加0.4分;⑥胞质没有异常加0.4分;⑦满分为10分。
1.5统计学方法 应用SPSS 26.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验,计数资料比较采用χ2检验,相关性分析采用Person检验。P<0.05为差异有统计学意义。
2 结 果
入组80例患者中临床妊娠37例,临床妊娠率为46.3%,其中单胎妊娠27例,双胎妊娠10例。
2.13组主要相关临床资料比较 3组女方年龄、不孕年限、体重指数、Gn时间、Gn总量、HCG日血E2水平、内膜厚度差异均无统计学意义(P>0.05)。见表1。
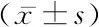
表1 3组临床资料比较
2.23组实验室资料比较 3组获卵数、ICSI卵数、2PN率、2PN卵裂率、可移植胚胎数(移植数+冷冻胚数)、≥8细胞的胚胎数差异均无统计学意义(P>0.05)。见表2。
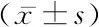
表2 3组实验室资料比较
2.33组胚源性IL-1β水平、胚胎形态学累积评分比较 B组IL-1β水平高于A组,C组IL-1β水平高于A组和B组,差异有统计学意义(P<0.05);3组移植胚胎形态学累积评分差异无统计学意义(P>0.05)。见表3。
2.4胚胎培养液中内源性IL-1β水平与胚胎形态学累积评分的关系 胚胎培养液中IL-1β随胚胎形态学累积评分的升高而增高,2个变量呈正相关(r=0.587,P<0.05)。
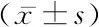
表3 3组IL-1β水平与胚胎形态学累积评分比较
3 讨 论
目前,体外受精是治疗不孕症的主要方法,通过收集卵母细胞在体外与精子受精,受精后的胚胎移植前在小滴培养液中培养,然后根据形态学评估移植2~3个最优质的胚胎。然而,随着体外培养技术的发展,临床妊娠率不断提高,多胎妊娠率也随之增加,而多胎妊娠会增加产科并发症等风险[5-6],因此,目前许多研究在探索施行单胚胎移植的可行性及最优方法[7-9]。2018年,专家一致认为,通过减少胚胎移植数量,将中国体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)的多胎发生率降至20%以下[10]。因此,在保证临床妊娠的同时,选择最优质的胚胎进行移植,减少多胎的发生是各生殖中心面临的挑战。且在辅助生殖过程中有一个主要问题是为什么反复进行体外受精并移植明显质量良好的胚胎而未发生妊娠,这一令人困惑的植入失败是当前研究的一个方向。常规的胚胎形态学评分存在主观因素不能充分反映胚胎的发育潜能。为了进一步鉴定胚胎发育,通过对胚胎培养液中胚源性物质的无创检测来预测胚胎发育及植入潜能将是一种很有效的方法[11-13]。
在胚胎体外培养和植入过程中,多种细胞因子以自分泌和旁分泌的方式被分泌,这些细胞因子与其相应受体结合调控胚胎的增殖与分化,且参与信号传导使胚胎与子宫内膜相互作用,从而影响胚胎移植的临床结局[14-15]。胚胎的发育及着床和肿瘤生长浸润有很大的相似性,目前IL-1系统在肿瘤基础研究中有了更清楚的认识,而且在治疗中得到了应用且日渐成熟[16-18],因此IL-1系统在生殖领域的研究可能有着重要的临床价值。
IL-1β是IL-1系统中最具有生物活性的亚型之一,与生殖活动密切相关[19]。因胚胎植入对于母体属半同种异体移植,以往认为主要处于免疫抑制,但近年研究发现成功的胚胎植入和随后的妊娠进展需要在促炎和抗炎信号之间实现更为复杂的平衡[20]。Kreines等[21]研究发现,在持续妊娠和最后活产的妇女中,IL-1β的血清水平随着时间的推移而升高,但对于随后发生妊娠丢失的患者血清IL-1β水平并没有升高;进行胚胎移植的妇女中发现IL-1β水平与成功妊娠具有正相关;在妊娠试验阳性患者中,如果未检测到血清IL-1β者和后续的妊娠丢失相关。因此,证实了在体外受精周期血清IL-1β与妊娠结局有明显相关性,并可对预后进行预测。胚胎发育和植入的成功是一个相对复杂的事件,涉及到母体与胚胎之间的信号对话。
近年研究表明,在体外受精辅助生殖过程中,胚胎培养液IL-1β水平与妊娠率呈正相关[22-24]。在这些研究中,测定胚胎培养液IL-1β水平时,酶联免疫吸附测定是主要的检测方法;要求样品体积至少为50 μL,这就是要有足够的样品体积;因此来自多个胚胎的所用培养液通常聚集起来用于测量细胞因子,而检测的结果成为多个胚胎的平均值,而不是仅来自单个移植胚胎的培养液。因此,如何在微量的胚胎培养液中可靠地检测细胞因子来预测胚胎发育潜力仍然是一个挑战。
本研究采用单液滴单胚胎培养,微滴定量为30 μL,检测2枚移植胚胎的培养液,能较好地反映移植胚胎的IL-1β水平。入组样本来自行ICSI患者,相对减少了颗粒细胞,精子异源性物质的干扰。在收集过程中,培养皿中的矿物油首先被移除,从而微滴表面矿物油会自由下落,液滴完全暴露出来,并迅速收集,以减少矿物油对结果的影响。根据种植率分为3组,结果显示,3组IL-1β水平有显著差异,胚胎培养液中IL-1β的水平与胚胎形态学累积评分作相关分析,结果表明,IL-1β表达随胚胎评分的升高而增高,2个变量呈正相关,这些共同提示胚胎培养液中胚源性IL-1β与胚胎发育及着床潜能密切相关。然而,由于酶联免疫法检测技术的有限性以及培养液微量的限制,本研究中共有5例未检测到IL-1β,因此探索一种更有效的检测微量IL-1β浓度的方法是一个重要的研究方向。
近年来,在胚胎体外培养过程中,胚胎内源性相关的细胞因子相继被发现,其分泌量能够客观地反映胚胎发育情况[25-27]。通过胚胎培养液中分泌的细胞因子的测定,可全面、客观、准确、无创地反映胚胎的发育植入潜能,比胚胎形态学观察更全面、更准确地预测胚胎移植后的临床结局。传统的形态学只能反映某一时间的胚胎情况,而细胞因子可反映时间段的胚胎情况,更能预测胚胎走势。因此,胚胎培养液中IL-1β水平能反映胚胎的发育潜能,可作为挑选优质胚胎的另一个重要参考指标。测定培养液中IL-1β水平与形态学观察联合应用,将有可能选择出发育潜能最优的胚胎用于移植,为广泛实行单胚胎移植提供技术支持,保证妊娠率的同时降低多胎风险,对辅助生殖临床工作有重要的指导意义。但目前酶联免疫法检测IL-1β时间相对较长,且评估指标的敏感度和特异度需要进一步研究证实,因此,应用于临床相对于形态学评分没有明显优势,但随着检验技术的不断发展,如利用芯片微流控技术测细胞因子方法探索[28],质谱等技术平台的完善,将实现快速准确地检测胚胎培养液中IL-1β等细胞因子浓度,为胚胎评估提供新的参数,辅助形态学观察。

