双氢青蒿素对人胃癌细胞BGC-823细胞增殖、凋亡的影响及机制研究
徐彦楠,孟 丽,朱 艳,闫 静,王彦玲,周晨明*
(1.河北医科大学教学实验中心,河北 石家庄 050017;2.河北医科大学电镜实验中心,河北 石家庄 050017;3.河北医科大学细胞生物教研室,河北 石家庄 050017)
胃癌是世界上常见的消化道恶性肿瘤之一,对人类的健康造成巨大威胁。其发病率和病死率分别位于世界恶性肿瘤第4位和第2位[1]。目前,在临床上主要通过手术切除病灶来治疗癌症改善病情。但是临床症状对于胃癌早期患者来说并不明显,以至于就诊率很低。并且目前在诊疗过程中缺乏诊断胃癌的生物学指标,导致众多出现临床症状的患者在确诊时已是伴有转移的中晚期胃癌[2]。最佳手术治疗时期已经错过,非手术治疗是唯一缓解病情的方式。目前,放疗与化疗已被广泛应用于中晚期肿瘤的非手术治疗中,但在治疗过程中容易出现不良反应,甚至出现器官衰竭。因此,寻找高效低毒的天然药物至关重要。青蒿素是1971年我国科学家在中草药青蒿中分离出的环状倍半萜类化合物,是一种低毒、高效治疗疟疾的天然药物。青蒿素难溶于水,使其疗效不能充分的发挥,因此合成了抗疟效果强于青蒿素且低毒、安全的青蒿素衍生物——双氢青蒿素(dihydroartemisinin,DHA)。有研究表明,DHA对宫颈癌、胰腺癌、肺癌、肝癌、淋巴癌和前列腺癌等肿瘤细胞的生长有明显地抑制作用[3-8],但是否能抑制人胃癌细胞BGC-823细胞及其作用机制的研究尚未报道。因此,本研究旨在探讨DHA抑制人胃癌细胞BGC-823细胞增殖并促凋亡的作用及作用机制,以期为中药抗肿瘤药物的开发提供依据。
1 材 料 与 方 法
1.1实验材料 人胃癌细胞系BGC-823细胞;DHA购自美国Sigma公司;RPMI1640培养基购自美国Gibco公司;噻唑蓝(methylthiazoletetrazolium,MTT)购自美国Pharma Minger公司;兔抗人Bax、Caspase-3、Caspase-8单克隆抗体购自美国Santa Cruz公司;羊抗兔二抗购自康为世纪生物试剂公司;倒置显微镜购自日本奥林巴斯公司;倒置荧光显微镜购自日本奥林巴斯公司;二氧化碳培养箱购自美国Formascientific公司;酶标仪购自美国Bio-Rad公司;电泳仪购自比利时Consort公司;超薄切片机UC7购自德国徕卡公司;流式细胞仪购自美国BD公司;透射电子显微镜H-7500购自日本日立公司。
1.2方法
1.2.1细胞培养 BGC-823细胞在含有10%胎牛血清的RPMI1640培养基中培养,置于CO2培养箱中,每周传代2~3次,维持细胞处于对数生长期。
1.2.2MTT法检测DHA对BGC-823细胞的抑制率 取对数生长的BGC-823细胞,弃培养基,用PBS进行清洗,加入0.25%胰酶进行消化,用培养基调成单细胞悬液,接种到96孔板上,置于培养箱中培养过夜,待贴壁后根据分组加入不同浓度的DHA[0(对照组),0.67,1.34,2.68,5.36,10.72 μmol/L]生长24,48,72 h。定时观察细胞生长情况,每孔加入5 g/L MTT 溶液20 μL/孔,孵育4 h后,弃上清加入150 μL/孔 二甲基亚砜。利用酶标仪以波长490 nm测各孔吸光值(absorbance,A),根据下列公式计算DHA对BGC-823细胞的抑制率:抑制率(%)=(1-实验组A/对照组A)×100%,并将上述计算结果用82798-IC50软件计算出DHA作用的半数抑制浓度(half maximal inhibitory concentration,IC50)。
1.2.3流式细胞术(flow cytometry,FCM)检测凋亡率 实验分组为对照组、1.7 μmol/L组、3.4 μmol/L组、6.8 μmol/L组。在细胞培养瓶中以1×105个/mL的浓度接种5 mL BGC-823细胞,24 h后在对照组加入3 mL培养基,实验组中分别加入3 mL终浓度为1.7、3.4、6.8 μmol/L DHA,之后继续在CO2培养箱中培养48 h,终止培养并收集细胞。细胞经0.04%乙二胺四乙酸消化,离心,收集细胞。用预冷PBS重悬,离心、清洗两次,用体积分数为70%乙醇吹打制成单细胞悬液。上机检测前弃乙醇,用PBS清洗重悬,取单细胞悬液0.1 mL,加入1 mL碘化丙啶染液,将其置于4 ℃冰箱避光继续孵育30 min,以500目铜网过滤,用流式细胞仪进行分析检测凋亡率。
1.2.4DHA对BGC-823细胞凋亡的形态学影响 分组同FCM,每组均做3个复孔,给药方式同FCM,继续培养48 h后离心,弃上清,PBS洗涤,用4%多聚甲醛固定30 min,PBS洗涤,DAPI避光孵育3 min,PBS清洗后置于荧光显微镜下观察、拍照。收集细胞,离心成团,弃上清,加入2.5%戊二醛进行前固定、1%四氧化锇后固定1.5 h、经50%、70%、80%、90%、100%丙酮梯度脱水、Epon812树脂包埋、超薄切片机切50 nm超薄切片、醋酸双氧铀及柠檬酸铅染色各30 min,在透射电子显微镜下检测、拍照。
1.2.5Western blotting检测相关蛋白表达 细胞分组及处理同FCM,继续孵育48 h后,经预冷的PBS洗涤,用裂解液裂解60 min,测定蛋白质浓度。之后进行蛋白电泳和转膜,再进行免疫反应:将膜用5%脱脂奶粉37 ℃封闭2 h,加入兔抗人Bax、Caspase-3、Caspase-8孵育,4 ℃冰箱过夜;TBST洗涤3次后,与辣根过氧化物酶标记的羊抗兔二抗孵育1 h,TBST洗涤3次,滴加发光液,显影并采用凝胶图像系统分析。
1.3统计学方法 应用SPSS13.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1不同浓度DHA对BGC-823细胞的增殖活性的影响 不同浓度DHA作用于BGC-823细胞后,其抑制率随药物浓度的增加而增大,且随着时间的延长而增大,具有显著的剂量和时间依赖性,差异有统计学意义(P<0.05)。见表1。DHA作用的IC50为3.4 μmol/L。

表1 不同浓度DHA对BGC-823细胞的抑制率比较
2.2FCM检测DHA对BGC-823细胞凋亡的影响 随着DHA药物浓度的增加,凋亡峰愈加明显,并呈现出剂量依赖性。差异有统计学意义(P<0.01)。见表2,图1。
2.3DHA对BGC-823细胞凋亡形态学的影响 荧光显微镜观察细胞凋亡的形态特征,对照组呈现淡蓝色荧光,且分布均匀、形态完整;随着DHA浓度的增加,实验组BGC-823细胞表现为细胞核固缩,蓝色荧光增强,部分细胞核呈现颗粒团状染色质或碎裂成许多球形颗粒物质,见图2。透射电子显微镜观察细胞凋亡的形态特征:对照组细胞器丰富,细胞核染色质分布均匀;1.7 μmol/L组细胞轻度固缩,染色质电子密度增加,边集于核膜下;3.4 μmol/L组细胞固缩加重,核膜下染色质边集进一步增厚;6.8 μmol/L组细胞体积明显缩小,胞质高度浓缩,染色质边集更加明显,见图3。
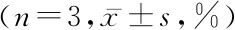
表2 FCM检测不同浓度DHA作用48 h后BGC-823细胞凋亡率比较
2.4DHA对BGC-823细胞凋亡相关蛋白Bax、Caspase-3、Caspase-8的影响 Western blotting结果表明,BGC-823细胞随着DHA用药浓度的增大,Bax、Caspase-3、Caspase-8条带变宽、变深。细胞中Bax、Caspase-3、Caspase-8蛋白表达随着DHA给药浓度的增加而增高,差异有统计学意义(P<0.05)。见表3,图4。

表3 不同浓度DHA及对照组作用48 h后BGC-823细胞Bax 、Caspase-3、Caspase-8蛋白表达
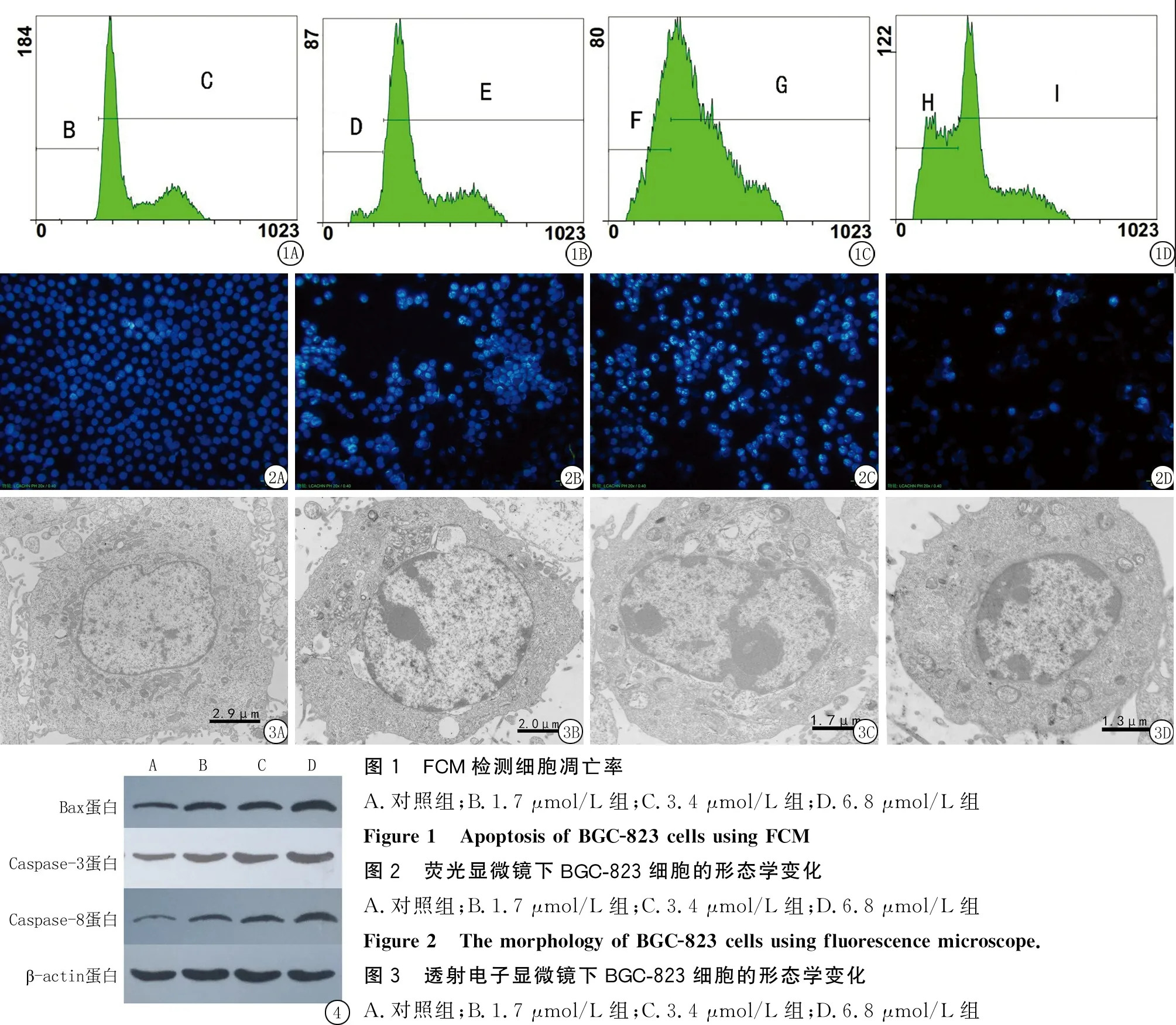
Figure 3 BGC-823 cells morphology using transmission electron microscope
3 讨 论
我国每年新增的胃癌患者约为67.9万,死亡约为49.8万,占全球总人数的45%[9]。虽然近些年,通过改善饮食习惯、降低危险因素等方法,胃癌发病率逐年降低,但仍是常见的恶性肿瘤之一。抑制肿瘤生长是目前临床治疗肿瘤的重要途径。DHA是青蒿素的主要衍生物,对多种组织的人类恶性肿瘤具有明显的细胞毒性作用[3-8]。为了考察DHA抗胃癌的作用和机制,本研究采用人胃癌细胞BGC-823细胞探讨DHA抗胃癌的效果及机制。本实验通过MTT检测DHA对人胃癌细胞BGC-823细胞增殖活性的影响,结果显示DHA对BGC-823细胞增殖的抑制作用明显且具有时间和剂量依赖性。
在MTT检测过程中,通过倒置显微镜可见用药组细胞凋亡现象明显。细胞凋亡是一个高度调控的细胞死亡过程,主要负责清除那些已经高度损坏、被破坏、老化和不可修复的细胞,以维持多细胞生物的正常生理过程。细胞凋亡出现异常可以导致和促进多种疾病如:自身免疫性疾病、神经退行性疾病、心脏病和癌症等的发生[10-12]。因此,涉及细胞凋亡调控的因素对疾病的诊断和干预有着巨大的价值。本实验通过 FCM检测发现随着DHA给药浓度的升高,细胞凋亡率也随之升高,表现为明显浓度依赖性。进一步通过荧光显微镜及透射电子显微镜观察,发现用药组细胞随着给药浓度的升高,细胞凋亡形态的变化更加明显,与FCM结果一致。
Caspases是属于半胱氨酸天冬氨酸蛋白酶的一类蛋白质,在凋亡的过程中发挥着重要的作用[13]。内源性和外源性凋亡都依赖于Caspases家族成员的激活。在细胞凋亡之前,细胞的表面受体会传递一种来自细胞外微环境的死亡信号,“死亡”配体与其受体结合,形成诱导死亡的信号复合体,然后激活Caspase-8,进一步激活Caspase-3,从而引发细胞凋亡[14]。Caspase-8主要位于线粒体,少数位于胞质和胞核中,其介导TNFR1等死亡受体诱导的细胞凋亡,是凋亡途径关键的启动者[15]。Caspase-3是整个凋亡通路的中枢,是Caspase凋亡级联通路的效应体,Caspase-3在启动外部凋亡通路和内部凋亡通路后均被激活,其作为细胞凋亡的执行者,通过特异性地裂解底物最终导致细胞凋亡[16]。Bax 又称成孔蛋白,是Bcl-2家族中经典的促凋亡因子,在调节细胞凋亡中发挥着重要的作用[17]。它可以在线粒体外膜上形成孔,导致线粒体的破坏并使细胞色素C释放增加,与Apaf-1相互作用,导致Caspase-9的激活,引起Caspases 的级联反应,最终导致细胞凋亡[18]。有研究表明,Bax、Caspase-3、Caspases-8基因的激活促进细胞凋亡[19]。本实验通过Western blotting测定Bax、Caspase-3、Caspase-8基因表达,结果显示其表达量用药组高于对照组,提示DHA可以使Bax、Caspase-3、Caspase-8的表达增加,进而诱导细胞凋亡。
由此可见,DHA对BGC-823细胞的增殖具有明显的抑制作用,其诱导凋亡的机制可能是通过上调Bax、Caspase-3、Caspases-8的表达而起作用,但DHA诱导凋亡信号通路的具体分子机制有待进一步研究。

