银基活性炭对废轮胎热解油的吸附脱硫机理研究
江山竹, 王 夺, 尹俊钧, 刘运权, 李水荣, 叶跃元
(厦门大学 能源学院,福建 厦门 361102)
废弃轮胎热裂解制备利用价值较高的液体燃料——热解油[1],已逐渐成为处理废轮胎的主要方法。然而,在轮胎生产的过程中,为了强化轮胎性能不可避免地引入各种含硫添加剂,导致经热裂解工艺生产的热解油中的硫含量偏高[2],极大地限制了热解油的应用,也使脱硫成为了热解油工业应用过程中必不可少的步骤。近些年来,活性炭吸附脱硫以其温和的操作条件、低廉的操作成本及较高的选择性受到研究者们的关注[3]。在众多的研究中,利用包括Cu[4]、Fe[5]、Zn[6]、Ag[7]等金属离子对活性炭进行改性,可使活性炭的吸附脱硫能力得到较大的提高。其中经Ag+改性的活性炭,对热解油的脱硫效果最佳[8]。然而,为何金属离子能够有效提升活性炭的脱硫能力,以及金属离子与有机硫之间发生了怎样的反应,目前仍存在较大的争议。Javier等[9]认为,有机硫分子上带负电的S原子和吸附剂上带正电的金属离子通过π-π相互作用在吸附剂表面直接络合。Huo等[6]认为在活性炭上负载金属离子后,活性炭表面的酸性官能团的数量大大增加,而有机硫可以通过与这些官能团相结合而被吸附在活性炭表面。Saleh等[10]提出有机硫分子利用芳香环的离域π电子与金属离子形成π型配合物从而被吸附在活性炭上。Ania等[11]则认为有机硫在活性炭上的吸附过程还有物理吸附参与其中。但是,目前关于金属离子负载活性炭对于废轮胎热解油吸附脱硫的反应机理方面的研究,仍缺乏详细的实验研究和论证,使人们无法从理论层面上认知为何该类型吸附剂具有较好的脱硫效果。Olajire等[7]指出,在银基活性炭上的多数Ag以Ag+的形式存在,且能够通过配位反应与有机硫化物形成络合物,从而提高改性活性炭对有机硫化物的吸附能力。基于此,本研究采用原位红外、核磁共振氢谱、ICP-OES和元素分析等表征手段,以二苯并噻吩为热解油含硫模型化合物,深入探究了Ag+负载活性炭对于废轮胎热解油吸附脱硫的反应机理,以期为Ag+负载活性炭吸附脱硫的工业应用提供一定的理论指导作用。
1 材料与方法
1.1 材料与试剂
废轮胎由福建厦门的废轮胎回收公司提供,实验之前,轮胎已由提供公司预先粉碎,并且轮胎中的钢丝和纤维网已预先取出。原料工业分析结果为:水分0.77%,灰分8.35%,挥发分61.35%,固定碳29.53%。元素分析结果为:C 73.36%, H 13.87%, O 9.9%, S 2.87%, 低位热值为32.7 MJ/kg。可以看出,废轮胎中的含C量为73.36%,低位热值为32.7 MJ/kg,意味着以废轮胎为原料制备的热解油应具有较好的品质。然而废轮胎中的硫元素达到了2.87%,暗示着对热解油进行脱硫处理必不可少。
硝酸银、二苯并噻吩(DBT)、异丙醇均采购于上海麦克林生化试剂有限公司。
1.2 实验方法
1.2.1热解油的制取 将10 g废轮胎粉在500 ℃的管式炉中进行热解。在热解过程中,以450 mL/min的吹扫速率向装置中吹入氮气来实现惰性氛围。热解产生的气态产物被氮气带出,通过6个放置在-20 ℃ 恒温低温槽中的铝瓶进行收集,收集在瓶中冷凝的液态物质,即热解油,含S 2.8%,密封保存以备后续实验。热解反应结束后,收集反应装置中残留的固体产物,密封保存作为制备活性炭的热解炭。
1.2.2活性炭的制备与改性 根据Acosta等[12]提出的活化方法将热解炭与KOH按照碱炭质量比6 ∶1 直接混合,在750 ℃下活化1 h。活化完成后,将所得活性炭用10%盐酸洗涤至中性,过滤后在110 ℃ 烘箱中干燥12 h。将0.5 g活性炭浸没在浓度为0.4 mol/L的 1 mL硝酸银溶液中,密封静置0.5 h 后在80 ℃烘箱中干燥12 h,在450 ℃下煅烧4 h,得到Ag+改性活性炭,记为 Ag/AC。
1.2.3改性活性炭脱硫 在不同的温度下,将1 mL热解油缓慢滴入含有0.1 g改性活性炭的烧杯中,并用磁力搅拌以500 r/min的速率持续搅拌烧杯中的热解油。充分吸附12 h后,过滤除去热解油中的剩余活性炭,将收集到的油样用元素分析测试其中的硫含量,最后在室温下密封保存,以便后续分析。
1.2.4反应机理研究 原位红外实验中,预先将浓度为0.25 mol/L的40 mL硝酸银溶液加入到250 mL 的三口烧瓶中。将一定量的二苯并噻吩溶解于40 mL 异丙醇中,并通过内径为0.2 mm的不锈钢针头,用BT100-2J(微量泵,中国上海欧豪斯仪器有限公司)以0.1 mmol/min的速率滴加到三口烧瓶中,滴加过程中用电磁搅拌器以450 r/min的速率持续搅拌。待反应结束后,通过旋转蒸发仪除去溶剂,收集剩余固体,用乙醇和去离子水各洗涤3次,在60 ℃下真空干燥12 h,剩余配合物置于干燥器皿中。
1.3 分析和表征
1.3.1GC/MS分析 利用装有RTX-5ms毛细管柱(30 mm×0.25 mm×0.25 μm)的日本岛津GC/MS-QP2010 SE气相色谱-质谱联用仪分析热解油成分。注射样品的体积为1 μL,分流比为20 ∶1。采用氦气作为载气,恒流量为1.2 mL/min,注入压力68.3 kPa,注入温度270 ℃。毛细管柱从50 ℃开始加热,在50 ℃下保持5 min;然后,以4 ℃/min的速率加热至350 ℃。
1.3.2原位红外分析 用Nicolet IS50 FT-IR原位红外追踪整个反应过程。原位红外装配Diamond-ATR HT探头、镜面反射附件(智能ITR)和MCT/A探测器。在实验开始之前,用液氮冷却MCT/A检测器0.5 h。实验中每个光谱添加64个干涉图,采样间隔为28 s,光谱分辨率为8 cm-1。原位红外光谱波数范围为1400~650 cm-1。
1.3.3核磁共振氢谱分析 自旋晶格弛豫时间T1通过Bruker 600 MHz ADVANCE III光谱仪测定,光谱仪配备有一个5 mm的PABBO探针,探针温度为(300±0.1) K。以含有0.1%乙苯的氘代氯仿为校准样品。将0.1 g配合沉淀物溶解于2 mL氘代氯仿中,过滤未溶解的配合沉淀物,然后将过滤后的溶液注入核磁共振管中,制备核磁共振测试样品。
1.3.4元素分析和ICP-OES分析 采用元素分析测定沉淀物中C、H、S等元素的含量,并用电感耦合等离子体原子发射光谱(ICP-OES)法测定所得配合沉淀物中二苯并噻吩与Ag+的物质的量之比。ICP-OES测试样品按以下程序处理:将15 mL 69%硝酸缓慢滴入装有100 mg样品的100 mL烧杯中,将溶液加热至200 ℃,直到产生白色固体;然后将白色固体溶解在装有2.5 mL的37%HCl的烧杯中,并将溶液转移至50 mL容量瓶中;使用30 mL去离子水清洗烧杯,将溶液转移到50 mL 容量瓶中,用去离子水定容。对每个样品进行3次重复试验。
2 结果与讨论
2.1 吸附温度和吸附时间对脱硫效果的影响
为了确定吸附脱硫的最佳工艺条件,首先考察了未改性活性炭对热解油的吸附脱硫效果,如图1所示。由图可见,吸附温度和吸附时间对脱硫效果有明显的影响,随着吸附温度的升高,活性炭的脱硫率呈先增大后减小的趋势,在20 ℃时达到最大值为15.33%,这表明废轮胎活性炭对于有机硫的吸附效果并不十分理想。随着吸附时间的增加,脱硫率也逐渐增加,在吸附时间达到12 h以后,脱硫率的增加变得非常缓慢,故此认为,有机硫在活性炭上达到吸附饱和至少需要12 h。因此,在后续的脱硫实验中,吸附温度和时间分别选择20 ℃和12 h。
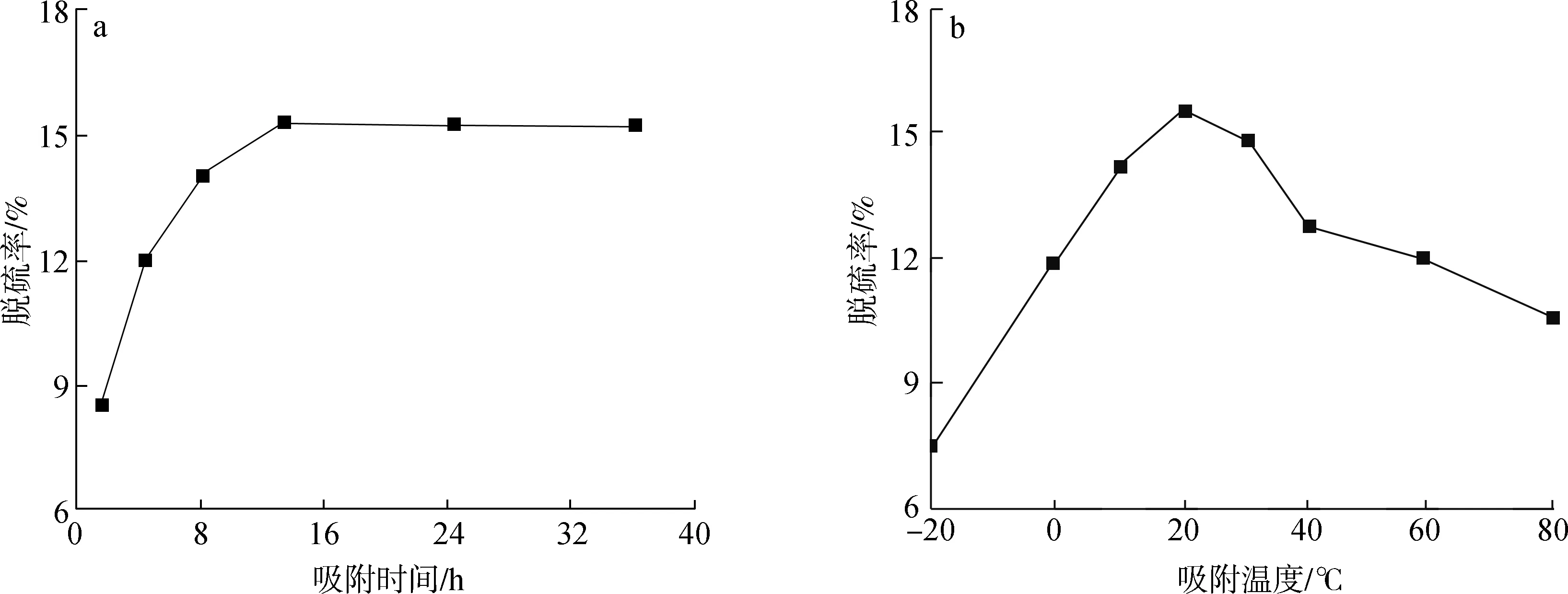
图1 吸附时间(a)和吸附温度(b)对活性炭脱硫能力的影响
在上述优化的操作条件下,考察了Ag/AC的脱硫效果。当活性炭上负载Ag+后,活性炭对于有机硫的吸附能力得到了显著的提升。Ag/AC对于有机硫的吸附能力从15.33%提高到了38.6%,这意味着负载在活性炭表面的Ag+在脱硫过程中极有可能与热解油中的有机硫发生了某种反应,从而使得被吸附在活性炭表面的有机硫增加。因此在后续的机理研究中,将重点考察负载在活性炭表面的Ag+与有机硫化物之间的化学反应。
2.2 热解油中的含硫化合物分析

图2 热解油中有机硫的主要存在形式Fig.2 The main forms of organic sulfur in pyrolysis oil
废轮胎热解油的成分复杂,含有烃类、酮类等上百种化合物[13],本研究重点针对其中的含硫化合物进行测定。通过GC/MS对热解油进行分析(图2),热解油中有机硫主要以噻吩类化合物的形式存在,包括噻吩(1.46%)、2-甲基噻吩(0.58%)、苯并噻吩(1.51%)、二苯并噻吩(2.57%)和4,6-二甲基二苯并噻吩(0.28%)等。在有机硫中二苯并噻吩的含量要明显高于其他几种噻吩硫,这表明二苯并噻吩在所收集到的热解油中占有机硫的主要部分。故在后续的反应机理研究中选择以二苯并噻吩为热解油中有机硫的模型化合物。
2.3 以二苯并噻吩为模型化合物的反应机理分析
2.3.1原位红外分析 在反应机理实验中,利用了原位红外来实时监测溶液中二苯并噻吩红外峰的变化,进而判断二苯并噻吩与Ag+的配位反应情况。如图3(a)所示,随着向Ag+溶液中不断滴加二苯并噻吩溶液,各个红外峰的峰强不断增加。整个过程中,所有红外峰均呈线性变化,并未在反应过程中出现明显的平台。如果溶液中发生了离子反应,则发生离子反应的官能团的红外峰强度在最初的一段时间内应为0,当离子反应结束后,该红外峰强度开始随着二苯并噻吩添加量的增加而逐渐增强。但是在图3(a)中并没有观察到类似的现象,因此溶液中没有发生离子反应,两者之间发生的应为配位反应。
图3(b)为Ag+存在条件下,二苯并噻吩红外峰的变化。从图3(b)可以看到,当溶液中有Ag+存在时,二苯并噻吩的红外峰发生了一定程度的蓝移或者红移,表明在溶液中Ag+与二苯并噻吩之间发生了反应[14]。由图3(b)可知,749.4 cm-1处红外峰为二苯并噻吩分子上S原子振动[15],当溶液中存在Ag+时,749.4 cm-1处的红外峰红移至743.3 cm-1处,并且与739.6 cm-1处的峰发生了融合,表明在二苯并噻吩与Ag+的相互作用中S原子是一个反应位点[7]。1200~1260 cm-1处红外峰为二苯并噻吩中苯环伸缩振动,当有Ag+存在时1200~1260 cm-1之间的2个峰出现了偏移并且融合成1230.4 cm-1处一个峰,这是由于苯环与Ag+通过π配位相互作用以后,苯环上的电子云密度发生改变所导致的[14]。这表明二苯并噻吩中的苯环或苯环上的碳原子可能也是一个反应位点。

图3 Ag+与二苯并噻吩反应过程的原位红外图谱

图4 二苯并噻吩(a)与配合物(b)的核磁共振氢谱Fig.4 1H NMR spectra of dibenzothiophene (a) and the complexes (b)
2.3.2核磁共振氢谱分析 为了进一步探究二苯并噻吩上的反应位点,利用核磁共振氢谱对实验得到的固体配合物进行检测。图4为固体配合物和二苯并噻吩标准物的核磁共振氢谱。图中3个峰分别属于H1,H4,H2和H3。可以看出,在配合物的核磁共振氢谱中H1,H2,H3和H4的峰合成了一个大峰。4个氢原子的核磁共振氢谱均发生了显著的变化,这表明二苯并噻吩的反应位点应是苯环而不是苯环上的某一个碳原子[16]。结合红外图谱分析,可以认定二苯并噻吩上的苯环是配位反应中的一个反应位点。
2.3.3ICP-OES分析 为了确定Ag+与二苯并噻吩反应中的配位数,利用ICP-OES和元素分析对实验中得到的固体配合物进行了分析,结果见表1。
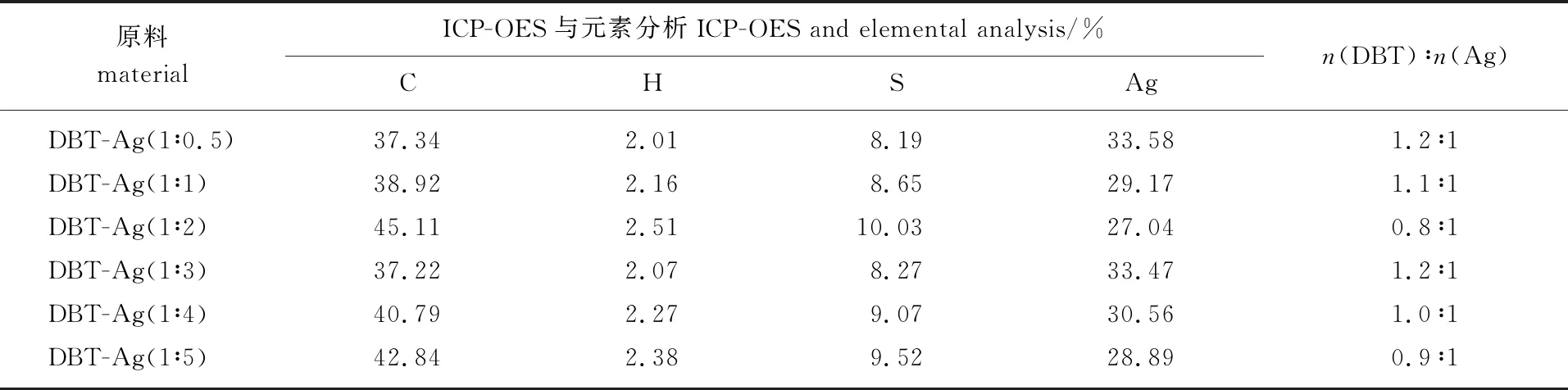
表1 配合物中Ag+的含量及n(DBT) ∶n(Ag)Table 1 Silver content and the molar ratio of DBT to Ag in complexes
由表1可以看出,随着原料中二苯并噻吩与Ag+物质的量之比的变化,固体配合物中二苯并噻吩与Ag+的物质的量之比始终在1左右波动,这表明在该配位反应中一个二苯并噻吩分子只与一个Ag+发生了反应。但是由之前的分析可知,在二苯并噻吩分子上存在2个反应位点,即S原子与苯环,并且由红外图谱分析可知,这2个位点均参与了反应。故此推测,反应过程中发生了2种配位反应,并且在溶液中生成了2种配合物(图5),分子式分别为Ag(DS)NO3和Ag(DC6H6)NO3(DS:在S原子处发生配位反应的二苯并噻吩;DC6H6:在苯环上发生配位反应的二苯并噻吩)。发生这种情况的原因可能是:当二苯并噻吩分子上结合了一个Ag+以后,导致其空间位阻增大[17],使得第二个Ag+难以通过弱相互作用继续与二苯并噻吩结合。
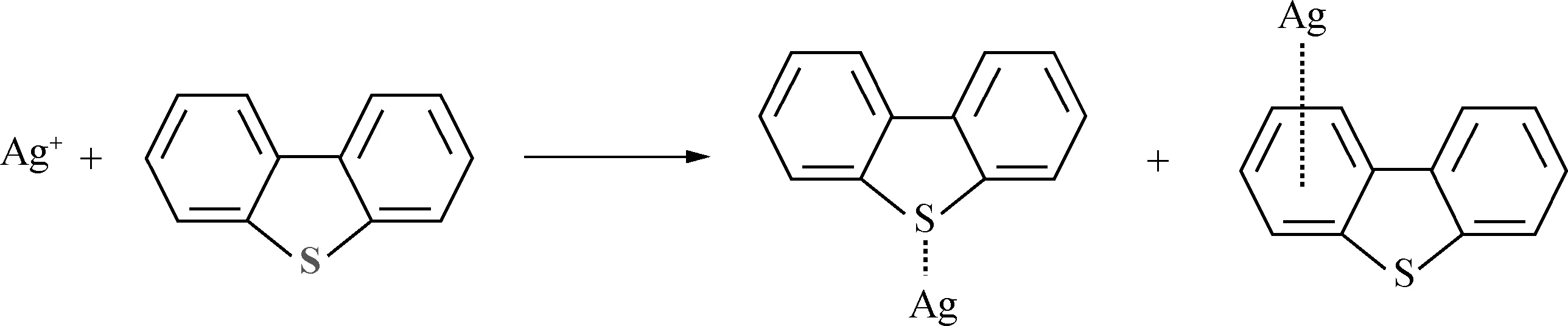
图5 Ag+与二苯并噻吩反应机理
3 结 论
3.1以废轮胎为原料经热解得到生物油和热解炭,热解炭活化、改性得到Ag+改性活性炭(Ag/AC),并将Ag/AC用于热解油的吸附脱硫实验。结果表明:在脱硫温度和脱硫时间分别为20 ℃和12 h时,活性炭脱硫效果达到最佳;未改性活性炭对热解油的脱硫效果较差,脱硫率仅为15.33%;在活性炭上负载Ag+后,脱硫率提高到了38.6%。
3.2GC/MS分析发现:热解油中有机硫的主要存在形式为噻吩、2-甲基噻吩、苯并噻吩、二苯并噻吩和4,6-二甲基二苯并噻吩,其中二苯并噻吩的GC含量最高,为2.57%。
3.3以二苯并噻吩为生物油模型化合物,探究了Ag+与二苯并噻吩在溶液中的反应机理,结果发现:Ag+与二苯并噻吩在溶液中发生了配位反应,即通过化学吸附的方式提高了改性活性炭的脱硫能力;Ag+与二苯并噻吩在溶液中会发生配位数为1的配位反应,配位点为二苯并噻吩分子上的S原子与苯环;反应过程中会生成2种配合物,分子式分别为Ag(DS)NO3和Ag(DC6H6)NO3。

