环孢素A导致牙龈增生患者治疗前后龈沟液TH1/TH2/TH17细胞因子变化研究
柳惠荣
[摘要] 目的 研究環孢素A导致牙龈增生(CIGH)患者治疗前后龈沟液(GCF)TH1/TH2/TH17细胞因子浓度变化及其意义。 方法 选取2014年7月~2019年11月就诊于我院口腔科门诊的21例CIGH患者,同期19名健康志愿者作为对照。记录健康志愿组及CIGH组治疗前后牙龈增生指数,收集龈沟液,采用流式微球技术(CBA)应用流式细胞仪测定健康志愿组及CIGH组辛伐他汀凝胶治疗3个月前后龈沟液TH1/TH2/TH17细胞因子浓度。 结果 辛伐他汀凝胶治疗总有效率为76.2%。治疗前CIGH组龈沟液中IL-6和TNF-α浓度与健康志愿组比较,差异有统计学意义(P<0.05),而IL-2、IL-4、IL-10、IL-17A和 IFN-γ 5种细胞因子浓度与健康志愿组比较,差异无统计学意义(P>0.05)。7种细胞因子浓度在CIGH患者1级增生组与2级增生组比较,差异无统计学意义(P>0.05)。辛伐他汀凝胶治疗前,有效组和无效组龈沟液中IL-6和TNF-α浓度与健康志愿组比较,差异有统计学意义(P<0.05),而IL-2、IL-4、IL-10、IL-17A和IFN-γ 5种细胞因子浓度与健康志愿组比较,差异无统计学意义(P>0.05);有效组与无效组龈沟液中7种细胞因子浓度比较,差异无统计学意义(P>0.05)。有效组龈沟液中IL-6和TNF-α浓度治疗前后比较,差异有统计学意义(P<0.05),与健康志愿组比较,差异无统计学意义(P>0.05);无效组龈沟液中IL-6和TNF-α浓度治疗前后比较,差异无统计学意义(P>0.05),治疗后与健康志愿组比较,差异有统计学意义(P<0.05);IL-2、IL-4、IL-10、IL-17A和IFN-γ 5种细胞因子浓度两组治疗前后比较,差异无统计学意义(P>0.05)。 结论 龈沟液中IL-6和TNF-α增高是促进CIGH发生的部分原因,局部给予辛伐他汀治疗可以降低龈沟液IL-6和TNF-α浓度,改善患者牙龈增生状况。
[关键词] 牙龈增生;环孢素A;TH1/TH2/TH17细胞因子;流式微球技术;龈沟液
[中图分类号] R781.42;R780.2 [文献标识码] A [文章编号] 1673-9701(2020)27-0005-05
[Abstract] Objective To study the changes and significance of TH1/TH2/TH17 cytokine concentration in gingival crevicular fluid (GCF) of patients with cyclosporin A-induced gingival hyperplasia(CIGH) before and after treatment. Methods A total of twenty-one patients with CIGH who were treated in the outpatient of the department of stomatology in our hospital from July 2014 to November 2019 were selected. Nineteen healthy volunteers were selected as the control in the same period. The gingival hyperplasia index of healthy volunteers and CIGH group before and after treatment was recorded. The gingival crevicular fluid was collected. The cytometric bead array(CBA) was used to measure 3 simvastatin gel treatments of healthy volunteer group and CIGH group using flow cytometry The concentration of TH1/TH2/TH17 cytokines in gingival crevicular fluid around month. Flow cytometric bead array(CBA) was used to measure the TH1/TH2/TH17 cytokine concentration in gingival crevicular fluid before and after 3 months of simvastatin gel treatment in healthy volunteer group and CIGH group. Results The total effective rate of simvastatin gel treatment was 76.2%. The concentration of IL-6 and TNF-α in the gingival crevicular fluid of the CIGH group before the treatment were significantly differentces from those of the healthy volunteer group(P<0.05). While there were no statistically significant differences in the concentration of IL-2, IL-4, IL-10, IL-17A and IFN-γ between the CIGH group and the healthy volunteer group(P>0.05). There was no significant difference in the concentration of 7 cytokines between grade 1 hyperplasia group and grade 2 hyperplasia group in CIGH patients(P>0.05). Before simvastatin gel treatment, the concentration of IL-6 and TNF-α in the gingival crevicular fluid of the effective group and the ineffective group were statistically differentces from those of the healthy volunteer group(P<0.05), while IL-2 and IL-4, IL-10, IL-17A and IFN-γ concentrations were not statistically differentces from those of the healthy volunteer group(P>0.05). The difference was not statistically significant in 7 cytokine concentrations in gingival crevicular fluid between the effective group and the ineffective group(P>0.05). After treatment, the differences in the concentration of IL-6 and TNF-α in gingival crevicular fluid of the effective group before and after treatment were statistically significant(P<0.05). And the difference was not statistically significant compared with the healthy volunteer group(P>0.05). The IL-6 and TNF-α concentrations in the gingival crevicular fluid of the non-effective group had no statistically significant differences before and after treatment(P>0.05). There was a statistically significant difference after treatment of the non-effective group compared with the healthy volunteer group(P<0.05). IL-2, IL-4, IL-10, IL-17A and IFN-γ concentrations of 5 cytokines before and after treatment had no significant differences between the two groups(P>0.05). Conclusion The increase of IL-6 and TNF-α in gingival crevicular fluid is part of the reason for promoting the occurrence of CIGH. Local administration of simvastatin can reduce the concentration of IL-6 and TNF-α in gingival crevicular fluid and improve the gingival hyperplasia of patients.
[Key words] Gingival hyperplasia; Cyclosporin A; TH1/TH2/TH17 cytokines; Cytometric bead array; Gingival crevicular fluid
药物性牙龈增生是指服用某些药物为主要因素而诱发的牙龈体积增大,出现乳头状和牙龈缘增厚病变形成小叶,牙龈坚韧,呈分叶状覆盖牙面。在组织学特征方面主要为上皮细胞和固有层成纤维细胞增多、细胞外基质和胶原纤维成分增多,并伴有不同程度的炎症浸润[1]。环孢素A是临床上应用广泛的一种免疫抑制剂,导致牙龈增生是其常见的不良反应,发病机制不明,影响患者的生活质量,目前尚无有效的治疗措施,因此对其发病机制的研究逐渐增多。细胞因子是由免疫细胞(如T细胞、B细胞、单核巨噬细胞、NK细胞等)和某些非免疫细胞(内皮细胞、表皮细胞、纤维母细胞等)经刺激而合成、分泌的一类具有广泛生物学活性的小分子蛋白质。细胞因子在牙龈增生的发病过程中起一定作用[2-3]。本研究应用流式微球技术(Cytometric bead array,CBA)即微量样本多指标流式蛋白定量技术,采用流式细胞仪测定环孢素A导致的牙龈增生(Cyclosporin A-induced gingival hyperplasia,CIGH)患者龈沟液(Gingival crevicular fluid,GCF)中TH1/TH2/TH17细胞因子(包括IL-2、IL-4、IL-6、IL-10、IL-17A、TNF-α和 IFN-γ共7种)浓度,探讨治疗前后细胞因子浓度的变化趋势,有利于更深入了解CIGH的发病机制。
1 资料与方法
1.1一般资料
选取2014年7月~2019年11月就诊于我院口腔科门诊的由环孢素A导致牙龈增生患者21例,男12例,女9例,中位年龄34(14~61)岁;以同期我院健康志愿者19名作为健康志愿组,男11例,女8例,中位年龄35(14~62)岁。所有研究对象均签署知情同意书。健康志愿者牙周组织健康,牙龈颜色正常,无红肿出血,牙槽骨无吸收。纳入标准:服用环孢素A持续时间1个月以上,近3个月内未服用过任何抗生素。排除标准:牙周膜来源的肿瘤;牙槽骨增生引起的牙龈假性增生;其他原因导致的牙龈增生,如遗传性牙龈纤维瘤病等。患者服用环孢素A的基础疾病为慢性血液系统疾病,包括慢性再生障碍性贫血、免疫性血小板减少症、阵发性睡眠性血红蛋白尿、自身免疫性溶血性贫血。
1.2 方法
1.2.1 主要试剂和仪器 双激光四色FACSCalibur流式细胞仪(Becton,Dickinson and Company公司,美国),TH1/TH2/TH17细胞因子检测试剂盒(江西诺德医疗器械有限公司,中国),AE 240 电子天平(梅特勒-托利多国际贸易上海有限公司,中国),Whatman-3MM层析滤纸(北京优尼康生物科技有限公司,中国)。
1.2.2 临床检查 检查口腔牙龈的颜色形态质地、牙龈增生指数(Gingival hyperplasia index,GHI)。GHI分级标准参考文献[4]。0级:无牙龈增生,附着龈紧贴牙槽骨,龈表面可呈小的点坑状,无或有轻微的肉芽颗粒,龈乳头的龈端呈刃状,牙龈的密度和体积无增加;1级:牙龈增生早期,表现为牙龈密度增加,龈表面有明显的颗粒和肉芽,探诊深度≤3 mm,龈乳头圆钝;2级:中度牙龈增生,龈乳头增大和(或)龈缘翻卷,探诊深度≤6 mm,从肥大牙龈的顶端外侧测量,颊舌向厚度达2 mm,齦缘的外形线为凹形或较平直,龈乳头在一定程度上可从牙面掀开;3级:牙龈增生显著,覆盖部分临床牙冠,探诊深度>6 mm,从肥大牙龈的顶端外侧测量,颊舌向厚度达3 mm,龈缘的外形线为凸形而不是凹形,龈乳头可从牙面掀开;4级:重度牙龈增生,表现为牙龈厚度明显增加,大部分临床牙冠被覆盖,其余数值同3级,龈乳头可从牙面掀开,探诊深度>6 mm,龈颊舌向厚度达3 mm。
1.2.3 牙龈增生患者治疗 对患者进行口腔健康知识宣教,教授患者正确的口腔健康行为等。局部给予辛伐他汀凝胶每日1次,3个月后评价疗效。辛伐他汀凝胶制备方法:84 mg辛伐他汀加入2 mL蒸馏水中搅拌均匀后为溶液A,105 mg甲基纤维素加入5 mL蒸馏水中在50℃~60℃搅拌,为溶液B,在制备溶液B过程中加入溶液A,形成均匀凝胶后0.1 mL辛伐他汀凝胶含有1.2 mg辛伐他汀。使用时将0.1 mL辛伐他汀凝胶注入牙周袋内,嘱患者勿食坚硬食物。
1.3 疗效评价标准
参考文献[4],GHI由高向低转变为有效,无变化或向高转变为无效。
1.4 龈沟液收集
将Whatman-3MM层析滤纸剪裁为6个10 mm×2 mm的滤纸条,每4条放入一个Eppendorf(Ep)管中,编号后用AE 240电子天平称重后备用。采集牙龈增生最严重的受试牙的龈沟液,在唇舌侧近远中轴角处将滤纸条轻轻插入龈沟内,至稍遇阻力,放置30 s后取出,如有血迹和唾液污染则弃之不用,重新取样,放回原Ep管中封存,即刻称重,用取液后Ep管的质量减去取液前Ep管的质量,按浓度(约1 g/L)换算成体积,即可得到龈沟液的体积数。Ep管于-20℃保存。
1.5 TH1/TH2/TH17细胞因子浓度检测
样本测试前解冻样本,按所得差值用去离子水稀释10倍后,以2400 g离心20 min,取上清液备测。应用CBA技术,采用流式细胞仪测定健康志愿者及CIGH患者治疗前后龈沟液TH1/TH2/TH17细胞因子浓度,按照试剂盒操作说明书进行操作。每个样本管中加入25 μL捕获微球混合液200 g离心5 min,吸去上清,加入等体积的微球缓冲液,混匀后室温避光30 min,加入待测样本和荧光检测试剂各25 μL,充分混匀后室温避光孵育2.5 h。之后加入1 mL PBS溶液,200 g离心5 min,吸去上清,再加入0.3 mL PBS溶液上机检测。流式细胞仪上应用CELLQuest 软件进行数据获取,CBA分析软件分析数据。
1.6 统计学处理
应用SPSS22.0统计学软件对实验数据进行统计分析,采用正态检验分析所有数据分布情况,符合正态分布的计量资料以均数±标准差(x±s)表示,采用One-way ANOVA单因素方差分析比较各组指标间的差异,组间两两比较采用Scheffe差别检验法。P<0.05为差异有统计学意义。
2 结果
2.1 辛伐他汀凝胶治疗CIGH患者效果
在使用环孢素A的74例慢性血液系统疾病患者中,21例患者出现牙龈增生,发生率为28.4%。使用环孢素A至出现牙龈增生为时间为2~7个月,就诊时牙龈增生程度1级9例,2级12例。辛伐他汀凝胶治疗后1级有效者7例,2级有效者9例,总有效率为76.2%。
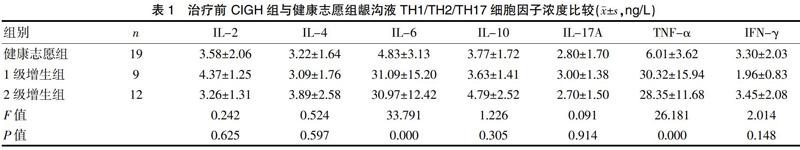
2.2 治疗前CIGH组与健康志愿组龈沟液TH1/TH2/TH17细胞因子浓度比较
与健康志愿组相比,治疗前CIGH组龈沟液中IL-6和TNF-α浓度差异有统计学意义(P<0.05);与健康志愿组相比,IL-2、IL-4、IL-10、IL-17A和 IFN-γ 5種细胞因子浓度差异无统计学意义(P>0.05)。7种细胞因子浓度在牙龈增生患者1级增生组与2级增生组相比,差异无统计学意义(P>0.05),见表1。
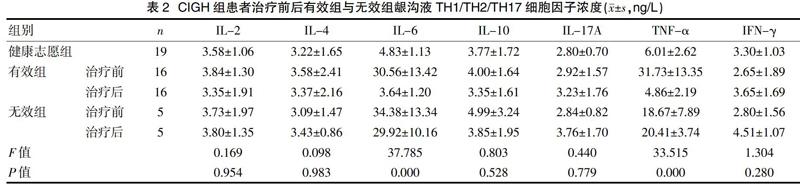
2.3 CIGH患者治疗前后有效组与无效组龈沟液TH1/TH2/TH17细胞因子浓度比较
7种细胞因子浓度在牙龈增生患者1级增生组与2级增生组相比,差异无统计学意义,两组合并后比较治疗前后数据。辛伐他汀凝胶治疗前,有效组与无效组龈沟液中IL-6和TNF-α浓度与健康志愿组相比,差异有统计学意义(P<0.05),而IL-2、IL-4、IL-10、IL-17A和IFN-γ 5种细胞因子浓度与健康志愿组相比,差异无统计学意义(P>0.05)。有效组与无效组龈沟液中7种细胞因子浓度相比,差异无统计学意义(P>0.05)。治疗后,有效组龈沟液中IL-6和TNF-α浓度与治疗前比较,差异有统计学意义(P<0.05),与健康志愿组相比,差异无统计学意义(P>0.05);无效组龈沟液中IL-6和TNF-α浓度治疗前后相比,差异无统计学意义(P>0.05),治疗后与健康志愿组相比,差异有统计学意义(P<0.05);IL-2、IL-4、IL-10、IL-17A和IFN-γ 5种细胞因子浓度两组治疗前后相比,差异无统计学意义(P>0.05),见表2。
3 讨论
环孢素A是常用的免疫抑制剂,其导致牙龈增生的发生率可达33.3%,可能与遗传易感性、牙龈炎症、药物代谢及牙龈胶原合成降解不平衡等有关,牙龈增生后容易出血、影响美观,严重者影响咀嚼功能,降低患者生活质量,研究牙龈增生的发病机制有助于开展针对性治疗[5]。动物模型研究发现,环孢素A增加牙龈成纤维细胞表达抗凋亡基因Bcl-2,表达内质网应激标志物如CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)和线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP),发挥抗凋亡作用,促进牙龈增生[6]。将Wistar大鼠分为环孢素组、结扎组、环孢素+结扎组处理,60 d后测定增生组织增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)表达情况,环孢素+结扎组PCNA表达最高,表明牙龈炎症也促进环孢素A诱导的牙龈增生[7]。体外培养原代牙龈成纤维细胞,加入浓度为1 mg/mL的环孢素A 16 h,测定细胞外基质与黏附分子途径相关的57个基因表达情况,编码细胞黏附蛋白E-cadherin的基因CDH1表达上调,而几乎所有细胞外基质金属蛋白酶(MMP8、MMP11、MMP15、MMP16、MMP24、MMP26)表达下调,表明环孢素A通过抑制金属蛋白酶分泌,导致牙龈结缔组织的细胞外基质成分积聚而致牙龈增生[8]。对药物(环孢素A、苯妥英钠和硝苯地平)诱导的牙龈增生患者的增生组织进行免疫组化染色,结缔组织生长因子(Connective tissue growth factor,CTGF)表达增高[9]。细胞因子变化在牙龈增生过程中发挥一定作用,环孢素A可通过介导牙龈成纤维细胞的细胞周期蛋白B1表达导致细胞过度生长诱发牙龈增生[10]。对体外培养的牙龈成纤维细胞在受到环孢素A刺激后产生IL-6,并促进IL-6生成,与环孢素A存在浓度和时间相关性[2]。在肾移植后使用环孢素A治疗的患者中,牙龈增生组龈沟液IL-6 及其家族成员抑瘤素M(Oncostatin M)浓度增高,与牙龈局部炎症程度不相关,推测IL-6家族成员在牙龈增生过程中发挥一定作用[3]。快速进展性牙周炎患者龈沟液中TNF-α水平增高,与炎症浸润广泛,袋上皮的增生与溃疡显著相关。TNF-α 促进成纤维细胞增殖,环孢素A与TNF-α 有协同作用。
本研究结果显示,在血液系统疾病使用环孢素A的74例患者中,21例患者出现牙龈增生,发生率为28.4%。患者就诊时牙龈增生程度主要为1级、2级,牙龈增生程度较轻可能与患者依从性较好,能够按照医嘱每1~2个月随访有关,能够及时发现环孢素A相关不良反应。牙龈增生及治疗后消退是一个相对较慢的过程,参考其他研究治疗时间,定为3个月,总有效率达到76.2%,取得一定治疗效果。CBA技术是一个基于流式细胞检测系统的多重蛋白定量检测方法,是能够同时对单个样品中的多个指标进行检测的新型分析技术。与ELISA法测定细胞因子相比,具有高通量、高特异性、高灵敏性、操作简便、低成本、重复性好、检测时间短等优势,成为一种新的细胞因子检测方法,越来越多的应用于各个领域。本研究应用CBA技术同时测定7种细胞因子,发现就诊时CIGH组龈沟液中IL-6和TNF-α浓度增高,且1级增生组与2级增生组之间相比,差异无统计学意义,而IL-2、IL-4、IL-10、IL-17A和 IFN-γ 5种细胞因子浓度与健康志愿组相比,差异无统计学意义。对1级增生组与2级增生组数据合并后进行分析,治疗前有效组和无效组龈沟液中IL-6和TNF-α浓度较健康志愿组明显增高,而有效组与无效组龈沟液中7种细胞因子浓度相比,差异无统计学意义,给予辛伐他汀凝胶治疗3个月后,有效组龈沟液中IL-6和TNF-α浓度可以降至正常水平,而无效组龈沟液中IL-6和TNF-α浓度治疗前后变化不明显,仍高于正常。IL-2、IL-4、IL-10、IL-17A和IFN-γ 5种细胞因子浓度治疗前后无明显变化,推测龈沟液中IL-6和TNF-α浓度增高在CIGH发生早期发挥一定促进作用。
目前包括環孢素A在内的药物性牙龈增生仍缺乏有效的治疗手段,一般为菌斑控制、去除局部刺激因素及切除手术等,可以取得一定的治疗效果[11]。停用环孢素A可以有效减轻牙龈增生,但本研究患者使用环孢素A的基础疾病主要为慢性血液系统疾病,使用环孢素A常常是治疗这类疾病的有效措施,因牙龈增生而停药或减少剂量的方法不可行。另外,患者往往出现血小板计数明显减少,各种操作后出血危险性增加,不适合采用牙周治疗及切除手术,对这一类患者需探索其他治疗手段。在小鼠动物模型中,阿奇霉素和甲硝唑能够抑制环孢素A诱导的牙龈增生[12]。近期一项荟萃分析表明,在环孢素A诱导的牙龈增生患者中,使用阿奇霉素有助于抑制环孢素A诱导的牙龈增生[13]。但由于阿奇霉素和甲硝唑与环孢素A存在药物相互作用,可以导致环孢素A浓度增高[14],增加肝肾功能损害等严重不良反应的可能性,不利于调整环孢素A用量,因此这一部分患者临床应用阿奇霉素存在一定的风险。在2型糖尿病合并慢性牙周炎的患者中,龈沟液IL-6、TNF-α和内脂素浓度增高,给予口服辛伐他汀治疗可以降低这些细胞因子浓度,减轻牙周炎症状[15]。而局部使用辛伐他汀凝胶同样可以降低龈沟液中IL-6和IL-8浓度,减轻慢性牙周炎患者的炎症反应[5]。由于在慢性血液系统疾病患者使用环孢素A的同时,往往还加用其他药物如达那唑等,考虑到辛伐他汀的血液系统药物不良反应,以及与其他药物的相互作用,采用局部给药方式以减少药物剂量,有利于减少不良反应,推测其作用机制可能是降低龈沟液中的IL-6和TNF-α浓度。鉴于环孢素A导致的牙龈增生发病机制复杂,需要进一步研究,如最新CBA方法可同时测定12种细胞因子(包括TH1/TH2/TH17细胞因子和单核巨噬细胞分泌的细胞因子),探讨其他细胞因子在发病过程中所起的作用;辛伐他汀凝胶局部给药的其他作用机制也需要进一步探讨。对于辛伐他汀治疗无效者需要探索其他的治疗方法,包括调整辛伐他汀凝胶浓度、延长用药时间、联合用药、试用中药等。康复新液的主要成分是美洲大蠊提取物,具有通利血脉,养阴生肌的功效。一项研究表明,固定矫治中的牙龈炎患者龈沟液的IL-6和TNF-α浓度增高,局部给予康复新液治疗后,IL-6和TNF-α浓度降低,牙龈炎好转[16],但是其对于包括环孢素A在内的药物性牙龈增生的治疗效果有待于深入研究。本研究患者牙龈增生程度较轻,对于3级和4级患者来说,这些细胞因子的变化如何,辛伐他汀凝胶局部给药疗效如何,均需要进一步研究。
[参考文献]
[1] Hatahira H,Abe J,Hane Y,et al. Drug-induced gingival hyperplasia:A retrospective study using spontaneous reporting system databases[J]. J Pharm Health Care Sci,2017,3:19.
[2] 施元洁,尹元正,李俐俐,等. 环孢素A引发牙龈过度生长过程中IL-6的表达[J]. 上海口腔医学,2011,20(3):251-255.
[3] Gürkan A,Becerik S,ztürk V,et al. Interleukin-6 family of cytokines in crevicular fluid of renal transplant recipients with and without cyclosporine A-induced gingival overgrowth[J]. J Periodontol,2015,86(9):1069-1077.
[4] 孟焕新. 中国牙周病防治指南[M]. 北京:人民卫生出版社,2014:14-22.
[5] Grover HS,Kapoor S,Singh A. Effect of topical simvastatin(1.2 mg) on gingival crevicular fluid interleukin-6,interleukin-8 and interleukin-10 levels in chronic periodontitis-A clinicobiochemical study[J]. J Oral Biol Craniofac Res,2016,6(2):85-92.
[6] Rao SR,Sundararajan S,Subbarayan R,et al. Cyclosporine-A induces endoplasmic reticulum stress and influences pro-apoptotic factors in human gingival fibroblasts[J]. Mol Cell Biochem,2017,429(1-2):179-185.
[7] Ricardo LH,do Prado RF,Carvalho YR,et al. Cyclosporine A-Induced gingival overgrowth and proliferating cell nuclear antigen expression in experimental periodontitis[J]. J Oral Biol Craniofac Res,2019,9(1):86-90.
[8] Lauritano D,Palmieri A,Lucchese A,et al. Role of cyclosporine in gingival hyperplasia: An invitro study on gingival fibroblasts[J]. Int J Mol Sci,2020,21(2):595.
[9] Anand AJ,Gopalakrishnan S,Karthikeyan R,et al. Immunohistochemical analysis of the role connective tissue growth factor in drug-induced gingival overgrowth in response to phenytoin,cyclosporine,and nifedipine[J]. J Int Soc Prev Community Dent,2018,8(1):12-20.
[10] Wei Y,Guo XC,Zhou Y,et al. Effect of cyclosporin A and tumor necrosis factor-α on cell proliferation of cultured human gingival fibroblasts[J].Chin J Stomatol,2012, 47(1):38-42.
[11] Rapone B,Ferrara E,Santacroce L,et al. Periodontal microbiological status influences the occurrence of cyclo-sporine-A and tacrolimus-induced gingival overgrowth[J]. Antibiotics (Basel),2019,8(3): pii:E124.
[12] Elkabir MA,El-Zehery RR,Mourad MI,et al. Efficacy of azithromycin and metronidazole combined therapy on rats' gingival overgrowth induced by cyclosporine-A:An experimental animal study[J]. J Oral Biol Craniofac Res,2016,6(3):219-226.
[13] Fuchs MD,Signer-Buset SL,Mendes S, et al. Does systemically administered azithromycin have an effect on gingival overgrowth?A systematic review[J]. Oral Surg Oral Med Oral Pathol Oral Radiol,2019,128(6):606-614.
[14] 胡宁宁,张翠欣,韩旭. 环孢素A药物相互作用及临床应用[J]. 河北醫药,2016,38(9):1405-1408.
[15] Bahammam MA, Attia MS. Effects of systemic simvastatin on the concentrations of visfatin, tumor necrosis factor-α,and Interleukin-6 in gingival crevicular fluid in patients with type 2 diabetes and chronic periodontitis[J].J Immunol Res,2018:8481735.
[16] Liu Y,Mu F,Liu L,et al. Effects of Kangfuxin solution on IL-1β, IL-6, IL-17 and TNF-α in gingival crevicular fluid in patients with fixed orthodontic gingivitis[J]. Exp Ther Med, 2018,16(1):300-304.
(收稿日期:2020-06-03)

