4株单核细胞增生李斯特菌分子特征分析*
程晨,孔子艳,孙闯,马萍,,姜飞,顾兵,(.徐州医科大学医学技术学院,江苏徐州 004;.徐州医科大学附属医院检验科,江苏徐州 00)
单核细胞增生李斯特菌(Listeriamonocytogenes,以下简称单增李斯特菌)为革兰阳性、不产芽孢杆菌,在自然界中广泛存在,并能够在低温下生长的兼性胞内寄生菌[1]。该菌可通过食源性途径传播,引起人类李斯特菌病(listeriosis),导致败血症、脑膜炎、脑膜脑炎等,孕妇、新生儿、免疫功能低下者和老年患者易感[2]。尽管李斯特菌病发病率较低,但由于感染死亡率高(20%~30%),曾有感染暴发报道[3-4],从而引起全球广泛关注。关于中国人群单增李斯特菌感染的病例报道较少,缺乏相关的分子多样性数据[5]。本研究分析4例单增李斯特菌临床感染病例,并对分离到的菌株进行毒力基因检测、血清学分型以及同源性分析,以了解分离菌株的分子特征。
1 材料与方法
1.1患者信息与菌株来源 纳入2018—2019年于徐州医科大学附属医院确诊为单增李斯特菌感染的患者4例,其中男性1例,女性3例,年龄1 d~79岁。4例患者诊断为败血症或神经系统感染,其中3例存在基础疾病,1例患儿母亲产前过敏性紫癜和高热。2例经脑脊液标本分离单增李斯特菌(LM1、LM4),另2例经血培养标本分离(LM2、LM3)。所有分离株经Vitek 2 Compact全自动细菌分析仪和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)仪鉴定。沙门菌标准菌株H9812由徐州疾病预防控制中心提供,金黄色葡萄球菌ATCC 29213由徐州医科大学附属医院检验科微生物室提供。
1.2主要仪器与试剂 Vitek 2 Compact全自动细菌分析仪(法国生物梅里埃公司),MALDI-TOF MS仪(德国布鲁克公司),T100TMThermal Cycler PCR扩增仪、CHEF Mapper XA脉冲场凝胶电泳仪及配套设备、GelX1850凝胶成像仪(美国Bio-Rad公司),3730型DNA测序仪(美国ABI公司);Oxoid抗菌药物药敏纸片(赛默飞世尔科技公司),LB肉汤、哥伦比亚血琼脂平板、M-H平板、MH-F平板(M-H琼脂+5%脱纤维马血+20 mg/L β-NAD)(青岛海博公司),细菌基因组DNA提取试剂盒(北京天根公司),1 000 bp DNA marker、Premix Taq、蛋白酶K、溶菌酶(日本TaKaRa公司),限制性内切酶AscⅠ、XbaⅠ(美国NEB公司),引物合成(上海生工公司)。
1.3药敏试验 用纸片扩散法检测单增李斯特菌药物敏感性,包括11种测试抗菌药物:氨苄西林、青霉素、美罗培南、红霉素、甲氧苄啶/磺胺甲噁唑、庆大霉素、四环素、环丙沙星、克林霉素、氯霉素、利福平。其中,氨苄西林、青霉素、美罗培南、红霉素和甲氧苄啶/磺胺甲噁唑5种抗菌药物的药敏试验选用MH-F培养基并参照2017年欧盟药敏试验标准(EUCAST)进行判读[6];其他6种抗菌药物的药敏试验选用M-H培养基,参照美国临床和实验室标准协会(CLSI)对葡萄球菌属的抑菌圈直径折点进行解释[7]。
1.4DNA模板提取 将单增李斯特菌用LB肉汤复苏并接种于哥伦比亚血平板上,37 ℃过夜培养。用细菌基因组DNA提取试剂盒提取DNA,操作方法参照试剂说明书。提取后的DNA测定其浓度和纯度,确保吸光度比值(A260 nm/A280 nm)在1.6~1.9之间,置于-20 ℃备用。
1.5毒力基因检测和血清型分型 参照文献[8]合成李斯特菌毒力岛(prfA、actA、plcB、plcA、hly、hly2、mpl)及inlA、inlB基因引物,用PCR方法进行扩增。反应体系为50 μL,包括Premix Taq 25 μL,模板DNA 2 μL,上、下游引物(20 μmol/L)各1 μL,ddH2O 21 μL。反应条件为:95 ℃ 5 min;95 ℃ 30 s,58 ℃(prfA、actA、plcB)/57 ℃(plcA、hly、hly2)/60 ℃(inlA、inlB)/62 ℃(mpl)45 s,72 ℃ 45 s,30个循环;72 ℃ 10 min。用多重PCR扩增血清型相关基因lmo0737、lmo1118、ORF2819、ORF2110、prs,进行血清分型[9],反应条件为:94 ℃ 3 min;94 ℃ 40 s,53 ℃ 69 s,72 ℃ 69 s,35个循环;72 ℃ 7 min。PCR产物经15 g/L琼脂糖凝胶电泳观察,取阳性产物经3730型DNA测序仪进行Sanger双脱氧链终止法双向拼接测序,并与GenBank中的序列进行比对确证。测序工作均由上海生工公司完成。引物信息见表1。

表1 LM毒力基因和血清学分型所用引物
1.6多位点序列分型(multi-locus sequence typing,MLST)分型 参照MLST网站https://bigsdb.pasteur.fr/listeria/,合成单增李斯特菌的7个管家基因(abcZ、bglA、cat、dapE、dat、ldh、lhkA),并参照文献[10]反应条件进行PCR扩增,PCR反应体系同1.5。PCR产物纯化后进行Sanger双向测序,测序后拼接,将测序数据拼接提交上述网站比对,确定菌株ST型。使用eBURST V3.0程序(http://eburst.mlst.net/),与单增李斯特菌的整个ST数据集进行比较(数据库更新至2019年8月12日)。
1.7脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)分型 参照美国疾病预防控制中心Pulse-Net的PFGE标准操作程序进行。调制4.0~4.5麦氏浊度单位单增李斯特菌悬浊液,用溶菌酶和蛋白酶K消化,使用限制性内切酶AscⅠ 37 ℃酶切4 h。沙门菌标准株H9812作为分子量标准,用限制性内切酶XbaⅠ酶切。电泳参数为6 V/cm、4~40 s、19 h。电泳后的胶块使用GelRed染色,纯水脱色,经GelDoc 2000凝胶成像系统观察。根据可视化分析对PFGE带型进行结果判读[11],判读标准为:条带完全相同,视为同一克隆;存在1~3条条带差异,视为同一克隆不同亚型;存在3条以上条带差异,视为不同克隆。
2 结果
2.1药敏结果 4株单增李斯特菌均对氨苄西林、青霉素、美罗培南、红霉素、甲氧苄啶/磺胺甲噁唑、庆大霉素、四环素、环丙沙星、氯霉素、利福平敏感,对克林霉素中介。
2.2毒力基因检测与血清型分型 4株单增李斯特菌9种毒力基因(prfA、actA、plcB、plcA、hly、hly2、inlA、inlB、mpl)携带率为100%。LM1和LM4的lmo0737和prs基因扩增为阳性,lmo1118、ORF2819和ORF2110基因扩增为阴性,血清型为1/2a-3a;LM2和LM3的ORF2819和prs基因扩增为阳性,lmo0737、lmo1118和ORF2110基因扩增为阴性,血清型为1/2b-3b-7。
2.3MLST和PFGE分型 4株单增李斯特菌分为4种ST型:LM2为一新ST型,提交至MLST网站,获得分型号ST1474(abcZ-bglA-cat-dapE-dat-ldh-lhkA:2-1-11-3-3-1-2);另3株菌(LM1、LM3和LM4)ST型分别为ST121、ST619和ST621。用eBURST V3.0软件对4株单增李斯特菌ST型与MLST数据库中其他ST型进行进化分析,结果显示,ST121属于CC121克隆群,是该群的主要ST型;ST621属于CC11克隆群,由管家基因abcZ-99取代了ST11的abcZ-7;ST1474属于CC5克隆群,由管家基因lhkA-2取代了ST5的lhkA-2;ST619不与任何ST型形成克隆群。见图1。4株单增李斯特菌经限制性内切酶AscⅠ酶切后表现为4种不同的PFGE带型。见图2。

注:方框中代表本研究4株菌株,其余粉色点代表同一时间段徐州地区分离的食源性菌株ST型在数据库中的分布。
3 讨论
本研究中4例患者为3例合并基础疾病的老年人和1例早产儿,均属于免疫力低下人群,早产儿母亲产前存在高热、过敏性紫癜症状,怀疑经垂直传播感染胎儿。4株单增李斯特菌分离株均对青霉素、氨苄西林等药物敏感,但随着近年来耐药菌株的不断出现[12],应加强单增李斯特菌的耐药监测,从而指导临床合理用药。4例患者初始治疗方案为头孢噻肟/舒巴坦(LM1、LM4)、亚胺培南(LM2)和美罗培南(LM3)。单增李斯特菌感染诊断明确后,改为哌拉西林/他唑巴坦(LM1)、万古霉素(LM2、LM4)和青霉素(LM3)治疗,3例患者痊愈出院,1例患者非医嘱出院(LM4)。考虑治疗单增李斯特菌感染的首选药物在EUCAST均有判断标准,此次实验室提供的11种抗菌药物的药敏结果为纸片扩散法检测结果,且临床治疗方案均依据细菌鉴定和药敏结果作了调整并取得了良好的治疗效果。
文献报道inlA/B毒力基因在李斯特菌的黏附与侵袭方面发挥重要作用,李斯特菌毒力岛(LIPI-1,也称为prfA相关毒力基因簇,包括prfA、plcA、hly、plcB、mpl、actA)促进李斯特菌的胞内感染、增殖和播散[13]。食源性菌株中inlA/B与LIPI在4b血清型单增李斯特菌中普遍存在,而在血清型1/2a、1/2b和1/2c中检出相对较少,而人源性菌株中65%携带LIPI-1,60%同时携带LIPI-1 和inlA/B[8]。本研究单增李斯特菌临床分离株均携带LIPI-1和inlA/B,与文献报道相符,表明这些菌株可能具有强大的定植侵袭和致病能力。4株菌分为1/2a-3a和1/2b-3b-7 2种血清型,与中国北京、上海、台湾等地[5,14-15]及欧洲一些国家临床分离株主要血清型一致[16-17]。本研究受样本量局限性影响,并没有明确特定血清型与毒力基因间的联系,需后续加大样本量作进一步探究。
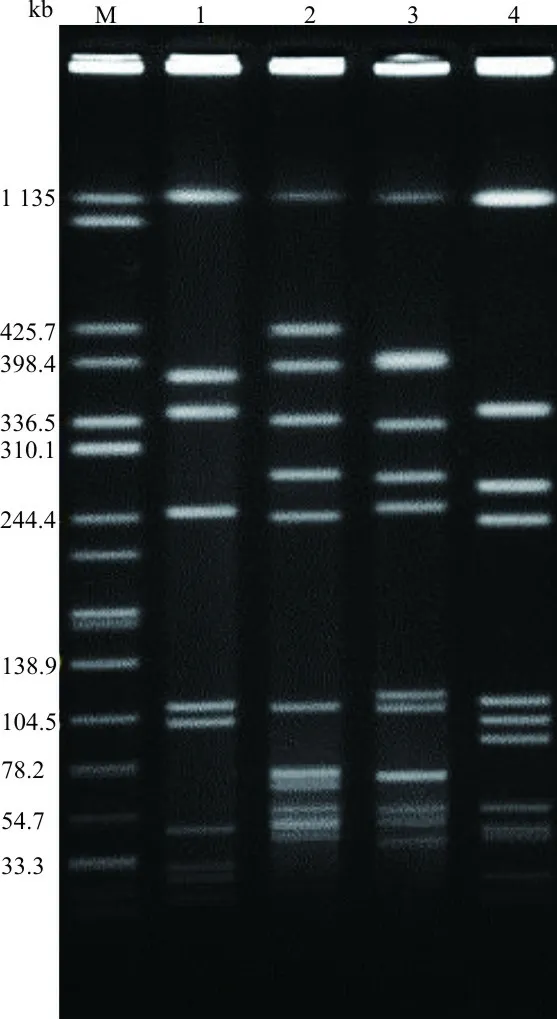
注:M,分子量标准(沙门菌标准株 H9812);1~4,单增李斯特菌LM1~LM4。
目前全球流行的单增李斯特菌克隆复合群包括CC1-CC9、CC87、CC121和CC155,我国ST87型临床分离株是较常见的ST型[5]。但本研究中4株单增李斯特菌未检出ST87,而检出ST121、ST619、ST621和ST1474,且上述4种ST型在江苏临床分离株中为首次报道,其中ST1474为新ST型,提示细菌群体的变异进化,为单增李斯特菌流行病学监测和微生物分子分型研究提供数据[18]。通过eBURST进化图发现,本文中ST121、ST621、ST1474均与其他ST型构成克隆复合群,但是通过与同时间段内本地区食源性菌株相比,只有1株ST121菌株与人源性菌株相同,考虑到食源性菌株数量太少(9株),且遗憾的是本研究在分离得到单增李斯特菌之后,并未及时对患者接触的食品以及早产儿的母亲进行溯源追踪,因此未能明确其传染源及传播途径。同时,PFGE结果的多样性也表明此次单增李斯特菌感染病例为散发病例。因此,作为食源性传染病原体,建立区域性单核细胞增生李斯特菌监测系统,追踪人感染单增李斯特菌的食物来源及传播途径,可为防治单增李斯特菌感染及其分子进化提供重要信息。这将是我们下一步研究的重点。
致谢:感谢徐州市疾病预防控制中心余峰玲老师提供的徐州地区食源性单核细胞增生李斯特菌菌株信息。

