外源性H2S对糖尿病小鼠肝纤维化的作用及其机制*
席雨鑫,温 馨,矫立杰,魏亚新,常贵全,武 韧,孙凤起,郝静辉,李鸿珠
(哈尔滨医科大学基础医学院病理生理学教研室,黑龙江 哈尔滨 150086)
众所周知,糖尿病并发症常常是糖尿病病人致死、致残的主要原因[1]。糖尿病可诱发一系列肝脏疾病,肝纤维化是慢性肝脏疾病发展到肝硬化、肝癌的必经阶段[2]。找到抑制肝纤维化的药物和方法是国内外学者关注的焦点。
硫化氢(hydrogen sulfide, H2S)是继一氧化氮和一氧化碳后新发现的第三个气体信号分子[3]。生理浓度范围的H2S在机体的各个组织器官发挥着重要的生理作用[3],例如,H2S可抑制细胞增殖、调节凋亡、抑制内质网应激、调控炎症反应、抗氧化、调控线粒体通透转运、调控离子通道及在细胞内信号转导等[3]。据报道,H2S通过抑制肝纤维化进而减轻肝硬化及肝癌的发生[4]。H2S是通过哪些机制抑制肝纤维化已成为当今研究的热点。本研究采用链脲佐菌素(streptozotocin, STZ)诱导C57 小鼠建立糖尿病肝纤维化模型,探讨外源性H2S对糖尿病小鼠肝纤维化作用及其相关机制。以期为肝癌及肝硬化等疾病的防治提供新的理论基础和治疗靶点。
1 材料与方法
1.1 药品和试剂
硫氢化钠(NaHS)和 STZ(Sigma公司),胱硫醚-β-合成酶(cystathionine-β-synthetase, CBS)、胶原 I(collagen-I, Col-I)、胶原 III(collagen-III, Col-III)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)和 β-actin 抗体(武汉三鹰生物技术有限公司),其它试剂均为分析纯。
1.2 动物和糖尿病模型建立
清洁级 C57 雄性体重(22±2)g小鼠24只购自哈尔滨医科大学附属二院动物室。将 其随机分为3组(n=8):(1)正常对照组(Control):小鼠腹腔注射生理盐水,注射时间同实验组;(2)糖尿病模型组(HG):按小鼠体重(150 mg/kg)一次性腹腔注射 STZ,注射体积为每只小鼠100~200 μl;(3)NaHS 处理组(HG + NaHS): 方法同组别(2),只是糖尿病模型建立后,腹腔注射NaHS(100 μmol/L·kg·d),每天一次,连续12周。以上3组,为防止小鼠发生低血糖休克,注射 STZ 后 24 h 内给予20% 的葡萄糖水饮用;注射 STZ 72 h 后,于小鼠尾静脉采血测各组小鼠空腹血糖,若空腹血糖浓度>16.7 mmol/L 则证明 I 型糖尿病大鼠模型造模成功[2]。
1.3 HE 染色
从各组小鼠肝脏右叶切取相同大小的肝脏组织,用4% 多聚甲醛磷酸缓冲液固定24~48 h,常规脱水、浸蜡、包埋、染色、透明和封片制成普通的HE染色切片,于Olympas光学显微镜下观察肝脏组织的形态学变化。
1.4 Masson染色
上述的石蜡切片脱蜡处理至无水,用 Regaud 苏木精染液染核 5~10 min,充分水洗,用 Masson 丽春红酸性复红液 5~10 min,以 2% 冰醋酸水溶液浸洗片刻,1% 磷钼酸水溶液分化 3~5 min,直接用苯胺蓝液染 5 min,以 0.2% 冰醋酸水溶液浸洗片刻,最后用 95% 酒精、无水酒精、二甲苯透明、中性树胶封固。
1.5 Western blot 检测
取各组肝组织,在液氮内研磨,加入冰预冷的蛋白裂解液(l mmol/L PMSF,pH7.4),混匀,冰浴作用 30 min;4℃,12 000 r/min,离心 30 min,取上清液,用考马斯亮蓝法染色,测定蛋白含量;取上清加入上样缓冲液(体积比4∶1),100℃ 沸水中煮 5 min。各组将等量的总蛋白加入 10% SDS-PAGE 凝胶中进行电泳,然后转至 PVDF 膜上,TBST 液清洗PVDF 膜 3 次,每次 10 min,加 5% 脱脂奶粉,37℃ 封闭 1 h 后加入相应的一抗,4℃ 震荡过夜。TBST 液漂洗 PVDF 滤膜 3次,每次 10 min。将膜与 TBST 稀释的二抗孵育,室温下振荡 1 h,TBST液漂洗除去未结合的二抗。用 Western blue stabilized substrate for AP显色,凝胶成像系统下拍照,计算条带光密度值,目的蛋白表达水平以其与 β-actin 光密度比值来表示。
1.6 统计学处理
2 结果
2.1 外源性H2S对其产生的关键酶CBS蛋白表达的影响
结果显示,Control组、HG组和HG+NaHS组的CBS表达分别为1.05±0.07、0.66±0.07和1.36± 0.06,可见与Control组比较,HG组CBS 蛋白表达显著减少(P<0.01)。与HG组比较,HG + NaHS组CBS 蛋白表达显著增加(P<0.01,图1)。

Fig. 1 The expressions of CBS in different groups(n=3)
2.2 外源性H2S对肝细胞损伤的影响
HE染色结果显示,Control组肝细胞排列整齐,肝组织结构完好;HG组肝细胞排列紊乱,肝组织结构破坏严重,有炎性坏死和大量脂质空泡;HG + NaHS组肝细胞损伤减轻,肝组织较完好(图2)。

Fig. 2 The structural changes of hepatocytes in different groups(× 400,scale bar=100 μm)
2.3 外源性H2S对肝纤维化的影响
Masson染色结果显示,Control组中央静脉区仅少量较原纤维沉积;HG组在中央静脉区及汇管区,有大量胶原纤维沉积;HG + NaHS组胶原纤维沉积较HG组明显减少(图3)。

Fig. 3 The results of Masson staining in different groups(× 400,scale bar=100 μm)
2.4 外源性H2S对Col-I、Col-III和MMP-9蛋白表达的影响
与Control组相比,HG组Col-I、Col-III和MMP-9蛋白表达均显著增加(P<0.01);与HG组比较,HG + NaHS组Col-I、Col-III和MMP-9蛋白表达均显著降低(P<0.01,图4,表1)。

Fig. 4 The expression changes of Col-I, Col-III and MMP-9 in different groups(n=3)
3 讨论
糖尿病是以胰岛素分泌绝对或相对不足,或外周组织对胰岛素不敏感,引起以糖代谢紊乱为主,包括脂肪、蛋白质代谢紊乱的一种全身性代谢疾病,常发生血液流变学、微循环和细胞代谢的紊乱,导致缺血、缺氧和组织水肿,进而引起血管和神经病变[1]。糖尿病会引起很多并发症并导致患者死亡。例如,糖尿病可引起肝硬化进而导致肝癌、糖尿病肾病是慢性终末期肾衰的主要原因、糖尿病性心肌病可引起严重心肌舒张和收缩障碍、严重糖尿病足常需要截肢、糖尿病视网膜炎可导致失明等[5]。可见,糖尿病并发症对机体的损伤较严重。
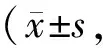
Tab. 1 The changes of Col-I, Col-III and MMP-9 expressions in different groups n=3)
STZ通过破坏胰岛 B 细胞引起血糖增加导致糖尿病的发生,这是目前建立 I 型糖尿病模型的主要方法。本实验结果显示,按小鼠体重(150 mg/kg)一次性腹腔注射 STZ 72 h 后,小鼠空腹血糖浓度为 23.8 mmol/L>16.7 mmol/L,并且 HE 和 Masson 染色也发现肝细胞外基质沉积和胶原含量均增加,这证明糖尿病小鼠模型造模成功。
众所周知,糖尿病可引起肝纤维化,导致肝细胞结构的破坏、细胞外基质增加、胶原纤维增多和排列紊乱,进而引起肝功能下降[6]。基质金属蛋白酶(matrix metalloproteinase, MMPs)是依赖于锌离子和钙离子的蛋白水解酶,其主要作用是降解细胞外基质。当MMPs 调节功能异常时,会引起细胞外基质的大量沉积。现已发现 26 种 MMPs(MMPs-1-26),称为 MMPs 家族。在 MMPs 家族中,MMP-9 是最重要的蛋白水解酶之一[7]。
内源性H2S 是一种具有广泛生理功能的气体信号分子,由半胱氨酸在胱硫醚-β-合成酶(cystathionine-β-synthase,CBS)、胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)和巯基丙酮酸硫转移酶(3-mercaptopyruvate suifurtransferase, 3MST)催化作用下产生的[3]。CBS、CSE和3MST 的分布具有组织器官特异性,肝组织中以CBS表达为最多[8]。据报道,H2S能够抑制肝、肺和肾纤维化,被称为有效的抗纤维化剂[9]。本实验结果显示,糖尿病模型组(HG组)CBS蛋白表达显著减少, 肝细胞损伤及肝纤维化均加重, Col-I、Col-III和MMP-9蛋白表达均显著增加,这提示糖尿病肝纤维化的发生与内源性CBS/H2S通路的下调密切相关。为了证明这一点,本实验外源给予NaHS(H2S产生的供体)的结果表明,与糖尿病模型组比较,NaHS处理组肝细胞损伤及肝纤维化均显著减轻,CBS 蛋白表达增加,Col-I、Col-III和MMP-9蛋白表达均显著减少。这证明外源性H2S可通过降低胶原含量和基质金属蛋白酶-9的表达而抑制糖尿病小鼠肝纤维化。
综上所述,糖尿病小鼠肝纤维的发生与内源性CBS/H2S通路的下调密切相关。外源性H2S可抑制糖尿病小鼠肝纤维化,其机制与降低胶原含量和基质金属蛋白酶-9的表达相关。因此H2S有望成为治疗肝硬化、肝癌的新靶点。同时,外源性H2S 能够抑制糖尿病及其并发症的发生和发展,这也为糖尿病及其并发症的临床防治提供新的思路。

