间歇性禁食与运动对骨骼肌自噬的激活及减脂效果的比较*
王 祯,于 亮,付 悦
(北京体育大学运动人体科学学院,北京 100084)
肥胖是困扰现代社会人体健康的一大难题,高热量饮食与体力活动不足是其主要诱因,因此饮食调控与有氧运动成为减肥的首选措施,然而二者减肥效果的优劣却鲜有报道。有氧运动是通过增加机体热量消耗,以达到控制体重效果的一种手段。而饮食调控则是通过减少机体能量摄取,降低体内脂肪的累积。间歇性禁食(intermittent fasting,IF)是目前较为流行的饮食调控手段之一,通过一定周期内禁食与饮食的交替进行,实现机体能量的间歇性亏空,有研究认为这种能量亏空形式可能会产生与有氧运动类似的效果[1,2]。但也有学者质疑,认为热量摄取的减少会影响机体对营养物质的吸收,导致肌肉质量受损[3,4]。
自噬是机体将自身多余、破损的细胞器或蛋白质经溶酶体系统清除的过程。通常生物体自噬活性较低,当个体经历运动、饥饿等应激刺激时,自噬活性会发生不同程度的改变,这种改变效益具有双面性,一方面自噬若激活程度适宜,则有利于胞内破损细胞器或变性蛋白质的清理,促进细胞生存,且可以通过自噬过程降解体内“杂物”,减少其对机体能量的占用;另一方面当应激强度过大,自噬水平的过度激活会引起程序性细胞死亡,进而导致包括骨骼肌在内的相关组织的损伤,影响其质量与功能。
现已知适宜强度的运动可以适度提高机体自噬水平,给骨骼肌带来积极影响,但间歇性禁食对骨骼肌自噬水平的影响却鲜有报道。本研究通过建立间歇性禁食和有氧运动模型,在观察对比二者体重控制效果的基础上,探讨其对骨骼肌质量的影响及自噬激活情况,为寻找适宜的控制体重的措施提供理论支撑。
1 材料与方法
1.1 实验动物与分组
实验选取清洁级雄性SD大鼠60只(8周龄,体重280-320 g),购于北京维通利华实验动物技术有限公司,在北京体育大学SPF级动物实验室进行饲养和训练,温度20~24℃,昼夜明暗交替各12 h。正式实验开始前预适应3 d后,随机分为安静对照组(Sed)、间歇性禁食组(InF)、有氧运动组(Exe),每组20只。此外,各组又分为14 d与28 d两个干预亚组。各组大鼠体重经单因素方差分析无显著性差异(P>0.05)。于每周六下午称量、记录体重。
1.2 模型建立
1.2.1 间歇性禁食模型 参考Vasconcelos等(2014)[5]设计的大鼠隔日禁食模型,具体干预方案为间歇性禁食组大鼠单笼饲养,预适应期间根据前一天喂食量及第二日饲料剩余量计算各组大鼠每只每日的平均食物摄入量。正式实验期间采取隔日禁食方案,即单数日(如1 d、3 d、5 d…27 d)投喂食物,双数日(如2 d、4 d、6 d…28 d)断粮,禁食期间不限制饮水,摄食日根据计算给予大鼠每日摄食量的2倍,使大鼠摄入总热量与安静组相同。实验周期分别为14 d、28 d。以上投食、断食及食物的称量均在每天同一时间点进行(图1)。

Fig. 1 Intermittent fasting program of rats
1.2.2 有氧运动模型 有氧运动组在预适应期间进行低速度短时间的适应性跑台训练,正式实验时速度16 m/min,时长60 min,每周训练6 d,跑台坡度第一周为0°,从第二周开始调整为5°,实验周期分别为14 d、28 d。
1.3 动物取材
各时间点训练完成后,处死前断食12 h,腹腔注射10%水合氯醛进行麻醉,剂量3 mg/kg,腹主动脉采血致死。取左右侧比目鱼肌置于天平上称重,计算湿重指数,即比目鱼肌湿重(g)/体重(g);分割米粒大小,用OCT包埋转移至-80℃存储,用于后续切片实验;分割同样大小投入戊二醛中,制备透射电镜样品;剩余比目鱼肌放入液氮中暂时贮存,当日取材结束立即转入-80℃冰箱冻存,用于后续检测。除称量湿重外,其它实验中的肌肉不区分左右侧。
1.4 双能X线吸收测量法(DEXA)
提前预热并校准实验设备,双击NORLAND图标并设定程序,大鼠麻醉后放在仪器上,标记开始点、结束点、基点后进行扫描,所有大鼠扫描结束后统一保存、分析数据,每组扫描4只(图2)。体脂指数(fat mass index)=体脂含量(g)/体重(g)。
1.5 透射电镜
将戊二醛中的样本按以下步骤开始实验:(1)0.1 mol/L磷酸缓冲液浸洗30 min。(2)4℃环境下1%锇酸固定2 h。(3)0.1 mol/L磷酸缓冲液浸洗10 min。(4)乙醇梯度脱水:30%乙醇、50%乙醇、70%乙醇各10 min。(5)70%乙醇醋酸双氧铀染2 h。(6)90%乙醇10 min×2;100%乙醇10 min×3。(7)环氧丙烷置换10 min。(8)环氧树脂EMbed浸透、包埋、聚合。(9)制作1 μm半超薄切片,染色后于光镜下取像定位,并切取60 μm超薄切片,重金属染色后,透射电镜下(×3 000、×6 000)观察比目鱼肌自噬体形态,每组选取2只进行透射电镜实验。

Fig. 2 DEXA detects body fat mass
1.6 冰冻切片及免疫荧光
(1)冰冻切片的制作:提前开启冰冻切片机预冷(温度-20℃),将样品放在冰冻切片机中20 min,以平衡样品温度。调整玻璃板和刀片的角度,用OCT包埋剂浇铸底座,取出包埋组织,将底部削平并垂直固定在底座上。50 μm粗调削出组织后,用8 μm细调切取组织,贴在备好的载玻片上,待组织雾气蒸发后置于显微镜下看其形态,选取肌细胞结构完整的载玻片放入-80℃冻存。(2)免疫荧光检测laminin:细胞外层粘连蛋白laminin定位于细胞外基质,利用其定位可检测肌纤维横截面积。取出带有样品的防脱载玻片,常温平衡5 min,按以下步骤进行实验:①PBS洗3次,每次5 min;②浸泡在含有0.3% Triton的PBS中破膜30 min;③画圈后滴加5%羊血清(使用PBS稀释),常温封闭20 min;④滴加含有一抗laminin的5%羊血清(浓度1∶500),湿盒内4℃过夜;⑤次日滴加含有荧光二抗的5%羊血清(浓度1∶500),避光孵育1 h;⑥载玻片上滴加DAPI封片,待DAPI干后,激光共聚焦显微镜拍摄并储存(放大倍数:100倍)。图片导入Image-Pro Plus统计、分析单个肌纤维横截面积。(3)免疫荧光检测LC3:取出带有样品的防脱载玻片,常温平衡5 min,按以下步骤进行实验:①浸泡在丙酮中4℃固定10 min;②PBS摇床洗3次,每次5 min;③画圈后滴加5%羊血清(使用PBS稀释)常温封闭20 min;④滴加含有一抗LC3的5%羊血清(浓度1∶100),湿盒内4℃过夜;⑤第2日加入荧光二抗(浓度1∶500),避光孵育1 h;⑥载玻片上滴加DAPI封片,待DAPI干后,激光共聚焦显微镜拍摄并储存(放大倍数:630倍),进行定性分析。
1.7 蛋白质印迹
剪取比目鱼肌100 mg放在EP管中,加1 ml RAPI裂解液(含蛋白酶及磷酸酶抑制剂),剪碎并匀浆。静置30 min后离心(4℃,12 000 r/min,8 min),取上清转移至新管中。BCA法测定其浓度,使用5×loading buffer和裂解液将各组浓度调为一致,沸水变性10 min,室温冷却,分装并移至-40℃冷存备用。Western blot检测自噬相关蛋白LC3、p62及调控蛋白AMPKα、p-AMPKα(Thr172)、ULK1的表达。AMPKα、p-AMPKα(Thr172)、ULK1、p62采用10%分离胶浓度,LC3采用12%分离胶浓度,SDS-PAGE凝胶电泳,300 mA转膜1.5 h,5% BSA对PVDF膜封闭2 h,使用5% BSA配制一抗AMPKα(浓度1∶500)、p-AMPKα(Thr172)(浓度1∶500)、ULK1(浓度1∶500)、LC3(浓度1∶500)、p62(浓度1∶500)、GAPDH(浓度1∶2 000),4℃过夜。目的蛋白二抗浓度1∶1 000,内参二抗浓度1∶2 000,常温孵育1.5 h,TBST清洗后曝光,利用Image Lab 5.1软件进行灰度值分析。
1.8 统计学处理
2 结果
2.1 间歇性禁食与运动对大鼠体重的影响
称量、计算单日摄食量发现,预适应期间大鼠单日平均摄食量为(31.1±12.1)g。干预14 d时InF组单个摄食日的平均摄食量为(35.4±6.7)g。干预28 d时InF组单个摄食日的平均摄食量为(35.9±6.0)g。
每周按时称量大鼠体重,数据显示,在干预期内各组大鼠体重均呈增长趋势,干预7 d InF、Exe组大鼠体重显著低于Sed组,InF组大鼠体重显著低于Exe组(P<0.01),并随时间延长延续该趋势(表1)。
14 d、28 d干预结束后将大鼠麻醉,使用DEXA检测其体脂含量,并计算体脂指数,数据显示干预14 d时InF、Exe组大鼠体脂指数低于Sed组,InF组体脂指数低于Exe组,但无显著性差异(P>0.05);干预28 d时InF、Exe组大鼠体脂指数显著低于Sed组(P<0.05),且InF组体脂指数显著低于Exe组(P<0.01,表2)。

Tab. 1 Effects of intermittent fasting and exercise on body weight of rats(g,

Tab. 2 Effects of intermittent fasting and exercise on fat mass index of rats(×10-2, n=4)
2.2 间歇性禁食与运动对大鼠骨骼肌质量的影响
湿重指数数据显示,14 d和28 d干预时长中InF组、Exe组均高于Sed组,且InF组均高于Exe组,但无显著性差异(P>0.05,表3);此外,免疫荧光法检测laminin显示,干预14 d时各组肌纤维横截面积之间差异无显著性(P>0.05),干预28 d时Exe组肌纤维横截面积显著大于Sed与InF组(P<0.01,图3,表4)。

Tab. 3 Effects of intermittent fasting and exercise on muscle wet weight index of rats(×10-4, n=10)

Fig. 3 Effects of intermittent fasting and exercise on cross-section area of rats soleus muscle(immunofluorescence ×100)
2.3 间歇性禁食与运动对大鼠骨骼肌自噬体形态的影响
本研究选取透射电镜观察骨骼肌中自噬体形态,结果显示Sed组大鼠比目鱼肌内Z线整齐、线粒体分布均匀、未见明显自噬体,干预14 d时InF组大鼠比目鱼肌内“双层膜结构”增加,提示自噬体的增多,Exe组自噬体略有增加,较不明显,但出现肌节混乱,线粒体肿大等现象;干预28 d时,InF组自噬体数量仍较Sed组增加,Exe组大鼠比目鱼肌内自噬体较14 d明显增多,单位视野面积中自噬体出现几率增加(图4)。

Tab. 4 Effects of intermittent fasting and exercise on cross-section area of in rats soleus muscle(μm2, n=10)

Fig. 4 Effects of intermittent fasting and exercise on autophagosome morphology of rats soleus muscle(uncoloured ×3 000 or 6 000)
2.4 间歇性禁食与运动对大鼠骨骼肌自噬分子LC3定位的影响
免疫荧光结果显示,与Sed组相比,InF组、Exe组大鼠比目鱼肌中自噬分子LC3在细胞膜周聚集较多,其中蓝色为细胞核,绿色为LC3(图5)。

Fig. 5 Effects of intermittent fasting and exercise on LC3 localization of rats soleus muscle(immunofluorescence ×630)
2.5 间歇性禁食与运动对大鼠骨骼肌自噬相关蛋白表达的影响
2.5.1 比目鱼肌LC3、p62蛋白表达变化 干预14 d时,InF组比目鱼肌内LC3-Ⅱ及LC3-Ⅱ/LC3-Ⅰ水平较Sed组升高,但不具有显著性差异(P>0.05),p62水平显著低于Sed和Exe组(P<0.01),而Exe组LC3-Ⅱ、LC3-Ⅱ/LC3-Ⅰ及p62蛋白表达水平与Sed组相比未见差异(P>0.05)。干预28 d时,InF组LC3-Ⅱ及LC3-Ⅱ/LC3-Ⅰ仍较Sed组升高,且p62显著低于Sed组(P<0.05);Exe组比目鱼肌LC3-Ⅱ及LC3-Ⅱ/LC3-Ⅰ水平明显升高,p62水平明显降低(P<0.05,图6,表5)。

Fig. 6 Effects of intermittent fasting and exercise on relative expressions of LC3 and p62 in rats soleus muscle
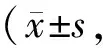
Tab. 5 Effects of intermittent fasting and exercise on relative expressions of LC3 and p62 in rats soleus muscle n=10)
2.5.2 比目鱼肌ULK1蛋白表达变化 干预14 d时,InF组、Exe组比目鱼肌ULK1蛋白水平较Sed组显著增加(P<0.01),而InF组与Exe组之间未见显著性差异(P>0.05)(相对表达量Sed组为1,InF组为1.35±0.08,Exe组为1.48±0.12);28 d干预后InF组、Exe组比目鱼肌ULK1水平仍维持在较高水平(图7)(相对表达量Sed组1,InF组为1.18± 0.13,Exe组为1.22±0.17)。

Fig. 7 Effects of intermittent fasting and exercise on relative expression of ULK1 in rats soleus muscle
2.5.3 间歇性禁食与有氧运动对比目鱼肌AMPKα、p-AMPKα(Thr172)蛋白表达的影响 干预14 d时,InF组、Exe组比目鱼肌AMPKα、p-AMPKα(Thr172)蛋白水平较Sed组显著增加,差异具有显著性(P<0.05),而InF组与Exe组之间未见显著性差异(P>0.05)。干预28 d时,InF组、Exe组比目鱼肌AMPKα、p-AMPKα(Thr172)蛋白仍维持在较高水平(图8,表6)。

Fig. 8 Effects of intermittent fasting and exercise on relative expression of AMPKα and p-AMPKα(Thr172)in rats soleus muscle
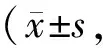
Tab. 6 Effects of intermittent fasting and exercise on relative expressions of AMPKα and p-AMPKα(Thr172)in rats soleus muscle n=10)
3 讨论
增加机体能量消耗和降低机体能量摄入是实现控制体重的两种途径,分别对应着运动与饮食调控。运动对体重的控制作用已得到诸多证实[6],本研究数据显示,有氧运动干预可显著减缓大鼠体重与体脂增长幅度,可能与自身热量消耗增多、增加脂肪供能有关。饮食调控作为另一种体重控制手段,因其“不费劲儿”、易坚持等特点,逐渐得到人们的重视和喜爱,它不仅能有效控制机体体重及体脂含量[7-9],还可以改善糖代谢能力,减轻氧化应激,达到促进健康、推迟衰老的效果。根据实施方案的不同,饮食调控手段可分为间歇性禁食、热量限制、饮食限制三类。与热量限制不同,间歇性禁食在摄食日不限制个体的饮食量,因此其依从性更好,此外,间歇性禁食在消耗脂肪方面也更为优秀[10]。课题组前期研究显示,对大鼠进行4周小强度间歇性禁食干预(每周三、五禁食)可有效控制体重增长,且未对骨骼肌质量产生负面影响[11],因此本研究在前期研究基础上加大饮食干预力度,并增加有氧运动组作为对比,为探索有效的减脂措施提供参考。本研究数据显示,间歇性禁食组大鼠体重从第7日开始便明显低于有氧运动组与对照组,体脂指数也在三组中表现最低,提示在减肥中采用饮食调控方法(如间歇性禁食)或许能较有氧运动收到更大的成效。
骨骼肌湿重及其单根肌纤维横截面积受到合成代谢与分解代谢的调控,是体现肌肉适应能力的间接标准。骨骼肌质量(skeletal muscle mass)是肌纤维内蛋白质和水分的总称,受肌肉蛋白合成(muscle protein synthesis,MPS)与肌肉蛋白降解(muscle protein breakdown,MPB)的双向调控,适宜强度的运动可以增加骨骼肌质量,而强度过大、持续时间过长的不科学运动会导致MPB过程增强,降低骨骼肌质量[12]。本研究采用有氧跑台运动,发现干预28 d时Exe组肌纤维横截面积较Sed、InF组显著增大(P<0.01),说明本研究使用的有氧运动强度适宜,且该强度有氧运动导致骨骼肌质量有益改变的时间点可能是28 d。此外,目前有关饮食调控对骨骼肌质量影响方面争议较大,部分研究发现,热量限制可以减少肌纤维的萎缩与损失[13,14],防止肌肉力量丢失[15];而有研究则认为,饮食调控方法降低机体对糖、蛋白质等营养物质的摄入,对肌纤维蛋白合成及其质量有负面效应。本研究结果显示,干预14 d、28 d时InF组肌纤维横截面积及湿重指数较Sed组无明显差异,而干预28 d时Sed及InF组肌纤维横截面积均显著低于Exe组(P<0.01),说明本研究采用的饮食调控方法(即间歇性禁食)对骨骼肌质量的作用仅是维持,若想提高骨骼肌质量,需辅以适宜的运动。
机体利用自噬清除体内“废物”,通过包裹、运送、水解等过程完成对被降解物的分解,该过程解除了体内受损细胞器或蛋白质对能量的消耗,使蛋白代谢及细胞环境处于稳定状态,学术中常使用LC3-Ⅱ或LC3-Ⅱ/LC3-Ⅰ水平反映自噬活性,其活性高低是左右骨骼肌质量的关键,自噬水平过高使骨骼肌质量受损,而自噬水平过低意味着体内“废物”的堆积,同样对骨骼肌质量不利[16,17],因此适宜自噬活性是维持骨骼肌质量的保证。禁食会引起自噬的激活,研究发现60%热量限制可通过诱导小鼠骨骼肌Nix表达,促进线粒体自噬的发生[18]。AMPK是诱导骨骼肌自噬的核心分子,可在Ser 317/Ser 555/Ser 467/Ser 637/Ser 777位点磷酸化ULK1,促进ULK1-Atg13-FIP200复合物的形成,直接诱发自噬。研究表明,运动可通过激活AMPK途径诱导骨骼肌自噬,基因敲除AMPK会降低机体运动能力及线粒体功能[19,20]。而禁食由于能量摄入的减少,同样对AMPK有激活作用。Bujak等[21](2015)发现,肌肉中的AMPK是饥饿过程中激活自噬的必需分子,敲除该蛋白会抑制自噬。本研究结果显示,干预14 d时,InF组比目鱼肌AMPKα及其磷酸化、ULK1、LC3-Ⅱ及LC3-Ⅱ/LC3-Ⅰ的表达较Sed组显著增加,p62水平显著降低(P<0.05);Exe组比目鱼肌AMPKα及其磷酸化、ULK1蛋白水平显著提高,但自噬标志分子LC3与自噬底物p62表达水平在28 d才表现出显著性变化(P<0.05),提示14 d间歇性禁食干预可以通过打开“能量开关”AMPK,活化ULK1,使肌肉自噬发生,而该长时间运动虽能有效激活AMPK,但自噬体的形成与降解需更长时间的干预。结合湿重、肌纤维横截面积数据分析发现,14 d与28 d间歇性禁食诱导的骨骼肌自噬不会给骨骼肌质量带来负面影响,推测其原因可能是机体在能量摄入不足的情况下,会经AMPK-ULK1途径诱导适宜的骨骼肌自噬,降低体内受损细胞器或错误折叠蛋白质对能量的消耗,以此适应能量摄入的缺乏,从而维持骨骼肌质量。
综上所述,本研究采用的间歇性禁食方案(隔日禁食)在控制大鼠体重、体脂增长方面优于有氧运动。14 d间歇性禁食干预可经AMPK/ULK1通路激活适宜自噬,以清除体内受损细胞器或错误折叠蛋白质,减少能量消耗,维持肌肉质量,而有氧运动对自噬的激活在28 d才更显著,有关间歇性禁食作为一种“短期”的体重控制方式尚待进行进一步研究。

Fig. 9 Intermittent fasting induced skeletal muscle autophagy via AMPK-ULK1 pathway

