苦参素复合长春新碱对HCT-8/VCR细胞耐药性的影响及其机制*
苏建伟,周喜汉△,叶颖霞,蒋 旗
(1.右江民族医学院附属医院消化内科, 2.右江民族医学院附属医院内科,广西 百色 533000)
结肠癌属于消化道恶性肿瘤,其发病率和死亡率逐年上升[1],由于结肠癌多数早期没有典型的临床症状,发现时大多数处于进展期和晚期,化疗已成了结肠癌患者主要的治疗方式。长春新碱是目前临床上常用抗结肠癌药物,其主要机制是抑制有丝分裂纺锤体中的微管(microtubule)形成,导致中期阶段的分裂细胞停滞,以发挥抗肿瘤作用[1]。但结肠癌患者长期使用长春新碱的毒副作用和耐药性已成为结肠癌化疗失败的主要原因。中医药在治疗肿瘤和逆转肿瘤化疗耐药等方面的研究已成为临床实验研究热点[2-3]。苦参素(oxymatrine,OM)是一种从苦参、广豆根中提取的生物碱,已有研究发现苦参素具有抗肿瘤作用,用于治疗晚期肝癌患者,可改善机体全身状况,延长生命[4]。另外也有研究发现,苦参素对肿瘤的耐药性也具有一定的逆转作用[5]。冯云等[6]研究发现通过调控肿瘤细胞的自噬及免疫应答水平可以逆转肿瘤的耐药性。关于苦参素能否逆转结肠肿瘤对长春新碱的耐药,其机制是否与自噬及免疫应答水平的表达相关,目前尚无深入的研究。本研究以人结肠癌耐长春新碱细胞株(HCT-8/VCR)为研究对象,初步探讨苦参素复合长春新碱对HCT-8/VCR细胞耐药性的影响及其机制,为临床上结肠癌的治疗提供理论依据。
1 材料与方法
1.1 主要试剂
HCT-8/VCR(人结肠癌耐长春新碱的HCT-8细胞)购自上海斯信生物公司;苦参素注射液(国药准字H20057480)购于江苏正大天晴药业有限公司;长春新碱注射液(国药准字H44021772购于深圳万乐药业有限公司。青链双抗、优级胎牛血清购自HyClone公司1640培养基、0.25%胰蛋白酶(含EDTA)购自GIBICO公司,细胞自噬染色检测试剂盒(MDC法)、磷酸盐缓冲盐PBS购自北京索莱宝科技有限公司;细胞活力检测试剂盒采用CCK-8购自上海翊圣公司;Anti-LC3-Ⅱ/LC3-Ⅰ兔单克隆抗体、Anti-SQSTM1/p62兔单克隆抗体、Anti-Beclin1兔单克隆抗体、Anti-TLR4鼠单克隆抗体购自abcam公司;GAPDH鼠抗体购自中杉金桥公司;预染marker、RIPA裂解液、BCA蛋白测定试剂盒、辣根过氧化物酶HRP-标记山羊抗兔IgG(H+L)购自碧云天公司;辣根过氧化物酶HRP-标记羊抗鼠IgG购自博士德公司;IL-6 ELISA检测试剂盒购自武汉默沙克生物科技有限公司。
1.2 细胞培养及分组
HCT-8/VCR用含10%胎牛血清的RPMI 1640培养基,置于37℃ 5%CO2的培养箱中培养。HCT-8/VCR细胞生长到80%时,以1.0×104cells/well,接种于96孔板中。实验分组分为空白组、苦参素单药组,长春新碱单药组、苦参素和长春新碱联合组,每组6个复孔。
1.3 CCK-8检测各组的抑制率
苦参素组药物浓度包括0.1 mg/ml、0.5 mg/ml、1 mg/ml、2 mg/ml、5 mg/ml、10 mg/ml、20 mg/ml、50 mg/ml。长春新碱单药组药物浓度包括1 μg/ml、5 μg/ml、10 μg/ml、20 μg/ml、50 μg/ml、100 μg/ml、200 μg/ml。苦参素和长春新碱联合组药物浓度包括:1 mg/ml苦参素和上述不同浓度的长春新碱。给药24 h后,每孔加入3 μl的CCK-8试剂,孵育2 h,450 nm处测定吸光度A。抑制率(%)=1-(实验组A值-本底组A值)/(对照A值-本底组A值)×100%。本实验用Graphpad prism 6.0软件分别计算单药组和联合组处理HCT-8/VCR细胞24 h的IC50值。计算联合组的逆转倍数=不加苦参素的IC50/加入苦参素的IC50。
1.4 MDC法检测各组细胞自噬体
采用1 mg/ml苦参素与1 μg/ml长春新碱单独或者联合处理细胞,24 h后,离心收集培养基和细胞分别备用,采用Wash buffer清洗细胞后加入10 μl 单丹磺酰尸胺(dansylcadaverine,MDC)试剂,孵育45 min,再清洗2遍,加入100 μl的Collection buffer重悬细胞,滴加于载玻片上并加盖玻片。采用荧光倒置显微镜拍照(激发滤光片波长355 nm,阻断滤光片波长512 nm)。
1.5 ELISA法检测细胞培养液中IL-6的含量
按照ELISA试剂盒说明书检测1.4方法中培养基的IL-6含量。
1.6 Western blot实验检测自噬相关蛋白和TLR4表达的情况
用RIPA裂解液冰上裂解1.4方法中各组的细胞,裂解完后4℃、13 000 r/min离心20 min,收集上清液,采用BCA试剂盒蛋白定量。取30~40 μg总蛋白进行SDS-PAGE,转膜,5%脱脂奶粉封闭,I抗4℃过夜,再加入II抗室温孵育1 h。最后用ECL曝光成像,化学发光系统分析结果。
1.7 统计学处理
2 结果
2.1 苦参素复合长春新碱对HCT-8/VCR细胞耐药性的影响
HCT-8/VCR细胞在苦参素单药组、长春新碱单药组作用24 h后的IC50值分别为34.16 mg/ml,17.63 μg/ml。苦参素和长春新碱联合组,长春新碱的IC50值为5.462 μg/ml。由此可以得出,苦参素复合长春新碱可降低HCT-8/VCR细胞的耐药性,逆转倍数为3.23(图1)。
2.2 苦参素复合长春新碱对HCT-8/VCR细胞自噬形成的影响
与空白组比较,苦参素组和联合组自噬体含量降低、长春新碱组自噬体含量升高;联合组与苦参素组比较,自噬体含量升高,联合组与长春新碱组比较,自噬体含量降低(图2)。

Fig. 2 Effects of matrine on autophagy of HCT-8/VCR cells
2.3 苦参素复合长春新碱对HCT-8/VCR细胞培养液中IL-6的影响
与空白组比较,苦参素组和联合组HCT-8/VCR细胞培养液中的IL-6水平明显降低(P<0.01)、长春新碱组HCT-8/VCR细胞培养液中的IL-6水平明显升高(P<0.01);联合组与苦参素组比较,HCT-8/VCR细胞培养液中的IL-6水平明显降低(P< 0.01,表1)。

Tab. 1 Content of IL-6 in HCT-8/VCR cell culture medium
2.4 苦参素复合长春新碱对HCT-8/VCR细胞自噬相关蛋白和TLR4表达的影响
自噬相关蛋白P62的表达情况为:与空白组比较,苦参素组P62的表达降低(P<0.05),长春新碱组和联合组P62的表达升高(P<0.05);联合组与苦参素组和长春新碱组比较,P62的表达均升高(P<0.05)。长春新碱单药和空白组相比,自噬相关蛋白P62的表达无明显差异(P>0.05)。
LC3-Ⅱ/LC3-Ⅰ、Beclin-1和TLR4的表达情况为:与空白组比较,苦参素组均表达升高(P<0.05),长春新碱组和联合组均表达降低(P<0.05);联合组与苦参素组和长春新碱组比较,表达均降低(P< 0.05。长春新碱单药和空白组相比LC3-Ⅱ/LC3-Ⅰ、Beclin-1和TLR4的表达无明显差异(P>0.05,图3)。
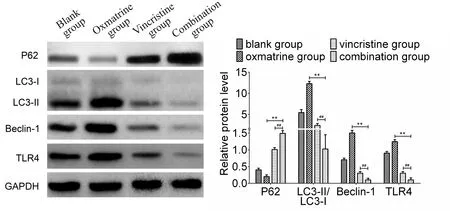
Fig. 3 The expression levels of autophagy-related protein and TLR4 protein in HCT-8/VCR cells
3 讨论
苦参素,分子式是C15H24N2O2·H2O,又称为氧化苦参碱,是由豆科植物苦参的干燥根、植株、果实经乙醇等有机溶剂提取制成的一类具有抗肿瘤、治疗病毒性肝炎、抗肝纤维化、心肌炎等作用的生物碱[4-5]。目前Duo[7]等人研究表明1.00 mg/ml的苦参碱即可抑制肝癌细胞的恶性增殖,而且苦参碱作用时间越长,抑制肝癌细胞的增殖效果越显著,本研究的结果与Duo等人的研究一致。在长春新碱中,加入1.00 mg/ml~10.00 mg/ml的苦参素能显著降低HCT-8/VCR细胞活力,随着苦参素浓度的升高,抑制增殖效果越显著。
自噬是机体自杀性死亡的一种形式,自噬在癌症的发生和发展过程中具有重要的调控作用。目前,研究表明,泛素结合蛋白P62、Bcl-2相互作用蛋白(Bcl-2 interacting coiled-coil protein 1,Beclin-1)和微管相关蛋白1/轻链3(microtubule-associated protein1A/1 B-light chain 3,LC3)在哺乳动物细胞自噬过程中也起着关键的作用[8],其中LC3由可溶型LC3-Ⅰ和脂化型LC3-Ⅱ组成。本研究发现苦参素和长春新碱联合组较单药组,苦参素通过诱导P6表达,降低LC3-Ⅱ/LC3-Ⅰ、Beclin-1表达,从而抑制HCT-8/VCR细胞的自噬。这与国内外许多研究结果一致。许多研究为了进一步验证自噬相关基因的表达与多药耐药蛋白的相关性,直接抑制或敲除这些自噬相关基因,结果表明抑制自噬可增加肿瘤细胞的化疗敏感性[9-11]。此外,Cen[12]等人研究表明肿瘤细胞自噬过程中细胞器内PAMP会与TLR相互作用诱导产生免疫应答,由此我们推测苦参素可能对HCT-8/VCR免疫应答具有一定的抑制作用。
白细胞介素-6(interleukin-6,IL-6)是肿瘤微环境中主要的免疫调节细胞因子之一。目前研究表明肿瘤细胞表达高水平IL-6,可激活相关传导通路如JAK/STAT或NF-κB通路等,从而促进肿瘤细胞增殖、抗凋亡、诱导血管增生、细胞浸润和产生耐药性[13]。本研究加入苦参素后,HCT-8/VCR细胞培养液中IL-6明显降低,增加结肠癌细胞对长春新碱药物的敏感性。这与韩睿[14]等人研究结果一致,他们指出在肺癌裸鼠体内降低IL-6的表达和分泌可以有效提高EGFR-TKI耐药肺癌细胞对EGFR-TKI药物的敏感性。Toll-样受体4(Toll-like receptor 4,TLR4)是目前研究最多的Toll样受体(Toll-like receptors,TLRs),不仅在免疫细胞表达,在肿瘤细胞也有表达。在肿瘤发生发展、免疫逃逸过程中发挥着重要的作用。在肝癌中研究还发现TLR4激动剂LPS通过激活COX-2/PGE2信号轴,进而激活STAT3通路,介导肝癌细胞的增殖及多药耐药的产生[15]。在乳腺癌中研究表明沉默TLR4降低紫杉醇对乳腺癌细胞NF-κB、IL-6和VEGFa的表达,增强乳腺癌细胞对紫杉醇的敏感性[16]。基于以上研究可以推测出抑制肿瘤细胞TLR4信号通路的活化,降低免疫应答水平,可以逆转肿瘤的耐药性。本研究结果发现苦参素和长春新碱联合组较单药组相比,HCT-8/VCR活力降低的同时TLR4和IL-6的表达也降低。这与上述的推测是一致。
综上所述:苦参素可以显著逆转HCT-8/VCR的耐药性,其机制与抑制自噬活动和抑制TLR4信号活化有关。

